PREPARATION METHOD FOR CHLOROPHENOXYCARBOXYLATE
本申请要求于2018年3月19日提交中国专利局、申请号为201810255198.6、发明名称为“一种氯代苯氧羧酸酯的制备方法”的中国专利申请的优先权,其全部内容通过引用结合在本申请中。 本发明涉及除草剂合成技术领域,尤其涉及一种氯代苯氧羧酸酯的制备方法。 目前,氯代苯氧羧酸酯的制备方法主要包括以下几步: 1)以酚为主要原料,经氯化制得氯代酚。此步产出的氯代酚具有极难闻的刺激性气味,导致生产现场环境极差,而且氯化选择性较差。 2)氯代酚在碱性条件下与氯代羧酸缩合,反应液经过酸化、过滤得到氯代苯氧羧酸湿料,烘干后得氯代苯氧羧酸。此步氯代酚中的二氯酚或多氯酚在缩合过程中,会发生两分子间的缩合,产生极难降解的剧毒物质--二噁英,而且生产的氯代苯氧羧酸中也含有二噁英,给环境和生产人员的健康带来了极大的风险。 3)以氯代苯氧羧酸、醇为原料,在催化剂作用下进行酯化反应,反应过程中使用有机溶剂共沸脱水,反应完毕经过水洗、脱溶得到氯代苯氧羧酸酯。在此步氯代苯氧羧酸中含有的二噁英会进入氯代苯氧羧酸酯,并随着氯代苯氧羧酸酯的使用进入植物体、空气、土壤和水源,并随着食物链富集,进而造成更加严重的环境危害。 上述方法氯化选择性差、后处理工艺会造成有效成分损失,产品的收率偏低。同时在使用酚为原料经氯化、缩合合成氯代苯氧羧酸时,会产出大量的含有羟基羧酸和废盐的废水,以及大量含有氯代酚、氯代苯氧羧酸的危废,三废处理压力大、处理成本高。 现有的氯代苯氧羧酸及其酯的合成工艺已经十分落后,随着环保意识、环保标准的不断提高,老旧落后的工艺已经严重制约着氯代苯氧羧酸及其酯的合成产业的良性发展和可持续发展,开发一种先进的合成工艺迫在眉睫。 发明内容 有鉴于此,本发明要解决的技术问题在于提供一种氯代苯氧羧酸酯的制备方法,高效且环保。 为解决以上技术问题,本发明提供了一种氯代苯氧羧酸酯的制备方法,包括以下步骤: 苯氧羧酸酯在催化剂A和催化剂B的作用下,和氯化剂进行2位和/或4位的选择性氯化反应,得到氯代苯氧羧酸酯; 所述催化剂A为路易斯酸; 所述催化剂B为C5~22的硫醚、噻唑、异噻唑、噻吩或它们的卤代衍生物。 本发明中,所述苯氧羧酸酯具有以下式Ⅰ~式Ⅳ任一结构: 其中,R1优选为C1~C3的亚烷基,进一步的,优选为亚甲基(-CH2-),甲基亚甲基(-CH(CH3)-),亚乙基(-CH2-CH2-)或亚丙基(-CH2-CH2-CH2-)。
R优选为C1~C10的烷基或C3~C10的环烷基,更优选为C1~C8的烷基或C3~C8的环烷基,进一步优选的,其为甲基、乙基、丙基、异丙基、正丁基、异丁基、异辛基或环己基。 对应的产物结构如下: 所述催化剂A为路易斯酸;优选为SnCl4、MgCl2、FeCl3、AlCl3、BF3、ZnCl2、TiCl4、SbF5、Al2O3、Fe2O3、TiO2、Pb(OAc)2、Zn(OAc)2和Al2O(OAc)4中的一种或多种;更优选为MgCl2、FeCl3、ZnCl2、SbF5、TiO2和Pb(OAc)2中的一种或多种,进一步优选为FeCl3、TiO2和Pb(OAc)2中的一种或多种。
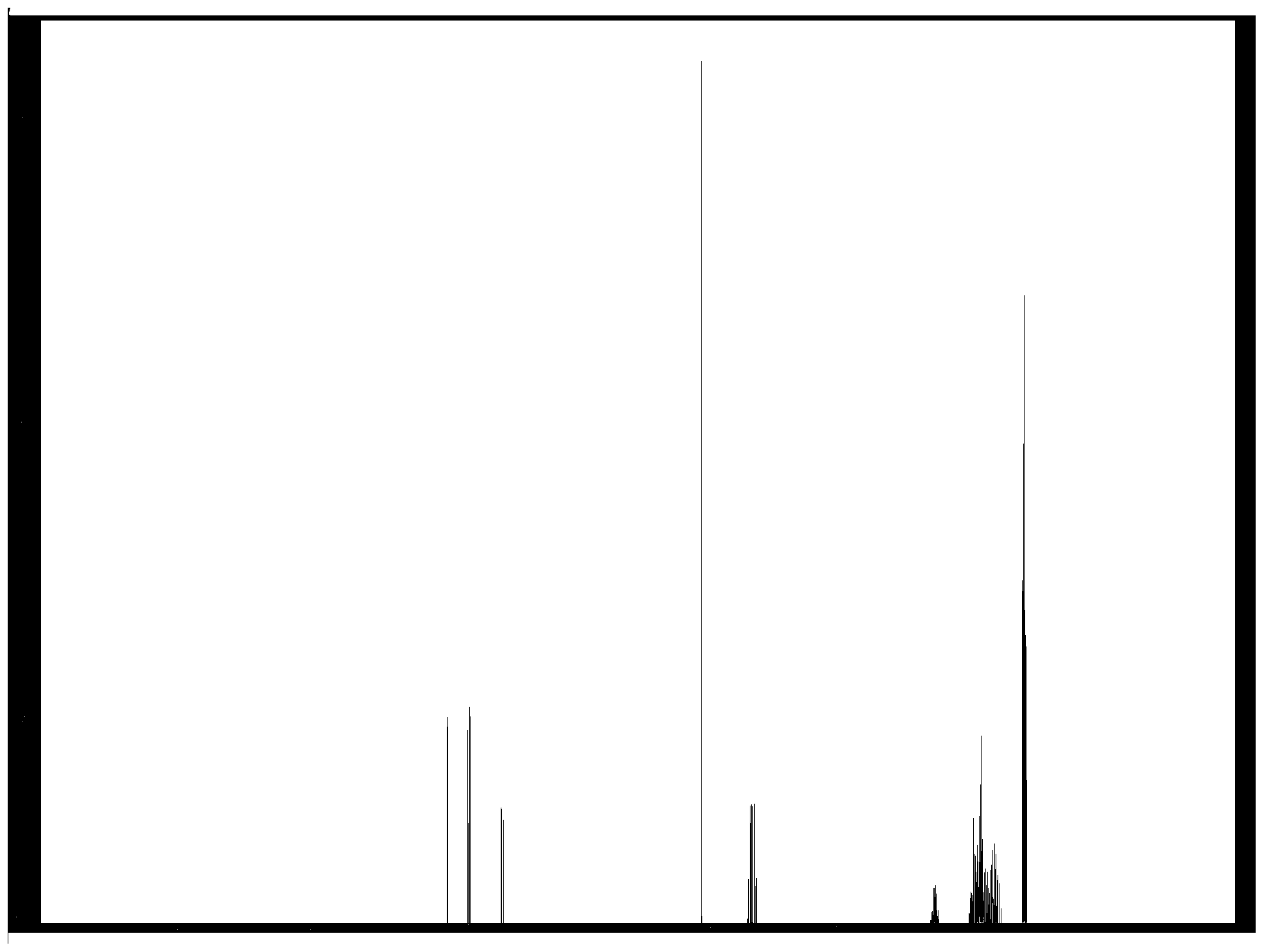
所述催化剂B为C5~22的硫醚、噻唑、异噻唑、噻吩或它们的卤代衍生物;优选为叔丁基甲基硫醚、叔丁基硫醚、苯硫醚、4,4’-二氯苯硫醚、2-甲基苯硫醚、2,4,6-三甲基苯硫醚、4,4'-硫代双(6-叔丁基-3-甲基苯酚)、噻唑、2-乙基噻唑、2,5-二氯噻唑、4-甲基噻唑、2-叔丁基噻唑、异噻唑、4,5-二甲基异噻唑、5-氯异噻唑、2,4,5-三叔丁基异噻唑、噻吩、2-甲基噻吩、2,5-二甲基噻吩、3-氯噻吩、3,4-二氯噻吩和2,3,4-三氯噻吩中的一种或多种;更优选为叔丁基硫醚、2,4,6-三甲基苯硫醚、4,4'-硫代双(6-叔丁基-3-甲基苯酚)、2-乙基噻唑、2,5-二氯噻唑、2,4,5-三叔丁基异噻唑、4,5-二甲基异噻唑、3,4-二氯噻吩和2,3,4-三氯噻吩中的一种或多种;进一步优选为叔丁基硫醚、4,4'-硫代双(6-叔丁基-3-甲基苯酚)、2,4,5-三叔丁基异噻唑和2,3,4-三氯噻吩中的一种或多种。 所述催化剂A的用量优选为苯氧羧酸酯重量的0.05%~1.0%,更优选为0.25%~1.0%,进一步优选为0.5%~1.0%。 所述催化剂B的用量优选为苯氧羧酸酯重量的0.05%~1.0%,更优选为0.2%~0.8%,进一步优选为0.3%~0.5%。 所述催化剂A的用量不宜过少,否则会导致氯化选择性出现大幅下降,但用量过多除了不经济外还会增加产品分离的难度;催化剂B的用量不宜过 少,否则会导致反应不发生或反应缓慢,用量过多不仅不经济还会导致选择性有所降低,同时还会增加产品分离难度。 所述氯化剂可以为苯酚氯化反应的一般氯化剂,优选为氯气、亚硫酰氯或硫酰氯,更优选为氯气或硫酰氯。 所述2位和/或4位的选择性氯化反应,指2位的单取代反应,4位的单取代反应,或2位和4位的双取代反应。 当所述选择性氯化反应为在2位或4位进行单取代反应时,如苯氧羧酸酯的结构如式Ⅰ~式Ⅳ所示,所述苯氧羧酸酯与氯化剂的摩尔比优选为1:(0.98~1.2),更优选为1:(1~1.1),进一步优选为1:(1.01~1.03)。 当所述选择性氯化反应为二取代反应时,如苯氧羧酸酯的结构如式Ⅰ所示,产物为2,4-二氯苯氧羧酸酯,所述苯氧羧酸酯与氯化剂的摩尔比优选为1:(1.98~2.4),更优选为1:(2~2.2),进一步优选为1:(2.02~2.06)。 氯化剂的用量不宜过少,否则会使原料的未转偏高,但是用量过多又会导致较多的过氯化产物的生成,对反应不利。 所述选择性氯化反应的温度优选为-20~100℃,更优选为-20~60℃,进一步优选为-20~20℃。所述反应的时间优选为0.2~1h。 该反应温度可以同时保持较高的反应活性和氯化选择性。 所述选择性氯化反应结束后,优选进行减压蒸馏,收集相应沸程的馏分即可得到氯代苯氧羧酸酯。 本发明通过对工艺路线的重新设计,对催化剂和氯化剂的精细筛选,将路易斯酸与特定催化剂复合使用,使得氯化选择性高达99.5%以上,所得反应物中原料未转含量低于0.1%,反应副产物总含量低于0.5%。 本发明制备的氯代苯氧羧酸酯的杂质及杂质含量如下表1所示: 表1本发明制备的氯代苯氧羧酸酯的杂质及杂质含量汇总 本发明制备的氯代苯氧羧酸酯可以直接作为除草剂产品,也可直接加入助剂做成各种除草剂制剂。 与现有技术相比,本发明提供了一种氯代苯氧羧酸酯的制备方法,包括以下步骤:苯氧羧酸酯在催化剂A和催化剂B的作用下,和氯化剂进行2位和/或4位的选择性氯化反应,得到氯代苯氧羧酸酯;所述催化剂A为路易斯酸;所述催化剂B为C5~22的硫醚、噻唑、异噻唑、噻吩或它们的卤代衍生物。 本发明以苯氧羧酸酯为原料,在催化剂作用下,经选择性氯化合成氯代苯氧羧酸酯,有效地提高了氯化选择性同时避免了有效成分的损失,所得氯代苯氧羧酸酯的含量可达98.5%以上,收率可达99%以上。与现有合成技术相比,工艺路线得到了极大的简化,有效的避免了具有难闻气味的氯代酚的生产和使 用,从根本上杜绝了剧毒的二噁英的产生,同时极大的改善了产品品质和生产现场的操作环境。且不产生含有效成分的母液,因此有效地避免了有效成分的损失,提高了产品的得率,同时由于工艺流程的简化也降低了能耗,有效杜绝了高COD、高盐废水的产生,三废产出得到了极大幅度的降低。 图1为本发明实施例8所得2,4-二氯苯氧乙酸异辛酯的核磁共振氢谱图。 为了进一步说明本发明,下面结合实施例对本发明提供的氯代苯氧羧酸酯的制备方法进行详细描述。 实施例1 向500mL四口瓶中依次加入167.87g 99%的苯氧乙酸甲酯(1mol)、1.43g99%的四氯化锡和1.09g 99%的叔丁基硫醚,于20℃下滴加入237.92g 99%的亚硫酰氯(1.98mol),滴加完毕保温反应30min,于1kpa压力下蒸馏并收集140~150℃的馏分,得2,4-二氯苯氧乙酸甲酯236.07g,含量98.9%,收率以苯氧乙酸甲酯计99.32%。 经检测,其中杂质包括:4-氯苯氧乙酸甲酯含量0.07%,2,6-二氯苯氧乙酸甲酯含量0.03%,2,4,6-三氯苯氧乙酸甲酯含量0.19%,叔丁基硫醚含量0.011%。 比较例1 向500mL四口瓶中依次加入167.87g 99%的苯氧乙酸甲酯(1mol)、2g 99%的四氯化锡,于20℃下滴加入237.92g 99%的亚硫酰氯(1.98mol),滴加完毕保温反应30min,于1kpa压力下蒸馏并收集140~150℃的馏分,得2,4-二氯苯氧乙酸甲酯215.52g,含量98.7%,收率以苯氧乙酸甲酯计90.49%。 比较例2 向500mL四口瓶中依次加入167.87g 99%的苯氧乙酸甲酯(1mol)、2g 99%的叔丁基硫醚,于20℃下滴加入237.92g 99%的亚硫酰氯(1.98mol),滴加完毕保温反应30min,于1kpa压力下蒸馏并收集140~150℃的馏分,得2,4-二氯苯氧乙酸甲酯193.95g,含量98.5%,收率以苯氧乙酸甲酯计81.27%。 实施例2 向500mL四口瓶中依次加入210.38g 99%的苯氧乙酸正丁酯(1mol)、1.58g 99%的氯化锌和2.10g 99%的2,4,6-三甲基苯硫醚,于-20℃下通入77.35g 99%的氯气(1.08mol),通入完毕保温反应30min,于1kpa压力下蒸馏并收集150~160℃的馏分,得4-氯苯氧乙酸正丁酯243.63g,含量98.7%,收率以苯氧乙酸正丁酯计99.07%。 实施例3 向500mL四口瓶中依次加入196.21g 99%的苯氧丁酸甲酯(1mol)、0.29g 99%的氯化铁和0.69g 99%的2-乙基噻唑,于30℃下滴加入275.39g 99%的硫酰氯(2.02mol),滴加完毕保温反应30min,于1kpa压力下蒸馏并收集150~160℃的馏分,得2,4-二氯苯氧丁酸甲酯263.63g,含量99.0%,收率以苯氧丁酸甲酯计99.19%。 实施例4 向500mL四口瓶中依次加入196.21g 99%的2-苯氧基丙酸乙酯(1mol)、1.08g 99%的四氯化钛和0.88g 99%的2,3,4-三氯噻吩,于0℃下通入78.78g 99%的氯气(1.1mol),通入完毕保温反应30min,于1kpa压力下蒸馏并收集145~155℃的馏分,得2-(4-氯苯氧基)丙酸乙酯228.99g,含量99.2%,收率以2-苯氧基丙酸乙酯计99.33%。 实施例5 向500mL四口瓶中依次加入273.52g 99%的2-氯苯氧丁酸异丁酯(1mol)、0.14g 99%的氯化铝和0.41g 99%的2,4,5-三叔丁基异噻唑,于50℃下通入85.94g 99%的氯气(1.2mol),通入完毕保温反应30min,于1kpa压力下蒸馏并收集160~170℃的馏分,得2,4-二氯苯氧丁酸异丁酯305.25g,含量99.4%,收率以2-氯苯氧丁酸异丁酯计99.41%。 实施例6 向500mL四口瓶中依次加入196.21g 99%的2-苯氧基丙酸乙酯(1mol)、0.69g 99%的二氧化钛和1.08g 99%的4,4’-二氯苯硫醚,于60℃下滴加入280.85g 99%的硫酰氯(2.06mol),滴加完毕保温反应30min,于1kpa压力下蒸馏并收集150~160℃的馏分,得2-(2,4-二氯苯氧基)丙酸乙酯263.02g,含量99.3%,收率以2-苯氧基丙酸乙酯计99.26%。 实施例7 向500mL四口瓶中依次加入259.34g 99%的2-(4-氯苯氧基)丙酸正丁酯(1mol)、0.65g 99%的醋酸铅和0.13g 99%的3,4-二氯噻吩,于40℃下滴加入118.96g 99%的亚硫酰氯(0.99mol),滴加完毕保温反应30min,于1kpa压力下蒸馏并收集155~165℃的馏分,得2-(2,4-二氯苯氧基)丙酸正丁酯291.22g,含量99.0%,收率以2-(4-氯苯氧基)丙酸正丁酯计99.01%。 实施例8 向500mL四口瓶中依次加入267.07g 99%的苯氧乙酸异辛酯(1mol)、2.67g 99%的氧化铝和2.27g 99%的4,4’-硫代双(6-叔丁基-3-甲基苯酚),于100℃下通入171.88g 99%的氯气(2.4mol),滴加完毕保温反应30min,于1kpa压力下蒸馏并收集175~185℃的馏分,得2,4-二氯苯氧乙酸异辛酯333.35g,含量99.1%,收率以苯氧乙酸异辛酯计99.12%。 采用核磁共振对制备的2,4-二氯苯氧乙酸异辛酯进行检测,结果见图1,图1为2,4-二氯苯氧乙酸异辛酯的核磁共振氢谱图。 实施例9 向500mL四口瓶中依次加入182.04g 99%的2-甲基苯氧乙酸甲酯(1mol)、0.82g 99%的氯化镁和0.46g 99%的2,5-二氯噻唑,于70℃下滴加入137.70g 99%的硫酰氯(1.01mol),滴加完毕保温反应30min,于1kpa压力下蒸馏并收集140~150℃的馏分,得4-氯-2-甲基苯氧乙酸甲酯214.60g,含量99.4%,收率以2-甲基苯氧乙酸甲酯计99.37%。 实施例10 向500mL四口瓶中依次加入309.59g 99%的2-甲基苯氧丁酸异辛酯(1mol)、2.01g 99%的氧化铁和2.32g 99%的叔丁基甲基硫醚,于80℃下滴加入140.42g 99%的硫酰氯(1.03mol),滴加完毕保温反应30min,于1kpa压力下蒸馏并收集185~195℃的馏分,得4-氯-2-甲基苯氧丁酸异辛酯341.38g,含量99.4%,收率以2-甲基苯氧丁酸异辛酯计99.53%。 由上述实施例可知,本发明提供的制备方法具有较高的收率和纯度,氯化反应的选择性较高。 以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还 可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。 一种氯代苯氧羧酸酯的制备方法,包括以下步骤: 苯氧羧酸酯在催化剂A和催化剂B的作用下,和氯化剂进行2位和/或4位的选择性氯化反应,得到氯代苯氧羧酸酯; 所述催化剂A为路易斯酸; 所述催化剂B为C5~22的硫醚、噻唑、异噻唑、噻吩或它们的卤代衍生物。 根据权利要求1所述的制备方法,其特征在于,所述苯氧羧酸酯具有以下式Ⅰ~式Ⅳ任一结构: 其中, R1为C1~C3的亚烷基;
R为C1~C10的烷基或C3~C10的环烷基。 根据权利要求2所述的制备方法,其特征在于,所述R1为-CH2-,-CH(CH3)-,-(CH2)2-或-(CH2)3-;R为甲基、乙基、丙基、异丙基、正丁基、异丁基、异辛基或环己基。
根据权利要求1所述的制备方法,其特征在于,所述催化剂A为SnCl4、MgCl2、FeCl3、AlCl3、BF3、ZnCl2、TiCl4、SbF5、Al2O3、Fe2O3、TiO2、Pb(OAc)2、Zn(OAc)2和Al2O(OAc)4中的一种或多种。
根据权利要求1所述的制备方法,其特征在于,所述催化剂B为叔丁 基甲基硫醚、叔丁基硫醚、苯硫醚、4,4’-二氯苯硫醚、2-甲基苯硫醚、2,4,6-三甲基苯硫醚、4,4'-硫代双(6-叔丁基-3-甲基苯酚)、噻唑、2-乙基噻唑、2,5-二氯噻唑、4-甲基噻唑、2-叔丁基噻唑、异噻唑、4,5-二甲基异噻唑、5-氯异噻唑、2,4,5-三叔丁基异噻唑、噻吩、2-甲基噻吩、2,5-二甲基噻吩、3-氯噻吩、3,4-二氯噻吩和2,3,4-三氯噻吩中的一种或多种。 根据权利要求1所述的制备方法,其特征在于,所述催化剂A的用量为苯氧羧酸酯重量的0.05%~1.0%;所述催化剂B的用量为苯氧羧酸酯重量的0.05%~1.0%。 根据权利要求1所述的制备方法,其特征在于,所述反应温度为-20~100℃。 根据权利要求1所述的制备方法,其特征在于,所述选择性氯化反应结束后,进行减压蒸馏,得到氯代苯氧羧酸酯。技术领域
背景技术
附图说明
具体实施方式