ANTIBODY SPECIFICALLY BINDING TO C-MET, AND USE THEREOF
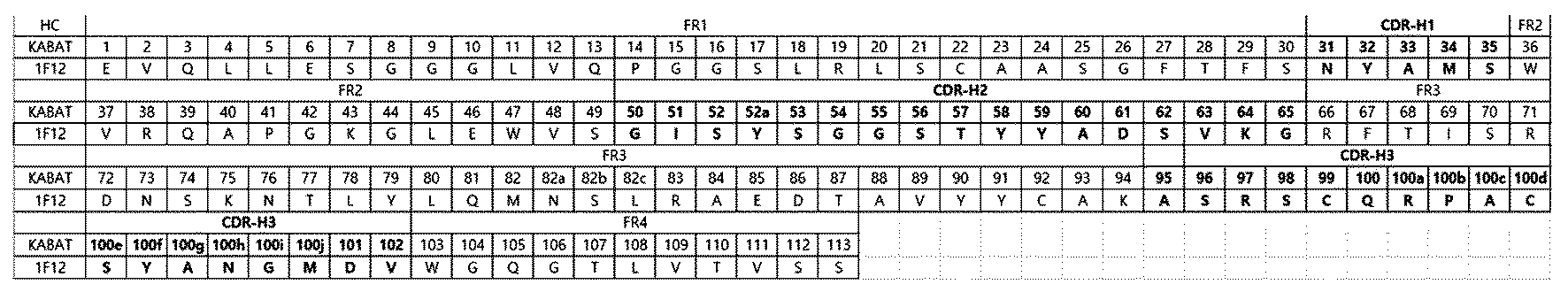
본 발명은 인간 및 마우스 c-Met에 교차결합하는 항-c-Met 항체 및 그 용도에 관한 것으로, 더욱 상세하게는 항-c-Met 항체 또는 이의 항원 결합 단편, 상기 항체 또는 이의 항원 결합 단편을 포함하는 이중특이 항체 또는 항체-약물 접합체, 이를 포함하는 암의 예방 또는 치료용 약학 조성물, 상기 항체 또는 이의 항원 결합 단편을 코딩하는 핵산, 상기 핵산을 포함하는 벡터 및 숙주세포, 이를 이용한 항-c-Met 항체 또는 이의 항원 결합 단편의 제조 방법 및 상기 항-c-Met 항체 또는 이의 항원 결합 단편 및 다른 암 치료제를 포함하는 암 치료용 병용 투여 조성물에 관한 것이다. 간세포성장인자(hepatocyte growth factor; HGF), 표피성장인자(epidermal growth factor; EGF), 혈관내피성장인자(vascular endothelial growth factor; VEGF), 섬유아세포 성장인자(fibroblast growth factor; FGF)와 같은 다양한 성장 인자들은 세포 표면의 수용체 타이로신 키나아제(receptor tyrosine kinase; RTK)들과 상호작용하여 발생단계에서 뿐 아니라 세포 성장, 분화, 혈관신생, 조직 재생 등과 같은 중요한 세포생리적 조절을 유도한다. 이러한 성장인자와 수용체들이 변이, 과발현, 자체활성 촉진 등 생리적인 측면에서 탈조절 될 경우, 비정상적 세포 성장 또는 분화를 야기함으로써 암의 발달을 개시, 촉진시킨다(Lemmon MA & Schlessinger J, Cell. 141:1117-1134, 2010). MET(met proto-oncogene; c-Met) 단백질은 간세포성장인자(HGF)/산란인자(scatter factor; SF) 수용체를 발현하는 원종양유전자로 알려져 있으며(Dean M et al., Nature. 318:385-388, 1985, Gherardi et al., Nat. Rev. Cancer. 12:89-103, 2012), 유일하게 알려진 리간드인 HGF와 상호 작용하여 중간엽-상피 이행(mesenchymalepithelial transition; MET)을 유도하고, 암세포의 성장, 침투, 전이 기능을 촉진한다. c-Met의 경우, 여러 종양의 발달과정에서 리간드인 HGF와 상관없이 발생, 전이, 침습, 신생혈관 유도 등의 기작에도 관여하기 때문에 효과적인 항암 표적으로 여겨지고 있으며, 이러한 배경으로 인해 화학약물, 단클론항체 등과 같은 c-Met 저해제 관련 연구가 활발하다(Comoglio PM et al., Nat. Rev. Drug. Discov. 7:504-516, 2008). 항암표적 c-Met에 대한 길항 항체(antagonistic antibody)의 개발은 대표적인 c-Met 저해에 의한 항암치료 전략이다. 항 c-Met 항체의 경우, 리간드인 HGF와 c-Met의 상호작용을 저해하거나, c-Met을 분해하여 불활성화 시키는 것으로 보고되고 있다. 예를 들어, 항 c-Met 항체로 개발된 ‘OA-5D5’ 한팔 길항 항체(one-armed antagonistic antibody)는 작용제(agonist)로서 c-Met 이량화(dmierization)를 유도하는 부작용을 갖지 않도록 변형된 항체로 개발 되었으며(Martens T et al., Clin. Cancer Res. 15:6144-6152, 2006), ‘DN30’의 경우, c-Met 자체의 불활성화를 유도해 기능을 상실시킴으로써 종양형성 억제를 유도하도록 개발되었다(Petrelli A et al., PNAS. 103:5090-5095, 2006). 하지만 한팔 길항 항체의 경우는 항체 단독 처리에 의한 종양 억제 효과는 미미한 반면, 화학요법과 함께 처리될 때에 유의적인 치료 효과를 보였고, c-Met 불활성화 항체는 리간드와 경쟁하는 양상이 낮고 작용제(agonist)로서의 효과를 부분적으로 보이는 단점이 있는 것으로 확인되었다. 따라서 인간 c-Met의 기능을 억제하는 치료용 항체의 개발은 지속적으로 요구되고 있다. 항암표적 항체 개발에 있어, 이와 같이, c-Met의 기능만을 억제하는 항 c-Met 항체의 경우, 인간 또는 마우스 유래 간세포성장인자의 오토크린(autocrine)/파라크린(paracrine) 작용에 대한 마우스 c-Met 수용체 억제 작용이 없어 마우스 종양모델에서의 전임상 효능 평가시 그 효과를 평가하는데 어려움이 있다. 인간 c-Met(P08581, UniProtKB/Swiss-Prot)은 1,390개, 마우스 c-Met(P16056, UniProtKB/Swiss-Prot)은 1,379개의 아미노산으로 구성되어 있어 서로 89% 이상의 높은 서열 유사성을 갖는다(Chan AML et al., Oncogene. 2:593-599, 1988). 리간드인 간세포성장인자 역시 인간과 마우스 사이에 90% 이상의 매우 높은 서열 유사성이 있으며(Tashiro K et al., PNAS. 87:3200-3204, 1990), 리간드와 수용체가 작용하는 대표적인 위치 역시 세마 부위(Sema domain)이기 때문에 교차반응 항체의 개발 및 적용 가능성이 높다고 할 수 있다. 따라서, 인간/마우스 c-Met에 대한 항체종양 미세 환경 내 암 특이 리간드-수용체 작용을 억제하여 마우스 종양모델에서 효과적인 전임상 연구결과를 확인할 수 있는 인간/마우스 c-Met에 교차반응하는 항체의 개발이 필요하다. 이러한 기술적 배경하에서, 본 발명자들은 인간 및 마우스 c-Met에 교차결합능을 가지며, 친화도 성숙(affinity maturation) 과정을 이용하여 c-Met과의 결합능이 개선된 개량 항체를 개발하고 본 발명을 완성하였다. 본 배경기술 부분에 기재된 상기 정보는 오직 본 발명의 배경에 대한 이해를 향상시키기 위한 것이며, 이에 본 발명이 속하는 기술분야에서 통상의 지식을 가지는 자에게 있어 이미 알려진 선행기술을 형성하는 정보를 포함하지 않을 수 있다. 발명의 요약 본 발명의 목적은 c-Met에 특이적으로 결합하는 항-c-Met 항체 또는 이의 항원 결합 단편을 제공하는 데 있다. 본 발명의 다른 목적은 상기 항체 또는 이의 항원 결합 단편을 포함하는 이중특이 항체 또는 항체-약물 접합체를 제공하는 데 있다. 본 발명의 또 다른 목적은 상기 항-c-Met 항체 또는 이의 항원 결합 단편 및/또는 상기 이중특이 항체 또는 항체-약물 접합체를 포함하는 암의 예방 또는 치료용 약학 조성물 및 치료 방법을 제공하는 데 있다. 본 발명의 또 다른 목적은 상기 항-c-Met 항체 또는 이의 항원 결합 단편을 코딩하는 핵산, 상기 핵산을 포함하는 벡터 및 숙주세포, 이를 이용한 항-c-Met 항체 또는 이의 항원 결합 단편의 제조 방법을 제공하는 데 있다. 본 발명의 또 다른 목적은 상기 항-c-Met 항체 또는 이의 항원 결합 단편 및 다른 암 치료제를 포함하는 암 치료용 병용 투여 조성물 및 치료 방법을 제공하는 데 있다. 본 발명의 또 다른 목적은 암의 치료를 위한 상기 항체 또는 이의 항원 결합 단편 또는 상기 이중특이 항체 또는 상기 항체-약물 접합체의 용도를 제공하는 데 있다. 본 발명의 또 다른 목적은 암 치료용 약제 제조를 위한 상기 항체 또는 이의 항원 결합 단편 또는 상기 이중특이 항체 또는 상기 항체-약물 접합체의 사용을 제공한다. 상기 목적을 달성하기 위하여, 본 발명은 서열번호 1 또는 27의 아미노산 서열을 포함하는 중쇄(heavy chain) CDR1; 서열번호 2 및 28 내지 31로 구성된 군에서 선택된 아미노산 서열을 포함하는 중쇄 CDR2; 서열번호 3, 32 및 33으로 구성된 군에서 선택된 아미노산 서열을 포함하는 중쇄 CDR3를 포함하는 중쇄 가변영역; 및 서열번호 4, 34 및 35로 구성된 군에서 선택된 아미노산 서열을 포함하는 경쇄(light chain) CDR1; 서열번호 5, 36 및 37로 구성된 군에서 선택된 아미노산 서열을 포함하는 경쇄 CDR2; 서열번호 6, 38 및 39로 구성된 군에서 선택된 아미노산 서열을 포함하는 경쇄 CDR3를 포함하는 경쇄 가변영역을 포함하는 항-c-Met 항체 또는 이의 항원 결합 단편을 제공한다. 본 발명은 또한, 상기 항-c-Met 항체 또는 이의 항원 결합 단편을 포함하는 이중특이 항체 또는 항체-약물 접합체를 제공한다. 본 발명은 또한, 상기 항-c-Met 항체 또는 이의 항원 결합 단편 및/또는 상기 이중특이 항체 또는 항체-약물 접합체를 포함하는 암의 예방 또는 치료용 약학 조성물 및 치료 방법을 제공한다. 본 발명은 또한, 상기 항-c-Met 항체 또는 이의 항원 결합 단편을 코딩하는 핵산, 상기 핵산을 포함하는 벡터 및 숙주세포, 이를 이용한 항-c-Met 항체 또는 이의 항원 결합 단편의 제조 방법을 제공한다. 본 발명은 또한, 상기 항-c-Met 항체 또는 이의 항원 결합 단편 및 다른 암 치료제를 포함하는 암 치료용 병용 투여 조성물 및 치료 방법을 제공한다. 본 발명은 또한, 상기 항체 또는 이의 항원 결합 단편 또는 상기 이중특이 항체 또는 상기 항체-약물 접합체를 투여하는 것을 특징으로 하는 암의 치료방법을 제공한다. 본 발명은 또한, 암의 치료를 위한 상기 항체 또는 이의 항원 결합 단편 또는 상기 이중특이 항체 또는 상기 항체-약물 접합체의 용도 및 암 치료용 약제 제조를 위한 상기 항체 또는 이의 항원 결합 단편 또는 상기 이중특이 항체 또는 상기 항체-약물 접합체의 사용을 제공한다. 도 1은 모항체(1F12)의 중쇄 가변영역 서열 및 CDR/Framework 분류를 나타낸 것이다. 도 2는 모항체(1F12)의 경쇄 가변영역 서열 및 CDR/Framework 분류를 나타낸 것이다. 도 3은 항-c-Met 항체의 mutant library 디자인이다. 도 4는 항-c-Met 항체의 mutant library 구축을 위한 프라이머 서열을 나타낸 것이다. 도 5는 항-c-Met 항체 affinity variants의 CDR 서열을 나타낸 것이다. 도 6은 항-c-Met 항체 affinity variants 16종의 agonist activity 분석 결과를 나타낸 것이다. 도 7은 항-c-Met 항체의 affinity 결과를 나타낸 것이다. 도 8은 위암 세포주 성장억제 양상 분석 결과를 나타낸 것이다. 도 9는 대장암 세포주에서 항-c-Met 항체 단독 및 면역치료제와의 병용 효능 분석 결과를 나타낸 것이다. 도 10은 대장암 세포주에서 항-c-Met 항체와 방사선 치료와의 병용 효능을 분석한 결과를 나타낸 것이다. 도 11은 대장암 피하이식 동물모델에서 면역세포 분포에 대한 분석 결과를 나타낸 것이다. 도 12는 대장암 피하이식 동물모델에서 항-c-Met 항체 투여 후 종양세포에서의 PD-L1 발현 변화를 나타낸 것이다. 발명의 상세한 설명 및 바람직한 구현예 다른 식으로 정의되지 않는 한, 본 명세서에서 사용된 모든 기술적 및 과학적 용어들은 본 발명이 속하는 기술분야에서 숙련된 전문가에 의해서 통상적으로 이해되는 것과 동일한 의미를 갖는다. 일반적으로 본 명세서에서 사용된 명명법은 본 기술분야에서 잘 알려져 있고 통상적으로 사용되는 것이다. 항체 효능 향상을 위해 항체공학기술의 응용이 요구된다. 그 중 항원에 대한 항체의 친화도를 성숙 시키는 친화도 성숙(affinity maturation) 방법이 있다. Affinity maturation은 무작위 돌연변이를 항체 유전자에 도입하여 항원에 대한 항체의 결합친화성을 증가시키는 기술을 말하며, 효과적인 치료 및 진단용 항체 신약 개발에 매우 유용하게 사용될 수 있다. 시험관 내 affinity maturation을 위해, 일반적으로 3가지 접근 방법이 사용된다. 오류가 발생하기 쉬운 PCR, 퇴화된 올리고 뉴클레오타이드를 사용하는 표적 잔기의 랜덤화 및 사슬 셔플링(chain shuffling)을 포함한다. 표적 잔기로 선택할 수 있는 부분은 상보성 결정 영역(complementarity determining region, CDR)으로서, 특히 CDR-H3와 CDR-L3이 항체-항원 상호작용을 지배하는 경향이 있으므로 무작위화를 위한 논리적 표적이 된다. 표적이 되는 항체 유전자 CDR 부위에 있는 아미노산을 변화시킴으로써 항체의 결합친화성을 높이는 것이다. 이 방법을 통해 AKA(tumor-associated glycoprotein 72와 결합하는 인간화 항체)의 CDR-H3에 있는 아미노산을 변화시켜 결합친화성을 22배 증가시킨 보고가 있으며(Hong et al., J. Biol. Chem. 2006, 281, 6985-6992), Hepatitis B virus 항원에 대해 개발한 항체 또한 결합친화성을 6배까지 증가시킨 보고가 있다(Hong el al., J. Microbiol. 2007, 45, 528-533). 본 발명은 일 관점에서, c-Met에 특이적으로 결합하는 항-c-Met 항체 또는 이의 항원 결합 단편에 관한 것이다. 바람직하게는, 서열번호 1 또는 27의 아미노산 서열을 포함하는 중쇄(heavy chain) CDR1; 서열번호 2 및 28 내지 31로 구성된 군에서 선택된 아미노산 서열을 포함하는 중쇄 CDR2; 서열번호 3, 32 및 33으로 구성된 군에서 선택된 아미노산 서열을 포함하는 중쇄 CDR3를 포함하는 중쇄 가변영역; 및 서열번호 4, 34 및 35로 구성된 군에서 선택된 아미노산 서열을 포함하는 경쇄(light chain) CDR1; 서열번호 5, 36 및 37로 구성된 군에서 선택된 아미노산 서열을 포함하는 경쇄 CDR2; 서열번호 6, 38 및 39로 구성된 군에서 선택된 아미노산 서열을 포함하는 경쇄 CDR3를 포함하는 경쇄 가변영역을 포함하는 항-c-Met 항체 또는 이의 항원 결합 단편에 관한 것이다. 본 발명에 있어서, 상기 항-c-Met 항체 또는 이의 항원 결합 단편은 서열번호 1 또는 27의 아미노산 서열을 포함하는 중쇄 CDR1; 서열번호 2 및 28 내지 31로 구성된 군에서 선택된 아미노산 서열을 포함하는 중쇄 CDR2; 서열번호 3, 32 및 33으로 구성된 군에서 선택된 아미노산 서열을 포함하는 중쇄 CDR3와 각각 80% 이상의 서열 상동성, 바람직하게는 90% 이상의 서열 상동성, 더욱 바람직하게는 99%의 서열 상동성을 가지는 서열을 포함하는 중쇄 가변영역을 포함하며, 본 발명에 따른 c-Met과 동일한 특성을 가지는 항체 또는 이의 항원 결합 단편도 본 발명에 따른 항-c-Met 항체 또는 이의 항원 결합 단편의 권리범위에 포함된다. 또한, 서열번호 4, 34 및 35로 구성된 군에서 선택된 아미노산 서열을 포함하는 경쇄 CDR1; 서열번호 5, 36 및 37로 구성된 군에서 선택된 아미노산 서열을 포함하는 경쇄 CDR2; 서열번호 6, 38 및 39로 구성된 군에서 선택된 아미노산 서열을 포함하는 경쇄 CDR3와 각각 80% 이상의 서열 상동성, 바람직하게는 90% 이상의 서열 상동성, 더욱 바람직하게는 99%의 서열 상동성을 가지는 서열을 포함하는 경쇄 가변영역을 포함하며, 본 발명에 따른 c-Met과 동일한 특성을 가지는 항체 또는 이의 항원 결합 단편도 본 발명에 따른 항-c-Met 항체 또는 이의 항원 결합 단편의 권리범위에 포함된다. 본 발명에 있어서, 상기 항-c-Met 항체 또는 이의 항원 결합 단편은 서열번호 40 및 42 내지 48로 구성된 군에서 선택된 아미노산 서열을 포함하는 중쇄 가변영역 및 서열번호 41 및 49 내지 54로 구성된 군에서 선택된 경쇄 가변영역을 포함하는 것을 특징으로 할 수 있다. 한편, 서열번호 40 및 42 내지 48로 구성된 군에서 선택된 아미노산 서열을 포함하는 중쇄 가변영역과 80% 이상의 서열 상동성, 바람직하게는 90% 이상의 서열 상동성, 더욱 바람직하게는 99%의 서열 상동성을 가지는 서열을 포함하며, 본 발명에 따른 c-Met과 동일한 특성을 가지는 항체 또는 이의 항원 결합 단편도 본 발명에 따른 항-c-Met 항체 또는 이의 항원 결합 단편의 권리범위에 포함되며, 서열번호 41 및 49 내지 54로 구성된 군에서 선택된 아미노산 서열을 포함하는 경쇄 가변영역과 80% 이상의 서열 상동성, 바람직하게는 90% 이상의 서열 상동성, 더욱 바람직하게는 99%의 서열 상동성을 가지는 서열을 포함하는 경쇄 가변영역을 포함하며, 본 발명에 따른 c-Met과 동일한 특성을 가지는 항체 또는 이의 항원 결합 단편도 본 발명에 따른 항-c-Met 항체 또는 이의 항원 결합 단편의 권리범위에 포함된다. 또한, 본 발명에 따른 항-c-Met 항체 또는 이의 항원 결합 단편에는 본 발명에 따른 항-c-Met 항체 또는 이의 항원 결합 단편에서, 보존적 치환을 통해 아미노산 서열의 일부가 치환된 항체 또는 이의 항원 결합 단편도 포함된다. 본 명세서에서 “보존적 치환”이란 1개 이상의 아미노산을 해당 폴리펩티드의 생물학적 또는 생화학적 기능의 손실을 야기하지 않는 유사한 생화학적 특성을 갖는 아미노산으로 치환하는 것을 포함하는 폴리펩티드의 변형을 의미한다. “보존적 아미노산 치환”은 아미노산 잔기를 유사한 측쇄를 갖는 아미노산 잔기로 대체시키는 치환이다. 유사한 측쇄를 갖는 아미노산 잔기 부류는 해당 기술분야에 규정되어 있으며, 잘 알려져 있다. 이들 부류는 염기성 측쇄를 갖는 아미노산(예를 들어, 라이신, 아르기닌, 히스티딘), 산성 측쇄를 갖는 아미노산(예를 들어, 아스파르트산, 글루탐산), 대전되지 않은 극성 측쇄를 갖는 아미노산(예를 들어, 글리신, 아스파라진, 글루타민, 세린, 트레오닌, 티로신, 시스테인), 비-극성 측쇄를 갖는 아미노산(예를 들어, 알라닌, 발린, 류신, 이소류신, 프롤린, 페닐알라닌, 메티오닌, 트립토판), 베타-분지된 측쇄를 갖는 아미노산(예를 들어, 트레오닌, 발린, 이소류신) 및 방향족 측쇄를 갖는 아미노산(예를 들어, 티로신, 페닐알라닌, 트립토판, 히스티딘)을 포함한다. 본 발명의 항체가 보존적 아미노산 치환을 갖고 여전히 활성을 보유할 수 있음이 예상된다. 본 명세서에서 용어 “c-Met 특이적 항체”는 c-Met에 결합하여 c-Met의 생물학적 활성의 억제를 초래하는 항체를 의미하며, “항-c-Met 항체”와 혼용되어 사용된다. 본 발명에 있어서, “항-c-Met 항체”는 다클론 항체(polyclonal antibody) 및 단클론 항체(단일클론 항체, monoclonal antibody)를 모두 포함하는 개념으로, 바람직하게는 단클론 항체이며, 온전한 전체 항체(whole antibody) 형태를 가질 수 있다. 전체 항체는 2개의 전체 길이의 경쇄 및 2개의 전체 길이의 중쇄를 가지는 구조로서, 불변영역을 포함하는 구조이며, 각각의 경쇄는 중쇄와 다이설파이드 결합으로 연결되어 있다. 본 발명에 따른 항-c-Met 항체의 전체 항체는 IgA, IgD, IgE, IgM 및 IgG 형태를 포함하는 개념으로, IgG는 아형(subtype)으로, IgG1, IgG2, IgG3 및 IgG4를 포함한다. 본 발명에 따른 항-c-Met 항체는 인간 항체 라이브러리(human antibody library)로부터 선별된 완전 인간 항체(fully human antibody)인 것이 바람직하지만, 이에 한정되는 것은 아니다. 본 발명에 따른 항-c-Met 항체의 “항원 결합 단편”은 항-c-Met 항체의 항원, 즉 c-Met과 결합할 수 있는 기능을 보유하고 있는 단편을 의미하며, Fab, Fab', F(ab')2, scFv (scFv)2, scFv-Fc, 및 Fv 등을 포함하는 개념으로, 본 명세서에서는“항체 단편”과 동일한 의미로 혼용되어 사용된다. 상기 Fab은 경쇄 및 중쇄의 가변영역과 경쇄의 불변영역 및 중쇄의 첫 번째 불변영역(CH1 도메인)을 가지는 구조로 1개의 항원 결합 부위를 가진다. Fab'는 중쇄 CH1 도메인의 C 말단에 하나 이상의 시스테인 잔기를 포함하는 힌지 영역(hinge region)을 가진다는 점에서 Fab과 차이가 있다. F(ab')2 항체는 Fab'의 힌지 영역의 시스테인 잔기가 디설파이드 결합을 이루면서 생성된다. 상기 Fv(variable fragment)는 중쇄 가변부위 및 경쇄 가변부위만을 가지고 있는 최소의 항체조각을 의미한다. 이중쇄 Fv(dsFv)는 디설파이드 결합으로 중쇄 가변부위와 경쇄 가변부위가 연결되어 있고, 단쇄 Fv(scFv)는 일반적으로 펩타이드 링커를 통하여 중쇄의 가변영역과 경쇄의 가변영역이 공유 결합으로 연결되어 있다. 이러한 항체 단편은 단백질 가수분해 효소를 이용해서 얻을 수 있고(예를 들어, 전체 항체를 파파인으로 제한 절단하면 Fab를 얻을 수 있고, 펩신으로 절단하면 F(ab')2 단편을 얻을 수 있다), 유전자 재조합 기술(예를 들어, 항체의 중쇄 또는 이의 가변영역을 코딩하는 DNA 및 경쇄 또는 이의 가변 영역을 코딩하는 DNA를 주형으로 하고, 프라이머쌍을 이용하여 PCR(Polymerase Chain Reaction)법에 의해 증폭시키고, 펩티드 링커를 코딩하는 DNA와 양 말단이 각각 중쇄 또는 이의 가변영역 및 경쇄 또는 이의 가변영역과 연결되도록 하는 프라이머쌍을 조합하여 증폭)을 통하여 제작할 수 있다. 본 명세서에서, 용어“중쇄”는 항원에 특이성을 부여하기 위한 충분한 가변영역 서열을 갖는 아미노산 서열을 포함하는 가변영역 도메인 VH 및 3 개의 불변영역 도메인 CH1, CH2 및 CH3를 포함하는 전체길이 중쇄 및 이의 단편을 모두 의미한다. 또한 본 명세서에서 용어“경쇄”는 항원에 특이성을 부여하기 위한 충분한 가변영역 서열을 갖는 아미노산 서열을 포함하는 가변영역 도메인 VL 및 불변영역 도메인 CL을 포함하는 전체길이 경쇄 및 이의 단편을 모두 의미한다. 본 명세서에서, 용어 “상보성 결정 영역(complementarity determining region, CDR)”은 면역글로블린 중쇄 및 경쇄의 고가변 영역(hypervariable region)의 아미노산 서열을 의미한다(Kabat et al., Sequences of Proteins of Immunological Interest, 4th Ed., U.S. Department of Health and Human Services, National Institutes of Health (1987)). 중쇄(CDRH1, CDRH2 및 CDRH3) 및 경쇄(CDRL1, CDRL2 및 CDRL3)에는 각각 3개의 CDRs이 포함되어 있다. CDR은 항체가 항원 또는 에피토프에 결합하는 데 있어서 주요한 접촉 잔기를 제공한다. 본 발명에 있어서, 상기 항-c-Met 항체 또는 이의 항원 결합 단편은 인간 c-Met에 대하여 특이적 결합능을 갖는 것을 특징으로 할 수 있다. 바람직하게는, 인간 c-Met 및 마우스 c-Met에 대하여 교차결합능을 갖는 것을 특징으로 할 수 있으나, 이에 제한되는 것은 아니다. 본 발명은 다른 관점에서, 상기 항-c-Met 항체 또는 이의 항원 결합 단편에 약물이 접합된 항체-약물 접합체(Antibody-drug conjugate, ADC)에 관한 것이다. 항체-약물 접합체(Antibody-drug conjugate, ADC)는 타겟 암세포로 항암 약물을 전달하기 전까지 항암 약물이 항체에 안정적으로 결합되어 있어야 한다. 타겟으로 전달된 약물은 항체로부터 유리되어 타겟 세포의 사멸을 유도해야 한다. 이를 위해서는 약물이 항체에 안정적으로 결합함과 동시에 타겟 세포에서 유리될 때는 타겟 세포의 사멸을 유도할 충분한 세포독성을 가져야 한다. 본 발명에 있어서, 상기 항-c-Met 항체 또는 이의 항원 결합 단편과 항암제 등 약물을 포함하는 세포독성물질은 서로 결합(예컨대, 공유결합, 펩타이드 결합 등에 의함)되어 접합체(conjugate) 또는 융합 단백질(세포독성물질 및/또는 표지물질이 단백질인 경우)의 형태로 사용될 수 있다. 상기 세포독성물질은 암세포, 특히 고형암세포에 대하여 독성을 갖는 모든 물질일 수 있으며, 방사선동위원소, 세포 독소 화합물(small molecule), 세포 독성 단백질, 항암제 등으로 이루어진 군에서 선택된 1종 이상일 수 있으나, 이에 제한되는 것은 아니다. 상기 세포 독소 단백질은 리신(ricin), 사포린(saporin), 젤로닌(gelonin), 모로딘(momordin), 데보가닌 (debouganin), 디프테리아독소, 녹농균독소(pseudomonas toxin) 등으로 이루어진 군에서 선택된 1종 이상일 수 있으나, 이에 제한되는 것은 아니다. 상기 방사선동위원소로는 131I, 188Rh, 90Y 등으로 이루어진 군에서 선택된 1종 이상일 수 있으나, 이에 제한되는 것은 아니다. 상기 세포 독소 화합물은 듀오카마이신(duocarmycin), 모노메틸 아우리스타틴 E(monomethyl auristatin E; MMAE), 모노메틸 아우리스타틴 F(monomethyl auristatin F; MMAF), N2'-디아세틸-N2'-(3-머캅토-1-옥소프로필)메이탄신(N2'-deacetyl-N2'-(3-mercapto-1-oxopropyl)maytansine; DM1), PBD(Pyrrolobenzodiazepine) dimer 등으로 이루어진 군에서 선택된 1종 이상일 수 있으나, 이에 제한되는 것은 아니다. 본 발명에 있어서, 상기 항체-약물 접합체는 본 발명이 속하는 기술분야에 잘 알려진 기술에 따른 것일 수 있다. 본 발명에 있어서, 상기 항체-약물 접합체는 상기 항체 또는 이의 항원 결합 단편이 링커를 통하여 약물과 결합되는 것을 특징으로 할 수 있다. 본 발명에 있어서, 상기 링커는 절단성 링커 또는 비절단성 링커인 것을 특징으로 할 수 있다. 상기 링커는 항-c-Met 항체와 약물 사이를 연결하는 부위로, 예를 들어 상기 링커는 세포 내 조건에서 절단 가능한 형태 즉, 세포 내 환경에서 항체에서 약물이 링커의 절단을 통해 방출될 수 있도록 한다. 상기 링커는 세포 내 환경 예를 들어 리소좀 또는 엔도좀에 존재하는 절단제에 의해 절단될 수 있으며, 세포 내 펩티다아제 또는 프로테아제 효소 예를 들어 리소좀 또는 엔도좀 프로테아제에 의해 절단될 수 있는 펩타이드 링커일 수 있다. 일반적으로 펩타이드 링커는 적어도 2개 이상의 아미노산 길이를 가진다. 상기 절단제는 카텝신 B 및 카텝신 D, 플라스민을 포함할 수 있으며, 펩타이드를 가수분해 하여 약물을 표적 세포 내로 방출할 수 있도록 한다. 상기 펩타이드 링커는 티올 의존성 프로테아제 카텝신-B에 의해 절단될 수 있고, 이는 암 조직에서 고발현되며, 예를 들어 Phe-Leu 또는 Gly-Phe-Leu-Gly 링커가 사용될 수 있다. 또한, 상기 펩타이드 링커는 예를 들어 세포 내 프로테아제에 의해 절단될 수 있는 것으로, Val-Cit 링커이거나 Phe-Lys 링커일 수 있다. 본 발명에 있어서, 상기 절단성 링커는 pH 민감성으로, 특정 pH 값에서 가수분해에 민감할 수 있다. 일반적으로, pH 민감성 링커는 산성 조건에서 가수분해될 수 있음을 나타낸다. 예를 들어, 리소좀에서 가수분해될 수 있는 산성 불안정 링커 예를 들어, 하이드라존, 세미카바존, 티오세미카바존, 시스-아코니틱 아마이드(cis-aconitic amide), 오르쏘에스테르, 아세탈, 케탈 등일 수 있다. 상기 링커는 환원 조건에서 절단될 수도 있으며, 예를 들어 이황화 링커가 이에 해당할 수 있다. SATA(N-succinimidyl-S-acetylthioacetate), SPDP(N-succinimidyl-3-(2-pyridyldithio)propionate), SPDB(N-succinimidyl-3-(2-pyridyldithio)butyrate) 및 SMPT(N-succinimidyl-oxycarbonyl-alpha-methyl-alpha-(2-pyridyl-dithio)toluene)를 사용하여 다양한 이황화 결합이 형성될 수 있다. 본 발명에 있어서, 상기 약물 및/또는 약물-링커는 항체의 라이신을 통해 무작위로 접합되거나, 이황화 결합 사슬을 환원하였을 때 노출되는 시스테인을 통해 접합될 수 있다. 경우에 따라서, 유전공학적으로 제작된 태그 예를 들어, 펩타이드 또는 단백질에 존재하는 시스테인을 통해 링커-약물이 결합될 수 있다. 상기 유전공학적으로 제작된 태그 예를 들어, 펩타이드 또는 단백질은 예를 들어, 이소프레노이드 트랜스퍼라제에 의하여 인식될 수 있는 아미노산 모티프를 포함할 수 있다. 상기 펩타이드 또는 단백질은 펩타이드 또는 단백질의 카복시 말단에서 결실(deletion)을 가지거나, 펩타이드 또는 단백질의 카복시(C) 말단에 스페이서 유닛의 공유결합을 통한 부가를 갖는다. 상기 펩타이드 또는 단백질은 아미노산 모티프와 바로 공유결합 되거나, 스페이서 유닛과 공유결합 되어 아미노산 모티프와 연결될 수 있다. 상기 아미노산 스페이서 유닛은 1 내지 20개의 아미노산으로 구성되며, 그 중에서 글리신(glycine) 유닛이 바람직하다. 상기 링커는 리소좀에서 다수 존재하거나, 또는 몇몇 종양세포에서 과발현되는 베타-글루쿠로니데이즈(β-glucuronidase)에 의해 인식되어 가수분해 되는 베타-글루쿠로나이드 링커를 포함할 수 있다. 펩타이드 링커와는 달리 친수성(hydrophilicity)이 커서 소수성의 성질이 높은 약물과 결합시 항체-약물 복합체의 용해도를 증가시킬 수 있는 장점을 지닌다. 이와 관련하여, 본 발명에서는 대한민국 특허공개공보 제2015-0137015호에 개시된 베타-글루쿠로나이드 링커, 예를 들어 자가-희생기(self-immolative group)를 포함하는 베타-글루쿠로나이드 링커를 사용할 수 있다. 또한, 상기 링커는 예를 들어 비절단성 링커일 수 있으며, 항체 가수분해 한 단계만을 통해 약물이 방출되어, 예를 들어 아미노산-링커-약물 복합체를 생산한다. 이러한 유형의 링커는 티오에테르기 또는 말레이미도카프로일기(maleimidocaproyl)일 수 있고, 혈액 내 안정성을 유지할 수 있다. 본 발명에 있어서, 상기 약물은 화학요법제, 독소, 마이크로 RNA(miRNA), siRNA, shRNA 또는 방사성 동위원소인 것을 특징으로 할 수 있다. 상기 약물은 약리학적 효과를 나타내는 제제로 항체에 결합될 수 있다. 상기 화학요법제는 세포독성 제제 또는 면역억제제일 수 있다. 구체적으로 마이크로투불린 억제제, 유사분열 억제제, 토포이소머라아제 억제제, 또는 DNA 인터컬레이터로서 기능할 수 있는 화학요법제를 포함할 수 있다. 또한, 면역조절 화합물, 항암제, 항바이러스제, 항박테리아제, 항진균제, 구충제 또는 이들의 조합을 포함할 수 있다. 상기 약물에는 예를 들어, 마이탄시노이드, 오리스타틴, 아미노프테린, 악티노마이신, 블레오마이신, 탈리도마이드, 캄프토쎄신, N8-아세틸 스퍼미딘, 1-(2 클로로에틸)-1,2-다이메틸 술포닐 하이드라자이드, 에스퍼라마이신, 에토포사이드, 6-머캅토퓨린, 돌라스타틴, 트리코테센, 칼리케아미신, 탁솔(taxol), 탁산, 파클리탁셀(paclitaxel), 도세탁셀(docetaxel), 메토트렉세이트, 빈크리스틴, 빈블라스틴, 독소루비신, 멜팔란, 클로람부실, 듀오카마이신, L-아스파라기나제(L-asparaginase), 머캡토퓨린(mercaptopurine), 티오구아닌(thioguanine), 하이드록시우레아(hydroxyurea), 시타라빈(cytarabine), 사이클로포스파미드(cyclophosphamide), 이포스파미드(ifosfamide), 니트로소우레아(nitrosourea), 시스플라틴(cisplatin), 카보플라틴(carboplatin), 미토마이신(mitomycin; 미토마이신 A, 미토마이신 C), 다카바진(dacarbazine), 프로카바진(procarbazine), 토포테칸(topotecan), 질소 머스터드(nitrogen mustard), 사이톡산(cytoxan), 5-플루오로우라실(5-fluorouracil), CNU(bischloroethylnitrosourea), 이리노테칸(irinotecan), 캄포토테신(camptothecin), 이다루비신(idarubicin), 다우노루비신(daunorubicin), 닥티노마이신(dactinomycin), 플리카마이신(plicamycin), 아스파라기나제(asparaginase), 비노렐빈(vinorelbine), 클로로람부실(chlorambucil), 멜파란(melphalan), 카르무스틴(carmustine), 로무스틴(lomustine), 부설판(busuLfan), 트레오설판(treosulfan), 데카바진(decarbazine), 테니포시드(teniposide), 토포테칸(topotecan), 9-아미노캠프토테신(9-aminocamptothecin), 크리스나톨(crisnatol), 트리메트렉세이트(trimetrexate), 마이코페놀산(mycophenolic acid), 티아조퓨린(tiazofurin), 리바비린(ribavirin), EICAR(5-ethynyl-1-beta-Dribofuranosylimidazole-4-carboxamide), 하이드록시우레아(hydroxyurea), 데프록사민(deferoxamine), 플룩수리딘(floxuridine), 독시플루리딘(doxifluridine), 랄티트렉세드(raltitrexed), 시타라빈(cytarabine(ara C)), 시토신 아라비노시드(cytosine arabinoside), 플루다라빈(fludarabine), 타목시펜(tamoxifen), 라록시펜(raloxifene), 메게스트롤(megestrol), 고세렐린(goserelin), 류프롤리드 아세테이트(leuprolide acetate), 플루타미드(flutamide), 바이칼루타마이드(bicalutamide), EB1089, CB1093, KH1060, 베르테포르핀(verteporfin), 프탈로시아닌(phthalocyanine), 광감작제 Pe4(photosensitizer Pe4), 데메톡시-하이포크레린 A(demethoxy-hypocrellin A), 인터페론-α(Interferon-α), 인터페론-γ(Interferon-γ), 종양 괴사 인자(tumor necrosis factor), 젬시타빈(Gemcitabine), 벨케이드(velcade),레블리미드(Revlimid), 로바스타틴(lovastatin), 1-메틸-4-페닐피리디늄 이온(1-methyl-4-phenylpyridiniumion), 스타우로스포린(staurosporine), 악티노마이신 D(actinomycin D), 닥티노마이신(dactinomycin), 블레오마이신 A2(bleomycin A2), 블레오마이신 B2(bleomycinB2), 페플로마이신(peplomycin), 에피루비신(epirubicin), 피라루비신(pirarubicin), 조루비신(zorubicin), 마이토산트론(mitoxantrone), 베라파밀(verapamil) 및 탑시가르긴(thapsigargin), 핵산 분해 효소 및 세균이나 동식물 유래의 독소로 구성된 군에서 선택된 하나 이상일 수 있으나, 이에 한정되는 것은 아니다. 본 발명에 있어서, 상기 약물은 링커 및 링커 시약 상의 친전자성 기와 공유결합을 형성하기 위해 반응할 수 있는 아민, 티올, 히드록실, 히드라지드, 옥심, 히드라진, 티오세미카바존, 히드라진 카르복실레이트, 및 아릴히드라지드기로 구성된 군에서 선택된 하나 이상의 친핵기를 포함할 수 있다. 본 발명은 또 다른 관점에서, 상기 항-c-Met 항체 또는 이의 항원 결합 단편을 포함하는 이중특이 항체(Bispecific antibody)에 관한 것이다. 본 발명에 있어서, 상기 이중특이 항체는 항체의 2개의 암(arm) 중에서, 하나의 암(arm)은 본 발명에 따른 항-c-Met 항체 또는 이의 항원 결합 단편을 포함하고, 나머지 다른 암(arm)은 c-Met 이외의 다른 항원, 바람직하게는 암 관련 항원 또는 면역관문 단백질 항원에 특이적인 항체, 또는 면역효능세포 관련 항원에 특이적으로 결합하는 항체 또는 이의 항원 결합 단편을 포함하는 형태를 의미한다. 상기 이중항체에 포함되는 항-c-Met 항체 이외의 항체가 결합하는 항원은, 바람직하게는 암 관련 항원 또는 면역관문 단백질 항원으로 HGF, EGFR, EGFRvIII, Her2, Her3, IGF-1R, VEGF, VEGFR-1, VEGFR-2, VEGFR-3, Ang2, Dll4, NRP1, FGFR, FGFR2, FGFR3, c-Kit, MUC1, MUC16, CD20, CD22, CD27, CD30, CD33, CD40, CD52, CD70, CD79, DDL3, Folate R1, Nectin 4, Trop2, gpNMB, Axl, BCMA, PD-1, PD-L1, PD-L2, CTLA4, BTLA, 4-1BB, ICOS, GITR, OX40, VISTA, TIM-3, LAG-3, KIR, B7.1, B7.2, B7-H2, B7-H3, B7-H4, B7-H6, B7-H7, EphA2, EphA4, EphB2, E-셀렉틴(selectin), EpCam, CEA, PSMA, PSA, c-MET 등에서 선택될 수 있고, 면역효능세포 관련 항원으로는 TCR/CD3, CD16(FcγRIIIa) CD44, CD56, CD69, CD64(FcγRI), CD89, CD11b/CD18(CR3) 등이 선택될 수 있지만, 이에 한정되는 것은 아니다. 본 발명은 또 다른 관점에서, 상기 항-c-Met 항체 또는 이의 항원 결합 단편을 포함하는 암의 예방 및/또는 치료용 약학 조성물에 관한 것이다. 본 발명은 또 다른 관점에서, 상기 이중특이 항체 또는 항체-약물 접합체를 포함하는 암의 예방 및/또는 치료용 약학 조성물에 관한 것이다. 본 발명에 있어서, 상기 암은 c-Met의 발현 또는 과발현과 관련된 것일 수 있다. 본 발명에 있어서, “암”과 “종양”은 동일한 의미로 사용되며, 전형적으로 조절되지 않은 세포 성장/증식을 특징으로 하는 포유동물의 생리학적 상태를 지칭하거나 의미한다. 본 발명에 있어서, 상기 항-c-Met 항체는 높은 항-c-Met 결합 및 이에 따른 c-Met 기능 억제로 인해 다양한 암종 유래의 암세포의 성장을 억제하며, c-Met과 하부 신호 전달물질들의 인산화를 억제함으로써 c-Met 신호전달을 억제하고, 신생혈관 형성을 억제한다. 따라서, 본 발명의 항체는 암의 예방 및 치료에 매우 유효하다. 본 발명의 조성물로 치료할 수 있는 암 또는 암종은 특별히 제한되지 않으며, 고형암 및 혈액암을 모두 포함한다. 이러한 암의 예로는 유방암, 대장암, 폐암, 위암, 간암, 혈액암, 골암, 췌장암, 피부암, 뇌암, 자궁암, 비인두암, 후두암, 결장암, 난소암, 직장암, 대장암, 질암, 소장암, 내분비암, 갑상선암, 부갑상선암, 요관암, 요도암, 전립선암, 기관지암, 방광암, 신장암 및 골수암을 포함할 수 있으나, 이에 한정되는 것은 아니다. 상기 암은 원발성 암 또는 전이성 암일 수 있다. 보다 바람직하게는, 상기 약학 조성물에 의해 예방 또는 치료될 수 있는 암은 c-Met 발현 암인 것을 특징으로 할 수 있다. 본 발명에 있어서, 상기 약학 조성물은 방사선을 사용한 병용 치료에 사용되는 것을 특징으로 할 수 있다. 본 발명은 또 다른 관점에서, 상기 항-c-Met 항체 또는 이의 항원 결합 단편 및/또는 상기 이중특이 항체 또는 항체-약물 접합체의 치료적 유효량을 c-Met 관련 질병의 예방 및/또는 치료를 필요로 하는 환자에게 투여하는 단계를 포함하는, c-Met 관련 질병의 예방 및/또는 치료 방법에 관한 것이다. 상기 예방 및/또는 치료 방법은 상기 투여 단계 이전에 상기 질병의 예방 및/또는 치료를 필요로 하는 환자를 확인하는 단계를 추가로 포함할 수 있다. 본 발명에 있어서, 상기 치료 방법은 항-c-Met 항체 또는 이의 항원 결합 단편을 포함하는 약학 조성물을 투여하는 단계; 및 방사선을 조사하는 단계;를 포함하는 것을 특징으로 할 수 있다. 상기 방사선은 조사(irradiation)량이 2Gy~10Gy인 것을 특징으로 할 수 있으나, 이에 제한되는 것은 아니다. 본 발명의 방법은 방사선 치료횟수 및 방사선 치료와 약학 조성물 투여 사이의 시간량은 본 발명의 방법에 따라 다양할 수 있으나, 바람직하게는 방사선 조사와 동시에 약학 조성물을 투여하거나, 약학 조성물을 투여한 후 10일~20일 후에 방사선을 조사하는 것을 특징으로 할 수 있으나, 이에 제한되는 것은 아니다. 본 발명은 또 다른 관점에서, 암의 치료를 위한 상기 항체 또는 이의 항원 결합 단편 상기 이중특이 항체 또는 항체-약물 접합체의 용도에 관한 것이다. 본 발명은 또 다른 관점에서, 암 치료용 약제 제조를 위한 상기 항체 또는 이의 항원 결합 단편 상기 이중특이 항체 또는 항체-약물 접합체의 사용에 관한 것이다. 본 발명에 따른 상기 약학 조성물, 치료 방법 및 용도에 있어서, 상기 항-c-Met 항체 또는 이의 항원 결합 단편은 단독 유효성분으로 제공되거나, 항암제 등의 세포독성 물질과 병용 투여 되거나, 항암제 등의 세포독성물질과 접합된 접합체(antibody-drug conjugate; ADC) 형태로 제공될 수 있다. 본 발명에 따른 항-c-Met 항체 또는 이의 항원 결합 단편, 및 이를 포함하는 약학 조성물은 종래의 치료제와 병용하여 사용하는 용도로 사용될 수 있다. 즉, 본 발명에 따른 항-c-Met 항체 또는 이의 항원 결합 단편, 및 이를 포함하는 약학 조성물은 기존의 항암제 등의 치료제와 동시에 투여되거나, 순차적으로 투여되는 용도로 사용될 수 있다. 본 발명에 있어서, 상기 약학 조성물은 치료 유효량의 항-c-Met 항체 또는 이의 항원 결합 단편, 및 약제학적으로 허용되는 담체를 포함하는 것을 특징으로 할 수 있다. 상기 “약제학적으로(제약상) 허용되는 담체”는 제제를 제제화하거나 또는 안정화시키는 것을 돕기 위해서 활성 성분에 추가될 수 있는 물질이고, 환자에게 유의한 해로운 독성 효과를 야기하지 않는다. 약제학적으로 허용되는 담체는 제제시에 통상적으로 이용되는 것으로서, 락토스, 덱스트로스, 수크로스, 솔비톨, 만니톨, 전분, 아카시아 고무, 인산 칼슘, 알기네이트, 젤라틴, 규산칼슘, 미세결정성 셀룰로스, 폴리비닐피롤리돈, 셀룰로스, 물, 시럽, 메틸 셀룰로스, 메틸히드록시벤조에이트, 프로필히드록시벤조에이트, 활석, 스테아르산 마그네슘 및 미네랄 오일 등을 포함하나, 이에 한정되는 것은 아니다. 상기 약학 조성물은 상기 성분들 이외에 윤활제, 습윤제, 감미제, 향미제, 유화제, 현탁제, 보존제 등을 추가로 포함할 수 있다. 적합한 약제학적으로 허용되는 담체 및 제제는 Remington's Pharmaceutical Sciences(19th ed., 1995)에 상세히 기재되어 있다. 본 발명의 약학 조성물은 비경구로 투여할 수 있고, 예컨대 정맥 내 주입, 피하 주입, 근육 주입, 복강 주입 등으로 투여할 수 있다. 본 발명의 약학 조성물의 적합한 투여량은 제제화 방법, 투여 방식, 환자의 연령, 체중, 성, 병적 상태, 음식, 투여 시간, 투여 경로, 배설 속도 및 반응 감응성과 같은 요인들에 의해 다양하며, 보통으로 숙련된 의사는 소망하는 치료 또는 예방에 효과적인 투여량을 용이하게 결정 및 처방할 수 있다. 본 발명의 바람직한 구현예에 따르면, 본 발명의 약제학적 조성물의 1일 투여량은 0.0001 내지 100 ㎎/㎏이다. 본 명세서에서 용어 “약제학적 유효량”은 암의 예방 또는 치료하는 데 충분한 양을 의미한다. 본 발명의 약학 조성물은 당해 발명이 속하는 기술분야에서 통상의 지식을 가진 자가 용이하게 실시할 수 있는 방법에 따라, 약제학적으로 허용되는 담체 및/또는 부형제를 이용하여 제제화 함으로써 단위 용량 형태로 제조되거나 또는 다용량 용기 내에 내입시켜 제조될 수 있다. 이때 제형은 오일 또는 수성 매질중의 용액, 현탁액 또는 유화액 형태이거나 엑스제, 산제, 좌제, 분말제, 과립제, 정제 또는 캅셀제 형태일 수도 있으며, 분산제 또는 안정화제를 추가적으로 포함할 수 있다. 본 발명은 또 다른 관점에서, 본 발명에 따른 항-c-Met 항체를 코딩하는 핵산에 관한 것이다. 본 명세서에서 사용되는 핵산은 세포, 세포 용해물(lysate) 중에 존재하거나, 또는 부분적으로 정제된 형태 또는 실질적으로 순수한 형태로 존재할 수도 있다. 핵산은 알칼리/SDS 처리, CsCl 밴드화(banding), 컬럼 크로마토그래피, 아가로스 겔 전기 영동 및 해당 기술분야에 잘 알려진 기타의 것을 포함하는 표준 기술에 의해 다른 세포 성분 또는 기타 오염 물질, 예를 들어 다른 세포의 핵산 또는 단백질로부터 정제되어 나올 경우 “단리”되거나 “실질적으로 순수하게 된” 것이다. 본 발명의 핵산은 예를 들어 DNA 또는 RNA일 수 있으며, 인트론 서열을 포함하거나 포함하지 않을 수 있다. 본 발명에 있어서, 상기 항-c-Met 항체를 코딩하는 핵산은 서열번호 55 내지 69로 구성된 군에서 선택된 서열을 포함하는 것을 특징으로 할 수 있다. 구체적으로, 본 발명에 따른 항체의 중쇄를 코딩하는 폴리뉴클레오티드 서열은 서열번호 55 또는 57 내지 63 및/또는 본 발명에 따른 항체의 경쇄를 코딩하는 폴리뉴클레오티드 서열은 서열번호 56 또는 64 내지 69이다. 본 발명은 또 다른 관점에서, 상기 핵산을 포함하는 재조합 발현 벡터에 관한 것이다. 본 발명에 따른 항-c-Met 항체 또는 이의 항원 결합 단편의 발현을 위하여, 부분적이거나 전장인 경쇄 및 중쇄를 코딩하는 DNA를 표준 분자 생물학 기술(예를 들어 PCR 증폭 또는 목적 항체를 발현하는 하이브리도마를 사용한 cDNA 클로닝)로 수득할 수 있으며, DNA가 전사 및 번역 제어 서열에 “작동되도록 결합”되어 발현 벡터 내로 삽입될 수 있다. 본 명세서에서 사용되는 용어 “작동되도록 결합”은 벡터 내의 전사 및 번역 제어 서열이 항체 유전자의 전사 및 번역을 조절하는 의도된 기능을 하도록 항체를 코딩하는 유전자가 벡터 내로 라이게이션된다는 것을 의미할 수 있다. 발현 벡터 및 발현 제어 서열은 사용되는 발현용 숙주세포와 상용성 있도록 선택된다. 항체의 경쇄 유전자 및 항체의 중쇄 유전자는 별개의 벡터 내로 삽입되거나, 두 유전자 모두 동일한 발현 벡터 내로 삽입된다. 항체는 표준 방법(예를 들어 항체 유전자 단편 및 벡터 상의 상보성 제한 효소 부위의 라이게이션, 또는 제한 효소 부위가 전혀 존재하지 않을 경우 블런트(blunt) 말단 라이게이션)으로 발현 벡터 내로 삽입된다. 경우에 따라서, 상기 재조합 발현 벡터는 숙주세포로부터의 항체 사슬의 분비를 용이하게 하는 신호 펩티드를 코딩할 수 있다. 항체 사슬 유전자는 신호 펩티드가 프레임에 맞게 항체 사슬 유전자의 아미노 말단에 결합되도록 벡터 내로 클로닝될 수 있다. 신호 펩티드는 면역글로불린 신호 펩티드 또는 이종성 신호 펩티드(즉, 면역글로불린 외 단백질 유래의 신호 펩티드)일 수 있다. 또한, 상기 재조합 발현 벡터는 숙주세포에서 항체 사슬 유전자의 발현을 제어하는 조절서열을 지닌다. “조절서열”은 항체 사슬 유전자의 전사 또는 번역을 제어하는 프로모터, 인핸서 및 기타 발현 제어 요소(예를 들어 폴리아데닐화 신호)를 포함할 수 있다. 통상의 기술자는 형질전환시킬 숙주세포의 선택, 단백질의 발현 수준 등과 같은 인자에 따라 조절 서열을 달리 선택하여, 발현 벡터의 디자인이 달라질 수 있음을 인식할 수 있다. 본 발명은 또 다른 관점에서, 상기 핵산 또는 상기 벡터를 포함하는 숙주세포에 관한 것이다. 본 발명에 따른 숙주세포는 동물세포, 식물세포, 효모, 대장균 및 곤충세포로 구성된 군에서 선택되는 것이 바람직하지만, 이에 한정되는 것은 아니다. 구체적으로는 본 발명에 따른 숙주세포는 대장균, 바실러스 서브틸리스(Bacillus subtilis), 스트렙토마이세스 속(Streptomyces sp.), 슈도모나스 속(Pseudomonas sp.), 프로테우스 미라빌리스(Proteus mirabilis) 또는 스타필로코쿠스 속(Staphylococcus sp.)과 같은 원핵 세포일 수 있다. 또한, 아스페르길러스 속(Aspergillus sp.)과 같은 진균, 피치아 파스토리스(Pichia pastoris), 사카로마이세스 세레비지애(Saccharomyces cerevisiae), 쉬조사카로마세스 속(Schizosaccharomyces sp.) 및 뉴로스포라 크라사(Neurospora crassa)와 같은 효모, 그 밖의 하등진핵 세포, 및 곤충으로부터의 세포와 같은 고등 진핵생물의 세포와 같은 진핵 세포일 수 있다. 또한 식물이나 포유동물로부터 유래할 수 있다. 바람직하게는, 원숭이 신장 세포7(COS7: monkey kidney cells)세포, NSO 세포, SP2/0 세포, 차이니즈 햄스터 난소(CHO: Chinese hamster ovary) 세포, W138, 어린 햄스터 신장(BHK: baby hamster kidney)세포, MDCK, 골수종 세포주, HuT 78 세포 및 HEK293 세포 등이 이용 가능하지만 이에 한정되지 않는다. 특히 바람직하게는 CHO 세포가 사용될 수 있다. 상기 핵산 또는 상기 벡터는 숙주세포에 형질주입 또는 트랜스펙션(transfection)된다. “형질주입” 또는 “트랜스펙션”시키기 위해 원핵 또는 진핵 숙주세포 내로 외인성 핵산(DNA 또는 RNA)을 도입하는 데에 통상 사용되는 여러 종류의 다양한 기술, 예를 들어 전기 영동법, 인산칼슘 침전법, DEAE-덱스트란 트랜스펙션 또는 리포펙션(lipofection) 등을 사용할 수 있다. 본 발명에 따른 항-글리피칸 3 항체를 발현시키기 위해 다양한 발현 숙주/벡터 조합이 이용될 수 있다. 진핵숙주에 적합한 발현 벡터로는 이들로 한정되는 것은 아니지만 SV40, 소 유두종바이러스, 아네노바이러스, 아데노-연관 바이러스(adeno-associated virus), 시토메갈로바이러스 및 레트로바이러스로부터 유래된 발현 조절 서열이 포함된다. 세균 숙주에 사용할 수 있는 발현 벡터에는 pET, pRSET, pBluescript, pGEX2T, pUC벡터, col E1, pCR1, pBR322, pMB9 및 이들의 유도체와 같이 대장균(Escherichia coli)에서 얻어지는 세균성 플라스미드, RP4와 같이 보다 넓은 숙주 범위를 갖는 플라스미드, λgt10과 λgt11, NM989와 같은 매우 다양한 파지 람다(phage lambda) 유도체로 예시될 수 있는 파지 DNA, 및 M13과 필라멘트성 단일가닥의 DNA 파지와 같은 기타 다른 DNA 파지가 포함된다. 효모 세포에 유용한 발현 벡터는 2℃ 플라스미드 및 그의 유도체이다. 곤충 세포에 유용한 벡터는 pVL941이다. 본 발명은 또 다른 관점에서, 상기 숙주세포를 배양하여 본 발명에 따른 항-c-Met 항체 또는 이의 항원 결합 단편을 발현시키는 단계를 포함하는 항-c-Met 항체 또는 이의 항원 결합 단편의 제조 방법에 관한 것이다. 상기 항-c-Met 항체 또는 이의 항원 결합 단편을 발현할 수 있는 재조합 발현 벡터가 포유류 숙주세포 내로 도입될 경우 항체는 숙주세포에서 항체가 발현되게 하기에 충분한 기간 동안, 또는 더 바람직하게는 숙주세포가 배양되는 배양 배지 내로 항체가 분비되게 하기에 충분한 기간 동안 숙주세포를 배양함으로써 제조될 수 있다. 경우에 따라서, 발현된 항체는 숙주세포로부터 분리하여 균일하도록 정제할 수 있다. 상기 항체의 분리 또는 정제는 통상의 단백질에서 사용되고 있는 분리, 정제 방법, 예를 들어 크로마토그래피에 의해 수행될 수 있다. 상기 크로마토그래피는 예를 들어, 프로틴 A 컬럼, 프로틴 G 컬럼을 포함하는 친화성 크로마토그래피, 이온 교환 크로마토그래피 또는 소수성 크로마토그래피를 포함할 수 있다. 상기 크로마토그래피 이외에, 추가로 여과, 초여과, 염석, 투석 등을 조합함으로써 항체를 분리, 정제할 수 있다. 본 발명에 따른 항-c-Met 항체 또는 이의 항원 결합 단편 및 이를 포함하는 약학 조성물은 종래의 치료제와 병용하여 사용하는 용도로 사용될 수 있다. 따라서, 본 발명은 또 다른 관점에서, 상기 항-c-Met 항체 또는 이의 항원 결합 단편 및 다른 암 치료제를 포함하는 암 치료용 병용 투여 조성물 및 치료 방법에 관한 것이다. 상기 다른 암 치료제는 본 발명에 따른 항-c-Met 항체 또는 이의 항원 결합 단편 이외에, 암 치료를 위해 사용될 수 있는 모든 치료제를 의미한다. 본 발명에 있어서, 상기 암 치료제는 면역관문억제제인 것을 특징으로 할 수 있으나, 이에 제한되는 것은 아니다. 우리 몸의 면역 시스템은 T-세포의 과다증식으로 인한 과다면역 반응을 억제하기 위한 면역검문 체계를 가지고 있다. 이러한 면역검문 체계를 면역관문(immune checkpoint)이라고 하며, 면역관문에 관여되는 단백질들을 면역관문 단백질(immune checkpoint protein)이라고 한다. 본질적으로 면역관문은 T-세포의 과활성화 및/또는 과다증식에 의한 과잉면역 반응을 억제하는 기능을 수행하지만, 암 세포는 이런 면역관문을 악용하여 T-세포가 자신을 공격하지 못하도록 함으로써 면역 시스템에 의한 공격에서 벗어나게 되며, 궁극적으로 암이 진행되는 결과를 초래한다. 이러한 면역관문의 억제제를 이용하여, 암 등의 질환을 치료할 수 있음은 이미 해당 기술분야에 알려져 있으며, 현재 면역관문 단백질을 표적으로 하는 항체 의약품이 시판 중에 있고, 다양한 면역관문 억제제가 개발 중에 있다. 최초로 개발된 면역관문 억제제 형태의 치료제는 면역관문 수용체인 CTLA-4(cytotoxic T-lymphocyte associated antigen-4) 특이적인 단클론 항체인 ipilimumab으로, 전이성 악성 흑색종에서 그 효과를 보여주었다. 이어서, PD-1(programmed cell death-1)과 PD-1에 대한 리간드인 PD-L1(programmed death ligand-1)에 특이적인 단클론 항체들이 개발되고 있으며, 대표적인 것들로는 nivolumab, pembrolizumab, avelumab, atezolizumab과 durvalumab 등이 있다. PD-1 또는 PD-L1 억제제는 악성 흑색종뿐만 아니라 그 효과가 다양한 종양들에서 나타난다. 본 발명에 있어서, 상기 면역관문억제제는 immune checkpoint inhibitor 또는 checkpoint inhibitor를 의미하고, 항-CTLA-4 항체, 항-PD-1 항체 또는 항-PD-L1 항체인 것을 특징으로 할 수 있으나, 이에 한정되는 것은 아니며, 구체적으로는 이필리무맙(Ipilimumab), 니볼루맙(Nivolumab), 펨브롤리주맙(Pembrolizumab), 아테졸리주맙(Atezolizumab), 아벨루맙(Avelumab) 또는 더발루맙(Durvalumab) 등이 사용될 수 있지만, 이에 한정되는 것은 아니다. 본 발명에 있어서, 상기 암은 유방암, 대장암, 폐암, 위암, 간암, 혈액암, 골암, 췌장암, 피부암, 뇌암, 자궁암, 비인두암, 후두암, 결장암, 난소암, 직장암, 대장암, 질암, 소장암, 내분비암, 갑상선암, 부갑상선암, 요관암, 요도암, 전립선암, 기관지암, 방광암, 신장암 또는 골수암인 것을 특징으로 할 수 있으나, 이에 제한되는 것은 아니다. “병용”은 항-c-Met 항체 또는 이의 항원 결합 단편과, 다른 암 치료제 각각이 동시, 순차적, 또는 역순으로 투여될 수 있음을 의미하는 것으로, 통상의 기술자의 범위 내 적절한 유효량의 조합으로 투여될 수 있다. 본 발명의 일 실시예에서, 항-PD-L1 항체와 본 발명에 따른 항-c-Met 항체를 병용투여한 경우, 종양의 성장을 더욱 억제하는 것을 확인하였다. 상기 병용 투여 조성물은 항-c-Met 항체를 포함하고, 이와 관련된 구성은 앞서 설명한 암의 예방 또는 치료용 조성물에 포함된 구성과 동일하므로 각 구성에 대한 설명은 병용 투여용 조성물에서도 동일하게 적용된다. 이하, 실시예를 통하여 본 발명을 더욱 상세히 설명하고자 한다. 이들 실시예는 오로지 본 발명을 예시하기 위한 것으로서, 본 발명의 범위가 이들 실시예에 의해 제한되는 것으로 해석되지 않는 것은 당업계에서 통상의 지식을 가진 자에 있어서 자명할 것이다. 실시예 1: 친화도 성숙을 위한 돌연변이 라이브러리 구축 c-Met 표적항체 1F12는 phage display 기술을 이용하여 선별되었으며, 이 항체의 친화도개량을 위해 Directed evolution법을 사용하였다. 항체의 가변영역은 Complementarity-determining region(CDR)과 Framework region으로 구분되며, 항원-항체 간의 결합에는 CDR이 크게 기여한다. 모항체의 중쇄 가변영역과 경쇄 가변영역은 도 1 및 도 2에 나타낸 바와 같다. KABAT numbering법을 기준으로 항체의 CDR과 Framework region을 구분하였다(표 1). 모항체(1F12) 중쇄와 경쇄의 가변영역에 존재하는 총 6개의 CDR에 NNK degenerate codon을 이용한 10 종의 mutant libraries(1F12-H1mut, 1F12-H2-1mut, 1F12-H2-2mut, 1F12-H3-1mut, 1F12-H3-2mut, 1F12-L1-1mut, 1F12-L1-2mut, 1F12-L2mut, 1F12-L3-1mut, 1F12-L3-2mut)를 제작하였다(도 3). Mutant libraries 구축에 사용될 CDR의 서열이 임의화된 1F12 돌연변이 single chain variable fragment(sfiI-VH-linker-VL-sfiI)의 DNA 서열은 하기 표 2에 나타낸 프라이머들을 이용한 overlapping extension PCR법을 이용하여 확보하였다. 이 때 중쇄 CDR-H3의 VH99와 VH100d에 Cysteine이 존재하고(도 1), 이 두 위치는 interchain disulfide bond를 형성하여, CDR-H3 구조를 안정화 시키므로, 이 두 부위에는 NNK codon을 사용하지 않고 Cysteine 잔기를 유지시키기 위해 TGT codon을 사용하였다. pComb3X scFv 발현 벡터(OmpA leader sequence-sfiI-VH-linker-VL-sfiI-His-HA-Amber codon-pIII)를 sfiI(NEB) 제한효소를 이용하여, insert 서열을 제거하여, 벡터를 선형화 시켰다. 이 선형화된 벡터에 CDR 각각의 위치가 NNK degenerate codon에 의해 20개의 아미노산으로 임의화된 sfiI-VH-linker-VL-sfiI을 linearized vector내로 T4 ligase(NEB)를 이용한 삽입을 수행하여, mutant libraries 구축을 완료하였다. 실시예 2: 친화도개량항체 선별 구축된 mutant libraries는 숙주세포로 TG1 대장균을 사용하였으며, 약 3.10 x 1010의 형질전환체를 가진다. 이 mutant libraries는 phage 형태로 회수되었으며, phage display 기술을 적용하여, c-Met에 더 높은 결합능을 보이는 antibody pool을 enrichment 시켰고, ELISA를 이용한 screening을 통해 affinity variants가 선별되었다. 최초로 13종의 친화도가 향상된 클론을 선별하였으며, 그 클론들은 1F12_H35H, 1F12_H53D, 1F12_H57K, 1F12_H58D, 1F12_H60N, 1F12_H100eH, 1F12_H100hR 1F12_L26D, 1F12_L27bD, 1F12_L50E, 1F12_L51D, 1F12_L95aR, 1F12_L96D이다. 1F12-H35H는 KABAT numbering 기준, 1F12 중쇄의 35번 위치의 아미노산이 Histidine(H)으로 치환됨을 의미하고, 1F12_L26D는 1F12 경쇄의 26번 위치의 아미노산이 Aspartic acid로 치환된 돌연변이를 의미한다. 이 13종의 친화도 개량 돌연변이 항체들은 포유세포에서 full-length human IgG1으로 제조하기 위한 생산벡터를 구축하였으며, Expi293 expression system(Gibco)을 이용해 제조사의 매뉴얼대로 수행하였다. 그 결과 1F12_H100hR(모항체에서 중쇄 100h 위치의 아미노산이 Arginine으로 치환된 클론)은 반복적인 제조에서 모두 항체 발현이 되지 않았다. 1F12의 중쇄 CDR 잔기 치환 항체 6종과 경쇄 CDR 잔기 치환 항체가 6종이 확보되었으며, 이를 조합한 항체 4종을 추가로 제조하였다(1F12_H2L3, 1F12_H2L6, 1F12_H3L5, 1F12_H6L5). 1F12_H2L3은 중쇄 가변영역 53번 위치가 Aspartic acid로 치환된 중쇄 발현 벡터와 경쇄 가변영역 50번 위치가 Glutamic acid로 치환된 경쇄 발현 벡터를 조합하여 제조한 항체이다(7종의 중쇄 돌연변이 발현 벡터와 6종의 경쇄 돌연변이 발현 벡터 중 각각 2번째와 3번째의 발현 벡터로 제조하였음을 의미한다). 결론적으로 도 5에서 1F12_H100hR을 제외한 항체들이 포유세포에서 발현 및 정제되어 후속 실험에 사용되었다. 총 17종의 개량 항체의 CDR 서열을 표 3에 나타내었으며, 중쇄 및 경쇄 가변영역 서열을 표 4에 나타내었다. 또한, 각 개량 항체를 코딩하는 폴리뉴클레오티드 서열을 표 5에 나타내었다. 실시예 3: Agonist activity 분석 c-Met 항체의 개발에 있어 agonist activity 분석은 필수적이다. 일반적인 항체는 Y-형태로 표적을 인지하는 paratope 2개를 가지는 bivalent 구조를 가진다. 이로 인해 1개의 c-Met 항체는 표적 항원인 c-Met 2개에 결합하게 되고, 이는 오히려 c-Met dimerization을 유도하여, 하부 신호 전달 경로를 활성화 시키는 agonist activity를 초래한다. Genentech는 Hybridoma 기술을 이용하여 5D5 항체를 개발하였으나, 이 항체는 c-Met에 결합하여 c-Met의 ligand인 HGF/SF와 유사한 효과를 보이며, 신호 전달 경로를 오히려 강화하는 agonist activity를 초래하였다. 이 현상을 최소화하기 위해, 5D5 항체는 one-arm 형태인 OA-5D5로 개량되었고, agonist activity는 최소화 되었다. 모항체인 1F12와 16종의 affinity variants의 agonist activity를 정량하기 위해 Akt 인산화정도를 측정하였다. 상세하게는, 96 well 세포 배양 플레이트에 Caki-1 renal cell carcinoma 세포주가 RPMI1640 완전배지(+10% FBS)에서 well당 약 70%의 confluency에 도달하였을 때, Serum starvation이 24시간 진행되었다. 모항체와 affinity variant 16종이 처리되었고, 대조군으로 c-Met agonist 항체인 5D5와 최소한의 agonist 활성을 보이는 OA-5D5, c-Met의 ligand인 HGF/SF(R&D systems)가 사용되었다. PBS는 시료의 vehicle로 처리된 시료와 동일 volume으로 처리하였으며, 항체들은 10 μg/mL로 처리되었고, HGF/SF는 50 ng/L로 처리되었다. 항체와 ligand의 처리시간은 30분이며, 3번 반복으로 실험이 진행되었다. 각 시료 처리 30분 후, 곧바로 1X PBS로 1회 세척을 진행하고, lysis buffer를 이용해 cell lysis를 진행하였다. 이 후 Akt 인산화 측정은 PathScan® Phospho-Akt Sandwich ELISA Kit(Cell signaling technology)를 이용해, 제조사의 매뉴얼대로 수행하였으며, 각 well에 대한 luminescent signal을 측정하여, PBS 처리 그룹은 0%로, HGF/SF 처리그룹은 100%로 변환하여, 각 항체들의 agonist 활성을 수치화 하였다. 5D5 c-Met agonist 항체는 86.01%의 Akt 인산화를 유도하였으며, HGF와 유사한 정도의 agonist 활성을 보였다. Agonist 활성을 최소화하기 위해 개량된 OA-5D5 one-armed monovalent antibody의 경우 30.46%의 감소된 agonist 활성을 보였다. 이에 비해 1F12 모항체의 agonist 활성은 18.23%로 확인되었으며, 16종 affinity variants의 agonist 활성은 하기 표 6에 나타내었다(도 6). 실시예 4: Affinity 분석 ELISA 기반 친화도 분석은 3번 반복으로 진행하였다. 96 well ELISA용 plate(Costar)에 recombinant human c-Met(Sino biological)이 50 ng/well로 4℃에서 overnight로 코팅하였다. 다음 날 3% skim milk 용액으로 1시간 블로킹을 진행 후, 1X PBST(Cell signaling technology)를 이용하여 3회 세척하였다. PBS(Gibco)에 각각의 항체들을 200 nM 부터 1/2씩 희석하여 100 μL 부피로 각 well에 처리하고 상온에서 1시간 동안 정치하였다. 1X PBST(Cell signaling technology)를 이용하여 3회 세척 후, 1:10000으로 3% skim milk 용액에 희석된 anti-human Fab-HRP(Thermo scientific) 2차 항체를 각 well에 100 μL로 1시간 동안 상온에서 정치하였다. 각각의 well을 1X PBST(Cell signaling technology)를 이용하여 5회 세척 후, TMB 용액(Thermo scientific)을 각 well에 100 μL 처리하고, 발색이 시작되어 적절히 푸른색으로 변하였을 때, STOP 용액(Cell signaling technology)를 100 μL 처리하여, 반응을 종료시켰다. UV/VIS spectrophotometer를 이용하여 OD450을 측정하였고, 이 수치를 normalization한 결과, 모항체(1F12) 대비 1F12_H2L3, 1F12_H2L6, 1F12_H3L5 및 1F12_H6L5 클론의 친화도가 상승되었으며, 1F12_H3L5 클론이 가장 높은 친화도를 나타냄을 확인하였다(도 7). 실시예 5: 암세포 성장억제능 분석 MKN45는 c-Met 증폭 위암 세포주이며, JCRB Cell Bank(Japan)에서 획득하였고, RPMI1640에 10% FBS가 첨가된 배지에서 배양하여 세포를 유지하였다. 대조 항체로 Onartuzumab(OA-5D5; monovalent c-Met Antibody, Genentech)을 사용하였으며, 공개된 항체 서열을 기반으로 항체 발현 벡터를 제작하였다. Expi293 expression system(Gibco)을 이용한 Transient expression을 하여, Mabselect sure(GE)를 AKTA avant(GE)에 장착한 Affinity chromatography법으로 정제를 진행하였고, SE-HPLC 분석을 통해 98% 이상의 순도를 확인하였으며, ELISA와 SPR 분석을 통해 문헌들과 유사성을 확인하였다. 세포 성장 억제능 분석을 위해서 96 well assay plate(Corning, 3610)에 RPMN1640 + 10% FBS의 조성을 가진 완전배양배지에 3000 cells/well로 분주하고, overnight 배양하여 세포들을 부착시킨 후, 배지를 제거하고, 최고 100 nM 부터 1/5씩 항체를 완전배양배지에 희석하여 배지를 100 μL씩 처리 하였다. 72시간 뒤 Cell Titer Glo(Promega)를 각 well에 100 μL 처리 후, Infinite M200 Pro(TECAN)으로 Cell Viability를 분석하였다. 그 결과 개량전 항체(1F12)와 대조 항체 onartuzumab 대비 1F12_H2L3, 1F12_H2L6, 1F12_H3L5 및 1F12_H6L5 항체의 효능이 좋은 것을 확인하였으며, 1F12_H3L5 항체의 효능이 가장 좋음을 확인하였다(도 8). 실시예 6: 동물모델에서 종양성장 억제능 평가 종양세포가 이식된 동물모델에서 종양성장 억제능을 평가하기 위하여 마우스 대장암 종양세포인 MC38 세포를 마우스에 이식하여 종양동물모델을 제작하여 1F12_H3L5 투여에 따른 종양성장 억제능을 평가하였다. MC38을 100 μL당 200000 cell이 존재하도록 준비하였으며, 이때 Hank’s Salt(HBSS) solution(Gibco) 과 Basal Matrigel(Corning®)을 1 : 1 로 섞은 solution을 이용하였다. 준비된 세포는 7-8주령의 C57BL/6 암컷 마우스의 우측허리뒤쪽 부위에 100 μL씩 1cc 주사기(26G)를 이용하여 이식하였다. MC38 세포주를 각각 마우스에 이식한 이후 5일째부터 1F12_H3L5(20 mg/kg, i.p.), Atezolizumab(5 mg/kg, i.p.) 투여를 시작하여 주 2회 투여 진행하였다. 병용투여에 따른 반응성을 평가하기 위하여 종양이식 후 5일째 되는 시점에서 단독투여군과 같이 1F12_H3L5(20 mg/kg, i.p.), Atezolizumab(5 mg/kg, i.p.) 병용투여를 진행하였으며, 병용투여시 1F12_H3L5(20 mg/kg, i.p.)을 먼저 투여 후 이어서 Atezolizumab(5 mg/kg, i.p.)을 투여하였다. 종양 크기는 캘리퍼를 이용하여 장축과 단축을 미리미터(mm) 단위로 측정하여 [(장축) × (단축)2 ×0.5]의 계산식으로 산출하여 측정하였다. 평가결과 MC38 종양 동물모델에서는 1F12_H3L5(20 mg/kg, i.p.) 투여에 따라 유의미한 종양 억제능이 관찰되지 않았고, Atezolizumab(5 mg/kg, i.p.) 투여군에서는 약 40-50%의 종양이 억제된 것을 관찰할 수 있었다. 동일 모델에서의 병용투여군(1F12_H3L5 + Atezolizumab)에서는 대조군 대비 종양이 발생하지 않음을 확인하였으며(종양 이식 후 22일째), 실험을 종료한 43일경에는 해당 병용투여군에서 1 개체에서만 종양이 형성되고 나머지 4 개체는 지속적으로 종양이 형성되지 않는 것을 관찰하였다. MC38 종양 동물모델에서 진행된 동물 시험결과는 1F12_H3L5와 대표적인 면역관문억제제로 알려져 있는 Atezolizumab(PD-L1 억제제)과의 병용투여를 통하여 1F12_H3L5의 치료효능이 증대될 수 있음을 시사한다(도 9). 실시예 7: 동물모델에서 방사선 치료와의 병용치료 반응성 평가 종양세포가 이식된 동물모델에서 종양성장 억제능을 평가하기 위하여 마우스 대장암 종양세포인 MC38 세포를 마우스에 이식하여 종양동물모델을 제작하여 1F12_H3L5 투여에 따른 종양성장 억제능을 평가하였다. MC38을 100 μL당 200000 cell이 존재하도록 준비하였으며, 이때 Hank’s Salt(HBSS) solution(Gibco)과 Basal Matrigel(Corning®)을 1 : 1 로 섞은 solution을 이용하였다. 준비된 세포는 7-8주령의 C57BL/6 암컷 마우스의 우측허리뒤쪽 부위에 100 μL씩 1cc 주사기(26G)를 이용하여 이식하였다. 종양 크기는 캘리퍼를 이용하여 장축과 단축을 미리미터(mm) 단위로 측정하여 [(장축) × (단축)2 ×0.5]의 계산식으로 산출하여 측정하였다. 방사선 치료를 위하여 종양 이식 후 20일이 되는 시점에서 마우스를 마취하여 방사선 조사기를 이용하여 피하이식된 종양에 방사선을 2Gy 단회 조사하였다. 시험 결과, 시험 종료시점 기준으로 방사선 조사군에서 약 80%에 가까운 종양성장 억제가 관찰되었으며, 방사선 조사와 함께 1F12_H3L5 또는 Atezolizumab을 각각 투여한 경우 약 90%에 가까운 종양 성장 억제능이 확인되었다(도 10). 실시예 8: MC38 동물모델 종양에서의 면역세포 발현 분석 면역관문억제제(Immune-checkpoint inhibitor) 등과의 병용투여 전략 등의 매커니즘 분석을 위하여, MC38 동물모델을 제작하여 종양조직에서의 면역세포 발현분석을 진행하였다. MC38을 100 μL당 200000 cell이 존재하도록 준비하였으며, 이때 Hank’s Salt(HBSS) solution(Gibco)과 Basal Matrigel(Corning®)을 1 : 1 로 섞은 solution을 이용하였다. 준비된 세포는 7-8주령의 C57BL/6 암컷 마우스의 우측허리뒤쪽 부위에 100 μL씩 1cc 주사기(26G)를 이용하여 이식하였다. 종양크기가 약 800-1000 mm3 되는 시점에서 부검하여 종양조직을 확보하였으며, 분리된 종양조직을 이용하여 RNA sequencing을 진행하여 분석하였다. 분석을 위하여 기존에 논문으로 보고된 주요 면역세포 별 gene expression signature를 이용하여 분석하였다. MC38 종양조직에서 주요 면역세포 발현을 확인한 결과, 면역 세포 침윤이 많은 종양으로 확인된다 (도 11). 따라서 MC38 종양 모델에서 면역관문억제제 치료 및 종양면역관련 치료 반응성이 나타날 가능성이 높음을 시사하며, 향후 시험에서 종양의 면역세포 발현 경향에 따라 치료 반응성을 예측할 수 있을 것으로 예상된다. 실시예 9: 종양에서의 면역체크포인트 PD-L1 분석 MC38 모델에서 1F12_H3L5를 투여한 마우스와 투여하지 않은 마우스의 종양세포에서 면역체크포인트인 PD-L1의 발현 변화를 확인하고자, 종양 조직은 단일 세포로 분리하는 과정을 수행하였다. 단일 세포에서 면역세포 마커인 CD45와 PD-L1의 염색을 통해 종양세포에서의 PD-L1에 대한 분석을 수행하였다. 종양세포에 침습한 면역세포를 배제하기 위하여 CD45의 발현이 없는 세포에서 PD-L1의 발현을 확인하였다. 그 결과, 1F12_H3L5를 투여한 마우스 개체에서 PD-L1의 발현하는 세포가 2배 이상 증가함을 확인하였다(도 12). 이는 1F12_H3L5와 PD-L1 저해제에 대한 민감도를 증가시킬 수 있음을 시사한다. 본 발명에 따른 c-Met에 결합하는 항체 또는 이의 항원 결합 단편은 인간 및 마우스 c-Met에 높은 친화력으로 결합할 수 있어 마우스 종양모델을 이용한 효능 평가에서 보다 정확한 전임상 결과를 확인할 수 있다. 본 발명에 따른 c-Met에 결합하는 항체 또는 이의 항원 결합 단편은 목적하는 암의 예방 또는 치료에 유용하게 사용될 수 있다. 이상으로 본 발명 내용의 특정한 부분을 상세히 기술하였는바, 당업계의 통상의 지식을 가진 자에게 있어서 이러한 구체적 기술은 단지 바람직한 실시 양태일 뿐이며, 이에 의해 본 발명의 범위가 제한되는 것이 아닌 점은 명백할 것이다. 따라서, 본 발명의 실질적인 범위는 첨부된 청구항들과 그것들의 등가물에 의하여 정의된다고 할 것이다. 전자파일 첨부하였음. The present invention relates to an anti-c-Met antibody that is cross-reactive to human and mouse c-Met, and a use thereof and, more specifically, to: an anti-c-Met antibody or an antigen-binding fragment thereof; a bispecific antibody or an antibody-drug conjugate comprising the antibody or an antigen-binding fragment thereof; a pharmaceutical composition for preventing or treating cancer, comprising same; a nucleic acid coding for the antibody or an antigen-binding fragment thereof; a vector and a host cell comprising the nucleic acid; a method for preparing an anti-c-Met antibody or an antigen-binding fragment thereof by using same; and a co-administered cancer treatment composition containing the anti-c-Met antibody or an antigen-binding fragment thereof and another cancer treatment agent. An antibody binding to c-Met and an antigen-binding fragment thereof, according to the present invention, can bind to human and mouse c-Met with high affinity, and thus more accurate preclinical results can be identified in an efficacy evaluation by using mouse tumor models. An antibody binding to c-Met and an antigen-binding fragment thereof, according to the present invention, can be effectively used in the prevention or treatment of target cancer. 서열번호 1 또는 27의 아미노산 서열을 포함하는 중쇄(heavy chain) CDR1; 서열번호 2 및 28 내지 31로 구성된 군에서 선택된 아미노산 서열을 포함하는 중쇄 CDR2; 서열번호 3, 32 및 33으로 구성된 군에서 선택된 아미노산 서열을 포함하는 중쇄 CDR3를 포함하는 중쇄 가변영역; 및 서열번호 4, 34 및 35로 구성된 군에서 선택된 아미노산 서열을 포함하는 경쇄(light chain) CDR1; 서열번호 5, 36 및 37로 구성된 군에서 선택된 아미노산 서열을 포함하는 경쇄 CDR2; 서열번호 6, 38 및 39로 구성된 군에서 선택된 아미노산 서열을 포함하는 경쇄 CDR3를 포함하는 경쇄 가변영역을 포함하는 항-c-Met 항체 또는 이의 항원 결합 단편. 제1항에 있어서, 서열번호 40 및 42 내지 48로 구성된 군에서 선택된 아미노산 서열을 포함하는 중쇄 가변영역 및 서열번호 41 및 49 내지 54로 구성된 군에서 선택된 아미노산 서열을 포함하는 경쇄 가변영역을 포함하는 것을 특징으로 하는 항-c-Met 항체 또는 이의 항원 결합 단편. 제1항 또는 제2항에 있어서, 단클론 항체인 것을 특징으로 하는 항-c-Met 항체 또는 이의 항원 결합 단편. 제1항 또는 제2항에 있어서, 상기 항원 결합 단편은 상기 항-c-Met 항체의 scFv, (scFv)2, scFv-Fc, Fab, Fab' 및 F(ab')2로 이루어진 군에서 선택되는 것을 특징으로 하는 항-c-Met 항체 또는 이의 항원 결합 단편. 제1항에 있어서, 상기 항체 또는 이의 항원 결합 단편은 인간 c-Met 및 마우스 c-Met에 교차결합하는 것을 특징으로 하는 항-c-Met 항체 또는 이의 항원 결합 단편. 제1항의 항-c-Met 항체 또는 이의 항원 결합 단편을 포함하는 이중특이 항체(bispecific antibody) 또는 항체-약물 접합체(antibody-drug conjugate). 제1항의 항-c-Met 항체 또는 이의 항원 결합 단편을 유효성분으로 포함하는 암의 예방 또는 치료용 약학 조성물. 제6항의 이중특이 항체 또는 항체-약물 접합체를 유효성분으로 포함하는 암의 예방 또는 치료용 약학 조성물. 제7항 또는 제8항에 있어서, 상기 암은 유방암, 대장암, 폐암, 위암, 간암, 혈액암, 골암, 췌장암, 피부암, 뇌암, 자궁암, 비인두암, 후두암, 결장암, 난소암, 직장암, 대장암, 질암, 소장암, 내분비암, 갑상선암, 부갑상선암, 요관암, 요도암, 전립선암, 기관지암, 방광암, 신장암 또는 골수암인 것을 특징으로 하는 약학 조성물. 제7항 또는 제8항에 있어서, 방사선을 사용한 병용 치료에 사용되는 것을 특징으로 하는 약학 조성물. 제1항에 따른 항-c-Met 항체 또는 이의 항원 결합 단편을 코딩하는 핵산. 제11항에 따른 핵산을 포함하는 재조합 발현 벡터. 제12항에 따른 재조합 발현 벡터로 형질전환된 숙주세포. 제13항에 있어서, 동물세포, 식물세포, 효모, 대장균 및 곤충세포로 구성된 군에서 선택된 것임을 특징으로 하는 숙주세포. 제13항에 있어서, 원숭이 신장 세포7(COS7: monkey kidney cells) 세포, NSO 세포, SP2/0 세포, 차이니즈 햄스터 난소(CHO: Chinese hamster ovary) 세포, W138, 어린 햄스터 신장(BHK: baby hamster kidney) 세포, MDCK, 골수종 세포주, HuT 78 세포 및 HEK293 세포, 바실러스 서브틸리스(Bacillus subtilis), 스트렙토마이세스 속(Streptomyces sp.), 슈도모나스 속(Pseudomonas sp.), 프로테우스 미라빌리스(Proteus mirabilis) 또는 스타필로코쿠스 속(Staphylococcus sp.), 아스페르길러스 속(Aspergillus sp.), 피치아 파스토리스(Pichia pastoris), 사카로마이세스 세레비지애(Saccharomyces cerevisiae), 쉬조사카로마세스 속(Schizosaccharomyces sp.) 및 뉴로스포라 크라사(Neurosporacrassa)로 구성된 군에서 선택되는 것을 특징으로 하는 숙주세포. 제13항 내지 제15항 중 어느 한 항에 따른 숙주세포를 배양하는 단계를 포함하는 항-c-Met 항체 또는 이의 항원 결합 단편의 제조 방법. 제1항의 항-c-Met 항체 또는 이의 항원 결합 단편 및 다른 암 치료제를 포함하는 암 치료용 병용 투여 조성물. 제17항에 있어서, 상기 다른 암 치료제는 면역관문억제제인 것을 특징으로 하는 병용 투여 조성물. 제18항에 있어서, 상기 면역관문억제제는 항-CTLA-4 항체, 항-PD-1 항체 또는 항-PD-L1 항체인 것을 특징으로 하는 병용 투여 조성물. 제17항에 있어서, 상기 암은 유방암, 대장암, 폐암, 위암, 간암, 혈액암, 골암, 췌장암, 피부암, 뇌암, 자궁암, 비인두암, 후두암, 결장암, 난소암, 직장암, 대장암, 질암, 소장암, 내분비암, 갑상선암, 부갑상선암, 요관암, 요도암, 전립선암, 기관지암, 방광암, 신장암 또는 골수암인 것을 특징으로 하는 병용 투여 조성물.