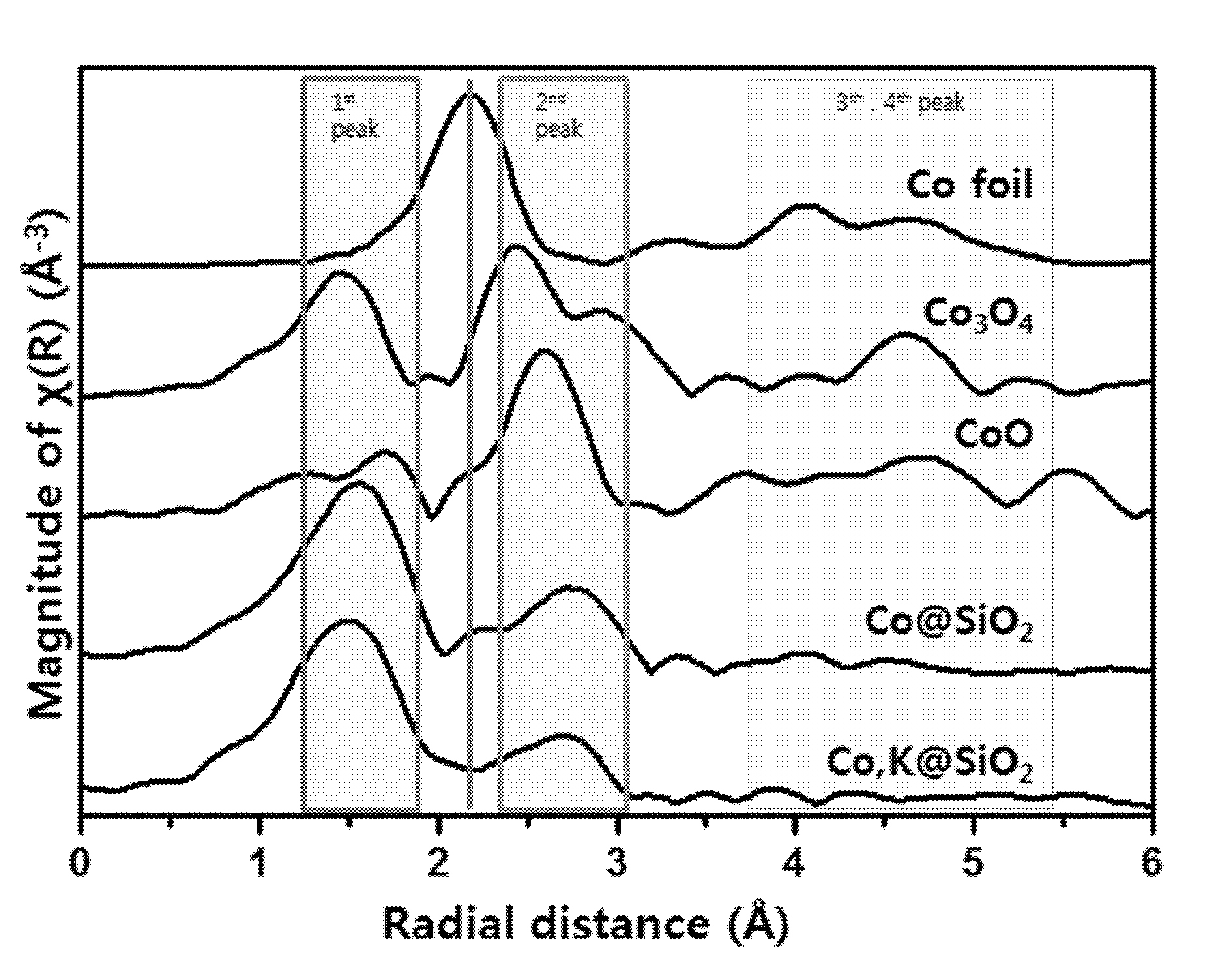
COBALT-BASED MONOATOMIC DEHYDROGENATION CATALYST AND METHOD FOR PREPARING OLEFIN CORRESPONDING TO PARAFFIN FROM PARAFFIN BY USING SAME
본 개시 내용은 코발트계 단원자 탈수소화 촉매 및 이를 이용하여 파라핀으로부터 대응되는 올레핀을 제조하는 방법에 관한 것이다. 보다 구체적으로, 본 개시 내용은 알칼리 금속의 전처리에 의하여 단원자 형태의 알칼리 금속이 고정된 무기 산화물(구체적으로, 실리카) 지지체 상에 단원자의 코발트가 담지된 탈수소화 촉매 및 이의 제조방법, 그리고 상기 탈수소화 촉매의 존재 하에서 파라핀, 구체적으로 경질 파라핀을 탈수소화 반응시켜 이에 대응되는 올레핀을 제조하는 방법에 관한 것이다. 에틸렌, 프로필렌, 부틸렌 등과 같은 경질 올레핀은 석유화학 산업에 있어서 널리 사용되고 있는 바, 화학 제품(옥소-알코올, 아크릴로니트릴, 프로필렌 옥사이드, 부탄올, 아크릴산 등) 및 플라스틱 제품(폴리프로필렌, 에틸렌-프로필렌 고무 등)의 빌딩 블록으로 사용되는 중요 화학 원료이다. 특히, 프로필렌은 무색의 저비점의 화합물로서 통상 고분자 그레이드(최소 약 99.5% 순도), 화학 그레이드(약 90-96% 순도) 및 리파이너리 그레이드(약 50-70% 순도)로 거래되고 있다. 일반적으로 이러한 경질 올레핀은 나프타 또는 케로센을 수증기 공존 하에서 열분해(즉, 스팀 크래킹)시켜 제조된다. 그러나, 최근 경질 올레핀에 대한 수요가 증가함에 따라 열분해 방식의 제조방법으로는 증가하는 수요를 충족하기 어렵기 때문에 다양한 합성 방법(예를 들면, 경질유분의 접촉분해 공정 등)이 제안된 바 있다. 전술한 스팀 크래킹, 접촉분해 공정 등으로부터 얻어지는 생성물은 전형적으로 복수의 올레핀(에틸렌, 프로필렌 등)뿐만 아니라, 메탄, 에탄, 프로판, C5, C6 이상의 다양한 탄화수소를 함유하는 혼합물 형태이다. 이때, 운전 조건 등의 변경을 통하여 생성물의 혼합물 조성을 조절할 수 있으나, 특정 생성물에 대한 시장 수요가 다른 공생성물에 비하여 높은 경우에는 충분한 방안이 될 수 없다. 특히, 예를 들면, 많은 지역에 있어서 프로필렌에 대한 시장 수요는 에틸렌에 비하여 신속하게 증가하고 있는 실정이다. 이러한 종래의 상용 공정에서 나타나는 낮은 올레핀 수율로 인하여, 가급적 올레핀 선택도를 높이기 위한 촉매 반응 기술이 요구되고 있다. 최근 상용화되고 있는 공정으로서 탈수소화 반응에 의한 제조 공정이 알려져 있는 바, 예시적으로 하기 반응식 1에 의하여 파라핀은 탈수소화 반응을 통하여 이에 대응되는 올레핀으로 전환될 수 있다. [반응식 1] 상술한 탈수소화 반응은 파라핀으로부터 수소 분자를 제거하여 올레핀성 이중결합을 형성한다. 이러한 경질 파라핀의 탈수소화 반응은 경질 파라핀(구체적으로 프로판)을 원료로 탈수소 반응을 통하여 이에 대응하는 올레핀(구체적으로 프로필렌)만을 선택적으로 제조하는 방식으로서, 통상 고온의 흡열반응을 통하여 짧은 체류시간 동안 반응이 이루어진다. 이러한 파라핀의 탈수소화는 복잡한 화학적 프로세스에 해당되는 바, 열역학적 평형이 패스 당 가능한 전환율을 제한하고, 반응에서 다량의 열이 공급될 필요가 있기 때문이다. 현재 상용화된 탈수소화 기술의 예는 하기 표 1과 같다. 상기 예시된 상용 공정의 경우, 혼합가스 형태의 공급원료를 사용하며, 주로 크롬계 촉매 또는 백금계(주로 Pt-Sn) 촉매를 사용하고 있고, 철 산화물계 촉매, 갈륨/제올라이트 기반의 촉매 등도 파라핀의 탈수소화 반응에 적용 가능한 것으로 알려져 있다. 또한, 일반적으로 탈수소화 촉매는 반응 중 코크의 발생에 따라 비활성화된 후에는 촉매를 재생하는 과정이 수행되나, 복수의 재생 과정을 거치는 동안 촉매 활성을 유지하는 것이 요구될 수 있다. 최근에는 지지체에 담지된 활성 금속의 모든 원소를 활용할 수 있는 촉매 기술이 관심을 받고 있다. 기존의 금속 담지 촉매는 넓은 사이즈 분포 및 불규칙한 형태학적 특징을 갖는 금속 입자가 집합되어 있는 형태로서 금속 활성점의 효과적인 활용에 영향을 미침으로써 종종 촉매 활성 또는 선택도에 바람직하지 않은 영향을 미치게 된다. 반면, 단원자 담지 촉매의 경우, 금속 나노구조를 원자 수준으로 분포된 금속 활성점으로 다운사이징함으로써 촉매의 활성을 극대화할 수 있는 장점을 제공한다. 이러한 관점에서 단원자 형태의 아연(Zn)을 실리카 등의 지지체 상에 담지시킨 촉매의 존재 하에서 프로판을 탈수소화 반응에 의하여 프로필렌으로 전환하는 기술도 알려져 있다(예를 들면, ACS Catal. 2014, 4, 4, 1091-1098). 그러나, 상기 문헌 등에서는 반응물로서 3%의 프로판, 그리고 나머지 성분은 비활성 가스인 아르곤(Ar)으로 이루어진 혼합 가스를 사용하고 있는 바, 이는 부생성물의 생성을 억제하면서 파라핀을 가급적 이에 대응하는 올레핀으로 선택적으로 전환시키기 위함이다. 그러나, 낮은 파라핀 함량의 공급원료를 사용하는 것은 상업적 관점에서 적합하지 않다. 또한, 종래의 탈수소화 반응용 단원자 촉매의 경우, 제조 공정 중 열처리 온도가 약 300℃로 설정되나, 실제 탈수소화 반응이 이보다 현저히 높은 온도인 500 내지 600℃ 수준의 고온에서 이루어지기 때문에 열안정성 면에서 취약한 문제점을 갖고 있다. 한편, 기존에 알려진 활성 금속 이외에도 코발트를 각종 무기 산화물 지지체 상에 담지한 촉매 역시 파라핀의 탈수소화 반응 활성을 갖는 것으로 알려져 있다(예를 들면, 미국특허공개번호 제2013-0253248호 등). 이때, 코발트를 활성 금속으로 하고 이의 단원자 형태로 지지체 상에 담지시킨 촉매의 존재 하에서 파라핀의 탈수소화 반응을 수행하는 방안을 고려할 수 있으나, 이 경우 고온에서 수행되는 탈수소화 반응 과정에서 지지체 상에 고정된 코발트 원소의 상호 응집(agglomeration) 현상 또는 환원되어 코발트 금속이 부분적으로 형성되는 현상이 발생하여 장기적인 반응 안정성을 확보하는데 한계가 존재한다. 따라서, 단원자 형태의 코발트 담지 촉매가 갖는 장점을 극대화하면서도 경질 파라핀의 탈수소화 반응 과정에서 지지체 상에 담지된 단원자 활성 금속이 환원되거나 응집되어 촉매 활성이 저하되는 현상을 억제하기 위한 방안에 관하여는 알려진 바 없다. 또한, 기존의 연구에서는 탈수소화 반응 시 낮은 함량의 파라핀이 함유된 공급원료를 사용하고 있는 바, 상용화를 위하여는 고농도(고함량), 더 나아가 순수한 파라핀을 공급원료로 사용하는 경우에도 높은 전환율 및 선택도로 올레핀을 안정적으로 제조할 수 있는 방안이 요구된다. 본 개시 내용에 따른 구체예에서는 파라핀의 탈수소화 반응에 의하여 올레핀을 제조하는 과정 중 고온에 노출되는 경우에도 촉매 안정성 또는 장기 활성을 유지할 수 있는 탈수소화 반응용 단원자 형태의 코발트(Co) 담지 촉매 및 이의 제조방법을 제공하고자 한다. 본 개시 내용에 따른 구체예에서는 상업화에 적합하도록 고농도의 파라핀 함유 공급원료에 대하여도 파라핀의 전환율이 높고, 대응되는 올레핀에 대한 선택도가 우수한 탈수소화 공정을 제공하고자 한다. 본 개시 내용의 제1 면에 따르면, 단원자 형태의 코발트계 촉매의 제조방법으로서, a) 실리카-함유 수계 분산물을 제조하는 단계; b) 상기 실리카-함유 수계 분산물 내에 알칼리 금속의 염을 용해시켜 알칼리-처리 실리카의 수계 분산물을 제조하는 단계; c) 상기 알칼리-처리 실리카의 수계 분산물에 염기 성분을 첨가하여 pH를 적어도 10으로 조절함으로써 pH 조절된 알칼리-처리 실리카의 수계 분산물을 제조하는 단계, 여기서 알칼리 금속 이온의 적어도 일부가 정전기적으로 실리카 표면 상에 흡착됨; d) 이와 별도로, 3+의 산화가를 갖는 코발트 전구체의 수용액을 제조하고 염기 성분을 첨가하여 pH를 적어도 10으로 조절함으로써 pH 조절된 코발트 전구체 수용액을 제조하는 단계; e) 상기 pH 조절된 알칼리-처리 실리카의 수계 분산물 및 상기 pH 조절된 코발트 전구체 수용액을 조합하여 3+의 산화가를 갖는 코발트 이온의 적어도 일부가 상기 알칼리 금속 이온이 흡착된 실리카 표면 상에 정전기적으로 흡착되어 있는 수계 분산물을 제조하는 단계; 및 f) 상기 알칼리 금속 이온 및 코발트 이온이 흡착된 실리카의 수계 분산물로부터 실리카 표면에 흡착되지 않은 알칼리 금속 및 코발트를 제거하는 단계; g) 상기 단계 f)로부터 얻어진 상기 알칼리 금속 이온 및 코발트 이온이 흡착된 실리카를 열처리하는 단계, 를 포함하고, 여기서, 상기 코발트계 촉매는, 2+ 산화가를 갖는 코발트 및 1+ 산화가를 갖는 알칼리 금속 각각이 실리카 상에서 단리된(isolated) 단원자 형태로 존재하고, 또한 상기 2+ 산화가를 갖는 코발트는 실리카의 표면에 존재하는 3원 실록산 고리에서 사면체 구조를 형성하며 배위되어 있는 방법이 제공된다. 본 개시 내용의 제2 면에 따르면, 지지체로서 알칼리 금속이 흡착된 실리카; 및 상기 지지체 상에 담지된 활성 금속으로서 코발트; 를 포함하는 단원자 형태의 코발트계 촉매로서, 2+의 산화가를 갖는 코발트 및 1+의 산화가를 갖는 알칼리 금속 각각이 실리카 상에서 단리된(isolated) 단원자 형태로 존재하고, 또한 상기 2+ 산화가를 갖는 코발트는 실리카의 표면에 존재하는 3원 실록산 고리에서 사면체 구조를 형성하며 배위되어 있는 탈수소화 촉매가 제공된다. 본 개시 내용의 제3 면에 따르면, 파라핀을 함유하는 공급원료를 제공하는 단계; 상술한 촉매의 존재 하에서 500 내지 700℃의 온도 및 0.3 내지 2 bar의 압력 조건 하에 상기 공급원료에 대한 탈수소화 반응을 수행하는 단계; 및 상기 탈수소화 반응 생성물 중 상기 경질 파라핀에 대응되는 올레핀을 회수하는 단계; 를 포함하는 파라핀으로부터 올레핀을 제조하는 방법이 제공된다. 본 개시 내용에 따른 구체예에 따른 탈수소화 촉매는 알칼리 금속으로 처리된 실리카 지지체 상에 단원자 형태의 코발트를 담지한 형태로서, 파라핀, 특히 경질 파라핀을 이에 대응하는 올레핀으로 탈수소화 반응시키는 과정 중 고온(예를 들면, 약 500℃ 이상)에 노출되는 경우에도 단원자 형태로 실리카 표면에 부착된 알칼리 금속의 작용에 의하여 코발트가 서로 응집되거나 소결되는 현상을 효과적으로 억제할 수 있다. 이와 같이 개선된 열적 안정성으로 인하여 탈수소화 반응 과정에서 고온에 장시간 노출되거나 탈수소화 반응으로부터 생성되는 수소와 접촉하는 경우에도 촉매의 변형 또는 변성이 효과적으로 억제되므로 촉매 활성을 장기간 유지할 수 있는 장점을 제공한다. 또한, 본 개시 내용의 구체예에 따른 촉매는 탈수소화 반응에 있어서 높은 함량의 파라핀을 함유하는 공급원료에 대하여도 양호한 전환율 및 올레핀 선택도를 나타낼 수 있기 때문에 상용화에 특히 유리한 장점을 제공한다. 도 1은 제조예 1 및 비교제조예 1 각각에 따라 제조된 코발트계 촉매에 대한 EXAFS 분석 결과를 나타내는 그래프이고; 도 2a 및 도 2b 각각은 제조예 1 및 비교제조예 1 각각에 따라 제조된 단원자 형태의 코발트계 촉매의 존재 하에서 실험예 1에서 프로판 탈수소화 반응을 수행하여 측정된 전환율 및 선택도를 나타내는 그래프이고; 도 3은 비교제조예 1에 따라 제조된 단원자 형태의 코발트계 촉매의 존재 하에서 실험예 1에서 프로판 탈수소화 반응을 수행한 후, EXAFS를 통하여 반응 전후의 변화를 관찰한 결과를 나타내는 그래프이고; 도 4는 제조예 1 및 비교제조예 1 각각에 따라 제조된 단원자 형태의 코발트계 촉매의 존재 하에서 실험예 1에서 수행한 프로판 탈수소화 반응, 그리고 실험예 2에서 수행한 고온 열처리 공정 후 촉매의 변화를 EXAFS를 통하여 관찰한 결과를 나타내는 그래프이고; 도 5a 및 도 5b 각각은 제조예 1, 그리고 비교제조예 2 및 3 각각에 따라 제조된 3종의 알칼리 금속이 첨가된 코발트 단원자 촉매를 실험예 3에서 프로판 탈수소화 반응을 수행하여 측정된 전환율 및 선택도를 나타내는 그래프이고; 그리고 도 6은 제조예 1에 따라 제조된 단원자 형태의 코발트계 촉매를 실험예 4에서 반복적인 프로판 탈수소화 반응-재생 공정을 15회 반복한 후에 촉매 변화를 EXAFS를 통하여 관찰한 결과를 나타내는 그래프이다. 본 발명은 하기의 설명에 의하여 모두 달성될 수 있다. 하기의 설명은 본 발명의 바람직한 구체예를 기술하는 것으로 이해되어야 하며, 본 발명이 반드시 이에 한정되는 것은 아니다. 또한, 첨부된 도면은 이해를 돕기 위한 것으로, 본 발명이 이에 한정되는 것은 아님을 이해하여야 한다. 본 명세서에 있어서 사용되는 용어는 하기와 같이 정의될 수 있다. "불균일계 촉매"는 촉매 반응 과정에서 반응물과 상이한 상(phase)으로 존재하는 촉매를 의미할 수 있는 바, 예를 들면 반응 매질 내에서 용해되지 않는 촉매를 의미할 수 있다. 불균일계 촉매의 경우, 반응이 일어나기 위하여는 적어도 하나의 반응물이 불균일계 촉매의 표면으로 확산되어 흡착되어야 하며, 반응 후에는 생성물이 불균일계 촉매의 표면으로부터 탈착될 필요가 있다. "지지체(support)"는 촉매 활성 성분이 부착된 높은 비표면적을 갖는 재료(전형적으로 고상 재료)를 의미할 수 있으며, 촉매 반응에 참여하거나 참여하지 않을 수 있다. "결정성" 또는 "결정질"이라는 용어는 전형적으로 원자가 격자 구조(예를 들면 3차원적 규칙성(three-dimensional order))를 갖도록 정렬된 임의의 고상 물질을 의미할 수 있는 반면, "비정질"은 이러한 격자 구조를 갖지 않는 임의의 고상 물질을 의미할 수 있는 바, 일반적으로 X-선 회절 분석(XRD), 핵자기 공명 분석(NMR), 시차 주사 열량측정법(DSC) 또는 이들의 조합에 의하여 특정할 수 있다. "경질 파라핀"은 탄소수 2 내지 5의 파라핀, 보다 구체적으로 탄소수 3 및 4의 파라핀을 의미할 수 있는 바, 구체적으로 에탄, 프로판, n-부탄, 이소부탄, 펜탄 등을 예시할 수 있다. 또한, "이에 대응되는 올레핀"은 탈수소화 반응의 공급원료 내 경질 파라핀으로부터 수소 분자가 제거된 동일 탄소수의 올레핀을 의미할 수 있다. "실리카"는 하나의 실리콘 원자가 4개의 산소 원자에 결합되어 형성된 사면체 구조의 물질을 의미할 수 있다. "다공성 실리카"는 다공성을 갖는 3차원의 네트워크 실리카를 의미할 수 있는 바, 1차 실리카 입자의 응집물(aggregate)로 이루어질 수도 있다. 탈수소화 촉매 본 개시 내용의 일 구체예에 따르면, 고농도의 파라핀(구체적으로, 경질 파라핀)을 함유하는 공급원료를 높은 전환율 및 선택도로 이에 대응되는 올레핀으로 전환시키는데 적합할 뿐만 아니라, 탈수소화 반응 시 고온에 노출되더라도 양호한 열 안정성을 나타내는 단원자 형태의 코발트계 촉매가 제공된다. 일 구체예에 따르면, 상기 촉매는 알칼리 금속이 단원자 형태로 고정(흡착)된(즉, 알칼리 금속으로 처리된) 실리카 지지체(구체적으로 비정질 실리카 지지체) 상에 활성 금속으로서 단원자 형태의 코발트가 담지된 불균일 촉매일 수 있다. 이때, 알칼리 금속이 흡착된 실리카 지지체의 경우, 실리카 상에서 양 전하를 갖는 산화가 1+의 알칼리 금속(또는 알칼리 금속 이온)이 실리카의 표면 상에 존재하는 음 전하의 SiO-와 정전기적 상호 작용(또는 흡착)에 의하여 단리된(isolated) 단원자 형태로 결합되어 있다. 또한, 2+의 산화가를 갖는 코발트(Co(II)) 또는 이온이 실리카의 표면에 단리된 단원자 형태로 존재하는 바, 이러한 단원자 형태의 코발트는 실리카의 표면에 존재하는 3원 실록산 고리에서 사면체 구조를 형성하며 배위되어 있다. 이와 같이, 코발트를 실리카 상에 담지하기에 앞서 단원자 형태의 알칼리 금속을 도입함으로써 코발트가 담지될 수 있는 부위 또는 사이트를 제한하고, 그 결과 알칼리 금속이 코발트 사이에 개재되어 코발트 간 다이머(dimer) 형성과 같은 폴리고머화 반응에 의하여 응집되는 현상을 효과적으로 억제할 수 있다. 또한, 본 구체예에 따른 촉매는 알칼리 금속을 도입함에 따라 탈수소화 반응시 생성되는 수소에 의하여 산화 상태의 코발트가 원소 상태로 환원되는 현상에 대한 저항이 증가함으로써 반응 과정에서도 활성이 급격히 저하되는 현상을 늦출 수 있는 장점을 갖는다. 본 구체예에서 촉매에 알칼리 금속을 도입함에 따른 기능은 종래의 촉매에서 알칼리 금속 등을 프로모터(promoter)로 사용하여 중심 금속 성분 이외에 담체에 존재하는 강한 산점을 제어하고 강한 산점에 의한 파라핀 내 탄소-탄소 결합의 해리 또는 코크 형성 등을 억제하여 촉매 반응의 선택도를 증가시키고, 또한 코크에 의한 촉매 비활성화를 억제하는 기능을 제공하기 위한 것과는 실질적으로 구별된다. 이처럼, 본 구체예에서 알칼리 금속의 도입은 종래의 탈수소화 촉매 내 알칼리 금속 프로모터의 기능과는 달리 지역적으로 집중되어 응집에 취약할 수 있는 중심 금속인 코발트의 담지 부위 및/또는 담지량을 제어하기 때문에 이론적으로는 오히려 촉매 반응에 방해가 될 수 있으나, 이러한 약점을 최소화하면서도 궁극적으로 코발트 금속의 환원 및/또는 응집을 억제하여 촉매의 안정성을 증가시킬 수 있는 효과를 제공할 수 있는 것이다. 구체적으로, 알칼리 금속으로 처리되지 않은 상태에서 단원자 형태로 담지된 코발트는 탈수소화 반응 중 Co-O-Co 다이머를 형성하면서 응집되는 현상을 거치게 된다. 특히, 반응이 진행됨에 따라 고온에 노출되거나, 또는 높은 함량의 파라핀을 함유하는 공급원료를 사용하여 탈수소화 반응을 수행하는 경우, 전술한 문제점이 두드러지는 바, 촉매 활성을 저하시키는 요인으로 작용한다. 예시적 구체예에 따르면, 알칼리 금속은 나트륨(Na), 칼륨(K) 및 세슘(Cs)으로 이루어진 군으로부터 선택된 적어도 하나일 수 있다. 보다 구체적으로, 알칼리 금속으로 칼륨(K)을 사용할 수 있는 바, 칼륨이 3원 실록산 고리와 결합된 코발트의 주변에 위치하여 코발트와 동반하여 안정화될 수 있는 이온 사이즈를 갖는 등의 특성을 갖고 있기 때문이다. 이와 관련하여, 탈수소화 촉매 내 알칼리 금속의 함량은, 예를 들면 약 0.00001 내지 1 중량%, 구체적으로 약 0.0001 내지 0.5 중량%, 보다 구체적으로 약 0.004 내지 0.1 중량% 범위일 수 있다. 예시적 구체예에 따르면, 탈수소화 촉매 내 코발트의 함량(담지량)은, 예를 들면 약 0.1 내지 10 중량%, 구체적으로 약 0.5 내지 5 중량%, 보다 구체적으로 약 1 내지 3 중량% 범위일 수 있다. 이러한 담지량은 실리카 종류에 따라 다소 변화 가능하나, 단원자 형태로 존재할 수 있는 코발트의 량은 전형적으로 최대 약 2 내지 3 중량%인 만큼, 이를 고려하여 정하여질 수 있을 것이다. 이때, 촉매 내 코발트(Co)/알칼리 금속의 중량 비는, 예를 들면 약 1 내지 2000, 구체적으로 약 10 내지 1000, 보다 구체적으로 약 100 내지 500 범위일 수 있다. 만약 알칼리 금속에 대한 코발트의 상대적 함량이 지나치게 큰 경우에는 지역적으로 한정된 면적 내에서 코발트 이온들이 많이 존재하게 되는 바, 이때 알칼리 금속 성분이 결핍하면 촉매 표면에서 코발트 이온들이 환원이나 응집을 일으켜 코발트 단원자 촉매의 비활성화가 유발될 수 있다. 반면, 알칼리 금속에 대한 코발트의 상대적 함량이 지나치게 작은 경우, 상대적으로 많은 공간을 차지하는 알칼리 금속의 존재로 인하여 반응물인 경질 파라핀의 접근이 방해되어 촉매의 전환율이 과다하게 감소하는 문제점이 야기될 수 있는 바, 이점을 고려하여 전술한 범위 내에서 적절히 조절하는 것이 유리할 수 있다. 탈수소화 촉매의 제조방법 일 구체예에 따르면, 단원자 형태의 코발트계 탈수소화 촉매의 제조방법은 하기와 같다. 먼저, 실리카를 수계 매질 내에 투입하여 실리카를 함유하는 수계 분산물을 제조한다(단계 a). 이때, 실리카는 특정 종류로 한정되는 것은 아니지만, 가급적 불순물 함량이 적은 고순도 실리카를 사용하는 것이 유리할 수 있다. 특정 구체예에 따르면, 실리카는 비정질 실리카, 구체적으로 다공성 비정질 실리카일 수 있는 바, 예를 들면 건식(fumed silica), 습식 실리카(precipitated silica) 등을 포함할 수 있다. 이러한 실리카는 미세한 분말의 형태로 분자 표면에 많은 량의 실란올기 및 실록산기가 존재하는 바, 실리카 표면에 존재하는 실란올(하이드록실) 그룹은 isolated(Si-OH), vicinal(수소 결합으로 연결됨) 및 germinal(HO-Si-OH)의 3가지 타입으로 구분될 수 있다. 예시적 구체예에 따르면, 실리카의 비표면적(BET 비표면적)은, 예를 들면 적어도 약 100 ㎡/g, 구체적으로 약 200 내지 1500 ㎡/g, 보다 구체적으로 약 300 내지 1000 ㎡/g 범위일 수 있다. 실리카의 포어 체적은, 예를 들면 약 0.1 내지 10 ㎤/g, 구체적으로 약 0.3 내지 5 ㎤/g, 보다 구체적으로 약 0.5 내지 3 ㎤/g 범위일 수 있다. 또한, 포어 사이즈(평균 직경)는, 예를 들면 약 0.5 내지 200 nm, 구체적으로 약 1 내지 100 nm, 보다 구체적으로 약 3 내지 30 nm 범위일 수 있다. 상기 수치 범위는 예시적 목적으로 기술된 것으로 이해되어야 한다. 전술한 실리카-함유 수계 분산물을 제조하는데 사용되는 수계 매질은, 물, 구체적으로 증류수일 수 있는 바, 수계 분산물 내 실리카의 함량은, 예를 들면 약 1 내지 30 중량%, 구체적으로 약 3 내지 20 중량%, 보다 구체적으로 약 5 내지 10 중량% 범위일 수 있다. 이후, 실리카-함유 수계 분산물 내에 알칼리 금속의 염을 첨가하여 용해시켜 알칼리-처리 실리카의 수계 분산물을 제조한다(단계 b). 예시적으로, 알칼리 금속의 염은 특별히 한정되는 것은 아니지만, 예를 들면 알칼리 금속의 수산화물(hydroxide), 질산염(nitrate), 염화물(chloride), 탄산염 (carbonate), 황산염(sulfate) 등으로부터 선택되는 적어도 하나일 수 있다. 보다 구체적으로는 알칼리 금속의 수산화물을 사용할 수 있는 바, 이는 코발트 전구체의 공침을 유발하지 않고, pH를 조절하는 데 용이하기 때문이다. 예시적 구체예에 따르면, 알칼리 금속의 염은 수계 분산물 내 실리카 중량을 기준으로, 약 0.001 내지 3 중량%, 구체적으로 약 0.005 내지 1 중량%, 보다 구체적으로 약 0.01 내지 0.5 중량% 범위에서 적절한 량으로 첨가하여 용해시킬 수 있다. 그 다음, 알칼리 처리된 실리카-함유 수계 분산물에 염기 성분을 첨가하여 pH 조절된 알칼리-처리 수계 분산물을 제조한다(단계 c). 염기 성분의 첨가를 통하여 알칼리 처리된 실리카-함유 수계 분산물의 pH는, 예를 들면 적어도 약 10, 구체적으로 적어도 약 11, 보다 구체적으로 약 10.5 내지 11.5 범위로 조절할 수 있다. 알칼리 처리된 실리카-함유 수계 분산물의 pH를 증가시키는 이유는 실리카 표면을 탈양성자화시키기 위함인 바, 구체적으로 실리카 표면에 존재하는 실란올기(Si-OH)로부터 수소 이온(H+)을 제거하여 음의 전하를 띄도록 할 수 있다. 즉, 이온은 실리카의 영 전하점(point of zero charge; PZC)에서는 흡착되지 않고 실란올기(하이드록시기)가 유지되므로, pH 조정을 통하여 실리카 표면을 탈양성자시킴으로써 음의 전하를 나타내도록 할 수 있는 것이다. 그 결과, 알칼리 금속 이온이 탈양성자화된 실리카의 표면의 실란올 음이온(SiO-)과 정전기적 상호 작용(즉, 정전기적 흡착)에 의하여 단원자 형태로 실리카에 고정 또는 그래프팅될 수 있다. 또한, 실리카 표면에 실란올과 함께 존재하는 실록산, 구체적으로 3원 실록산이 염기성 수계 매질 내에서 3개의 실란올 음이온을 형성하는 바, 이는 후속 공정에서 코발트가 단원자 형태로 고정될 수 있는 부위를 제공할 수 있는 것으로 판단된다. 예시적 구체예에 따르면, 상기 염기 성분은, 예를 들면, 수산화나트륨, 수산화칼륨, 수산화암모늄 등의 수용액일 수 있는 바, 구체적으로는 암모늄-함유 염기, 보다 구체적으로는 수산화암모늄(암모니아수)를 사용한다. 이때, 첨가되는 염기로서 코발트 전구체의 수용액과 조합 또는 혼하 시 침전을 유발하지 않는 종류를 사용하는 것이 유리하다. 한편, 본 개시 내용의 일 구체예에 따르면, 전술한 pH 조절된 알칼리-처리 실리카의 수계 분산물의 제조 단계와는 별도로, 코발트 전구체의 수용액을 제조하고, 염기 성분을 첨가하여 pH 조절된 코발트 전구체 수용액을 제조하는 단계가 수행될 수 있다(단계 d). 이와 관련하여, 코발트 전구체는 3+의 산화가를 갖는 코발트(Co(III)) 착이온을 포함하는 전구체일 수 있는 바, 예를 들면 Co(NH3)6Cl3를 직접 사용하거나, 또는Co(NO3)2, CoCl2, Co(acac)3 등으로부터 선택되는 적어도 하나의 코발트 화합물(전구체)을 암모니아수로 처리한 후에 여과를 통하여 코발트 착이온을 포함하는 전구체를 얻을 수 있다. 다만, 코발트 단원자 촉매로의 원활한 형성을 위하여 제조 단계를 최소화할 수 있는 Co(NH3)6Cl3를 전구체로 사용하는 것이 유리할 수 있다. 예시적 구체예에서 전구체 수용액 내 코발트 전구체의 농도는, 예를 들면 약 0.1 내지 20 중량%, 구체적으로 약 0.5 내지 10 중량%, 보다 구체적으로 약 1 내지 5 중량% 범위일 수 있다. 또한, 염기 성분을 첨가하여 코발트 전구체 용액의 pH를 조절할 수 있는 바, 이 역시 후속 단계 중 pH 조절된 알칼리-처리 실리카의 수계 분산물과의 조합 시 실리카 표면이 탈양성자화된 상태(즉, 음의 전하를 갖도록 개질된 상태)를 안정적으로 유지시킴으로써 양의 전하를 갖는 전구체의 코발트 이온(Co3+)이 실리카 표면에 정전기적 흡착 방식으로 고정될 수 있다. 이때, 염기 성분은 단계 c에서 언급된 종류 중 적어도 하나를 선택하여 사용할 수 있다. 예시적으로, 단계 c 및 단계 d 모두 동일한 염기 성분 또는 염기 화합물을 사용할 수 있다. 다만, 이때 첨가하는 염기로서 전술한 바와 같이 코발트 전구체의 수용액과 혼합될 경우에 침전을 유발하지 않는 종류를 사용하는 것이 바람직할 것이다. 또한, 염기 첨가를 통하여, 코발트 전구체 수용액의 pH는, 예를 들면 적어도 약 10, 구체적으로 적어도 약 11, 보다 구체적으로 약 10.5 내지 11.5 범위로 조절할 수 있다. 이와 같이, pH 조절된 Co(III) 전구체의 수용액이 제조되면, pH 조절된 알칼리-처리 실리카의 수계 분산물과 조합한다(단계 e). 이때, pH 조절된 코발트 전구체 수용액과 pH 조절된 알칼리-처리 실리카의 수계 분산물의 혼합 비는 코발트 전구체 수용액 내 코발트 이온이 알칼리-처리 실리카의 표면에 단원자 형태(구체적으로 단일 층의 단원자 형태)로 고정되는 량을 고려하여 정하여질 수 있다. 이와 관련하여, 코발트 이온은 실리카 표면에 최대 약 2 내지 3 중량% 만큼 단원자 형태로 담지 가능하나, 실제로는 사용된 코발트 전구체 전부가 실리카 표면에 고정될 수 없는 만큼, 이론 량에 비하여 과량의 코발트(Co(III)) 전구체를 용해시킬 수 있다. 예시적 구체예에 있어서, 코발트 전구체가 실리카 중량을 기준으로 약 1 내지 20 중량%, 구체적으로 약 2 내지 10 중량%, 보다 구체적으로 약 3 내지 8 중량% 범위가 되도록 코발트 전구체 수용액과 알칼리-처리 실리카의 수계 분산물의 혼합 비를 조절할 수 있다. 또한, 조합 과정에서 코발트 : 알칼리 금속의 중량 비는, 예를 들면 약 2000 : 1 내지 1 : 1, 구체적으로 약 1000 : 1 내지 10 :1, 보다 구체적으로 약 500 : 1 내 100 : 1의 범위 내에서 조절될 수 있다. 그 결과, 코발트 이온의 적어도 일부는 알칼리 금속 이온이 흡착된 실리카 표면 상에 정전기적으로 흡착될 수 있고, 더 나아가 알칼리 금속 이온(예를 들면, K+ 이온) 및 코발트 이온(Co3+ 이온)이 각각 단원자 형태로 고정된 실리카의 수계 분산물을 얻을 수 있다. 특히, 전구체 상태인 3+ 산화가의 코발트(또는 Co3+)는 앞서 알칼리 처리에 의하여 실리카 상에 도입된 알칼리 금속 이온으로 인하여 실리카 표면 상의 3원 고리 실록산이 존재하는 부위(사이트)에서만 강하게 결합할 수 있고, 그 외의 부위에서는 담지가 억제되는 것으로 판단된다. 즉, 실리카 지지체를 미리 알칼리 처리함으로써 코발트가 담지될 수 있는 부위가 한정되는 것이다. 반면, 알칼리-처리되지 않은 상태에서 코발트를 담지시킬 경우에는 원하지 않는 실리카 표면 부위(사이트), 예를 들면 단리된(isolated) 실란올기가 존재하는 부위에 코발트 이온이 약하게 부착되어 불안정한 상태의 코발트로 담지되고, 이는 추후 탈수소화 반응 중 다른 코발트와 폴리고머화(다이머화)되어 응집에 의한 입자화 현상을 유도함으로써 촉매 활성을 저하시키는 요인으로 작용하는 것으로 판단된다. 예시적 구체예에 따르면, 2가지 수계 유체(수계 실리카-분산물 및 코발트 전구체 수용액)의 조합은 교반 하에서 수행될 수 있는 바, 교반 속도는, 예를 들면 약 200 내지 500 rpm, 구체적으로 약 250 내지 400 rpm 범위일 수 있고, 또한 교반 시간은, 예를 들면 적어도 약 3분, 구체적으로 적어도 약 5 분, 보다 구체적으로 약 5 내지 10 분 범위일 수 있는 바, 반드시 상기 조건에 한정되는 것은 아니다. 또한, 조합 시 온도는 특별히 한정되는 것은 아니지만, 예를 들면 약 10 내지 40℃, 구체적으로 약 20 내지 30℃, 보다 구체적으로는 상온으로 설정할 수 있다. 그 다음, 알칼리 금속 및 코발트 전구체가 흡착된 실리카의 수계 분산물로부터 실리카 표면에 단원자 형태로 고정되지 않은 알칼리 금속 및 코발트를 가급적 완전히 제거한다(단계 f). 이는 함침 방식의 담지 방법과 구별되는 것으로, 실리카 표면에 전기적 상호 작용에 의하여 단원자 형태로 고정되어 있는 알칼리 금속(또는 알칼리 이온) 및 코발트(또는 Co3+)만을 남기고 제거하기 위함이다. 만약, 통상의 함침법에서와 같이 코발트 전구체가 실리카 표면에 벌크 상태로 부착될 경우에는 탈수소화 반응 중 환원, 응집 등과 같이 활성을 저하시키는 현상이 유발될 수 있다. 상술한 점을 고려하여, 예시적 구체예에서는 조합된 분산물 내 고형분(알칼리 금속 및 코발트 전구체가 흡착된(고정된) 실리카)을 정치(settling), 여과(filtering) 등과 같은 통상의 고-액 분리 공정에 의하여 분리할 수 있고, 필요 시 분리된 고형분에 물, 구체적으로 증류수를 첨가하여 교반을 수행하고, 다시 고형분을 분리하는 과정을 반복할 수 있다. 또한, 예시적으로, 분리된 고형분에 대하여는 물, 구체적으로 증류수를 이용하여 적어도 1회, 구체적으로 복수 회에 걸쳐 세척함으로써 흡착되지 않고 잔류하는 알칼리 금속 및 코발트 전구체를 가급적 남김없이 제거할 수 있다. 이후, 얻어진 고형분을 건조하는 바, 이때 건조 온도는 특별히 한정되는 것은 아니지만, 예를 들면 약 10 내지 40℃, 구체적으로 약 20 내지 30℃, 보다 구체적으로는 상온으로 설정할 수 있다. 이때, 코발트 이온의 산화 상태는 여전히 +3으로 유지된다. 후속 단계로서, 알칼리 금속 이온 및 코발트 이온이 흡착된(고정된) 실리카를 열처리함으로써 탈수소화 촉매로 전환시킨다(단계 f). 이때, 열 처리는 산소-함유 분위기 하에서 수행될 수 있는 바, 예를 들면 약 250 내지 1000℃, 구체적으로 약 275 내지 800℃, 보다 구체적으로 약 300 내지 600℃ 범위에서 열 처리 온도를 설정할 수 있다. 본 구체예에 있어서, 알칼리 금속 및 코발트가 흡착된(고정된) 실리카를 열 처리함에 따라 실리카 상에 흡착된 3+의 산화가를 갖는 코발트가 2+의 산화가를 갖는 코발트로 전환된다. 다만, 선택적으로, 산소-함유 분위기 하에서의 열 처리 단계에 앞서 추가 건조 단계를 수행할 수 있는 바, 이때 추가 건조 온도는, 예를 들면 약 50 내지 150 ℃, 구체적으로 약 120 내지 150℃ 범위일 수 있다. 이러한 상대적 고온 건조 과정에서는 3+ 산화가로 존재하는 코발트의 적어도 일부가 미리 2+ 산화가의 코발트로 부분 환원될 수 있다. 이와 관련하여, 본 발명이 특정 이론에 구속되는 것은 아니지만 열처리 후 코발트의 산화가가 2+로 유지되는 이유는 하기와 같이 설명될 수 있다. 코발트는 3+인 경우에는 최외각 오비탈에 6개의 전자를 차지하기 때문에 6개의 결합(bond)이 형성되는 8면체(octahedral)만 가능하다. 한편, 2+인 경우에는 최외각 오비탈에 7개의 전자가 존재하므로 주로 4면체(tetrahedral)를 형성하나 CoO의 경우에서와 같이 8면체도 가능하다. 본 구체예의 경우, 구조적으로 3원 실록산기와 결합하여야 하므로 4면체 구조를 형성하기 위하여 2+로 변화하는 것으로 볼 수 있다. 반면, 다시 3+로 존재하려면 주변과 어울려서 8면체를 형성해야 하는 바, 실리콘(Si)은 4면체 이외에 다른 구조를 갖지 않는 원소이므로 주변 환경과 부합되지 않아 3+의 코발트로 전환되지 않는 것으로 판단된다. 반면, 비활성화는 Si와의 연결(커뮤니케이션)이 절단되어 단독으로 Co 금속으로 응집된 것이기 때문에 산소와 접촉하여 산화물을 형성할 경우에는 3+의 코발트를 포함하는 Co3O4가 될 수 있는 것으로 판단된다. 또한, 열 처리 시간은 3+의 코발트가 2+의 코발트로 전환되는데 충분한 시간인 한, 특별히 한정되는 것은 아니지만, 예를 들면 약 2 내지 12시간, 구체적으로 약 2.5 내지 8 시간, 보다 구체적으로 약 3 내지 4 시간 범위일 수 있다. 상술한 열 처리 단계에서 소정 온도 이상으로 가열함에 따라 전환된 2+ 산화가의 코발트는 산소-함유(또는 산화) 분위기(또는 하소 분위기) 하에서 열처리가 지속되더라도 다시 3+ 산화가의 코발트로 전환되지 않는 바, 이는 단원자로서 사면체 구조를 유지해야 하기 때문이다. 더욱이, 촉매가 소정 온도 이상에서 운전되는 탈수소화 반응에 적용되는 경우에도 이러한 산화 상태는 변화하지 않는 바, 이는 본 구체예에 따른 촉매가 환원에 대한 내성을 갖고 있음을 지시한다. 탈수소화 반응 본 개시 내용의 다른 구체예에 따르면, 전술한 단원자 형태의 코발트계 촉매를 이용하여 파라핀, 구체적으로 경질 파라핀(보다 구체적으로 탄소수 2 내지 5의 경질 파라핀)을 탈수소화 반응에 의하여 이에 대응되는 올레핀으로 전환시키는 공정이 제공된다. 특히, 경질 파라핀으로서 프로판을 함유할 수 있다. 이와 관련하여, 공급원료는 가스 상으로 제공될 수 있다. 이때, 주목할 점은 상술한 촉매를 적용할 경우에 높은 파라핀 함량의 공급원료를 사용하더라도 양호한 전환율 및 선택도를 달성할 수 있다는 것이다. 예시적으로, 공급원료 내 파라핀 함량은, 예를 들면 적어도 약 50 체적%, 구체적으로 적어도 약 70 체적%, 보다 구체적으로 적어도 약 80 체적% 범위일 수 있고, 더 나아가 약 99 체적%를 초과하는 수준일 수도 있다. 이는 종래의 단원자 촉매(예를 들면, Zn 촉매)에 관한 실험에서 최대 약 20 체적%의 파라핀을 함유하는 공급원료를 대상으로 탈수소화 반응을 수행하는 점과 구별된다. 예시적 구체예에 따른 탈수소화 반응에 있어서, 반응 온도는, 예를 들면 약 500 내지 700℃, 구체적으로 약 550 내지 650℃, 보다 구체적으로 약 570 내지 620℃ 범위일 수 있고, 또한 반응 압력은, 예를 들면 약 0.3 내지 2 bar, 구체적으로 약 0.4 내지 1.5 bar, 보다 구체적으로 약 0.5 내지 1 bar 범위에서 조절될 수 있다. 이외에도, 표준상태에서 기상공간속도(GHSV)는, 예를 들면 약 100 내지 2000 hr-1, 구체적으로 약 200 내지 1500 hr-1, 보다 구체적으로 약 300 내지 1000 hr-1 범위 내에서 정하여질 수 있다. 상술한 탈수소화 반응 조건은, 공급원료 내 파라핀의 종류, 촉매 내 활성 금속 및 알칼리 금속의 담지 량 및 이의 비율 등을 고려하여 변경 가능하다. 예시적 구체예에 따르면, 탈수소화 반응 공정에 있어서 전환율 및 선택도 각각은, 예를 들면 적어도 약 30%(구체적으로 적어도 약 40%), 그리고 적어도 약 70%(구체적으로 적어도 약 80%) 수준일 수 있다. 본 발명은 하기의 실시예에 의하여 보다 명확히 이해될 수 있으며, 하기의 실시예는 본 발명의 예시 목적에 불과하며 발명의 영역을 제한하고자 하는 것은 아니다. 본 실시예에서 사용된 분석 기기 및 분석 방법은 하기와 같다. - EXAFS 본 발명에 의한 코발트 단원자 촉매의 코발트 단원자 규명 및 코발트 단원자 주변 환경의 변화를 분석하기 위하여 포항방사광가속기 (PAL PLS-II)의 8C 빔라인 (nano-XAFS, 4keV ∼ 20keV, 1012 photons/sec)에서 Co K-edge (7.709 keV) X-ray absorption spectroscopy (XAFS)를 측정하였다. I0의 흡수율은 15%, It+Ir의 흡수율은 85%가 되도록 가스를 조절하였으며, 모노크로매이터는 70%로 detune 하였다. 레퍼런스를 제외 (0.1 mm)한 모든 시료는 파우더를 2 mm 슬릿에 채워 넣어 편평하게 한 후 투과 모드로 측정하였다. - 전환율 및 선택도 계산 프로판의 전환율 및 선택도는 하기 수학식 1 및 2에 따라 산출하였다. [수학식 1] [수학식 2] 제조예 1 먼저 상업적으로 시판 중인 실리카 20 g을 200 ml의 증류수에 분산시키고, 0.144 g 중량의 KOH를 용해시킨 후 30분 동안 교반하여 실리카 수계 분산물을 제조하였다. 이후, 상기 실리카 수계 분산물에 28 중량%의 진한 암모니아수(삼전화학)를 첨가하여 분산물의 pH가 11이 되도록 조절함으로써 pH 조절된 칼륨-처리 실리카 수계 분산물을 제조하였다. 이와 별도로, 비이커에 5 g의 코발트 전구체(Co(NH3)6Cl3)를 50 ml의 증류수에 용해시키고, 28 중량%의 진한 암모니아수 (삼전화학)를 첨가하여 pH가 11이 되도록 조절하여 pH 조절된 코발트 전구체 수용액을 제조하였다. 그 다음, pH 조절된 코발트 전구체 수용액을 신속하게 pH 조절된 칼륨-처리 실리카 수계 분산물에 첨가하고 10분 동안 상온에서 교반하였다. 교반한 시료를 5분 동안 정치시킨 후에 액상은 버린 다음, 200 ml의 증류수를 다시 붓고 10분 동안 재차 교반하였다. 다시 교반한 시료를 정치시키고 용액을 버린 후에 남은 시료를 감압 여과하고, 증류수로 수회에 걸쳐 세척하였다. 여과된 시료는 상온에서 건조시킨 후, 125 ℃에서 다시 건조시켰다. 건조된 시료는 분당 5℃의 승온 속도로 300℃까지 승온시킨 후, 3 시간 동안 공기 중에 열처리하여 탈수소화 촉매(Co,K@SiO2 촉매)를 제조하였다. 비교제조예 1 제조예 1에서 사용된 실리카 20 g을 200 ml의 증류수에 분산시키고, 이를 28 중량%의 진한 암모니아수 (삼전화학)를 이용하여 용액의 pH가 11이 되도록 조절함으로써 pH 조절된 실리카 수계 분산물을 제조하였다. 이와 별도로, 비이커에 5 g의 코발트 전구체(Co(NH3)6Cl3)를 50 ml의 증류수에 용해시키고, 28 중량%의 진한 암모니아수 (삼전화학)를 첨가하여 pH가 11이 되도록 조절하여 pH 조절된 코발트 전구체 수용액을 제조하였다. 그 다음, pH 조절된 코발트 전구체 수용액을 신속하게 pH 조절된 실리카 수계 분산물에 첨가하고 10분 동안 상온에서 교반하였다. 교반한 시료를 5분 동안 정치시킨 후에 액상은 버린 다음, 200 ml의 증류수를 다시 붓고 10분 동안 재차 교반하였다. 다시 교반한 시료를 정치시키고 용액을 버린 후에 남은 시료를 감압 여과하고, 증류수로 수회에 걸쳐 세척하였다. 여과된 시료는 상온에서 건조시킨 후, 125 ℃에서 다시 건조시켰다. 건조된 시료는 분당 5℃의 승온 속도로 300℃까지 승온시킨 후, 3 시간 동안 공기 중에 열처리하여 탈수소화 촉매(Co@SiO2 촉매)를 제조하였다. 제조예 1 및 비교제조예 각각에 따라 제조된 촉매 내 코발트 함량 및 칼륨 함량을 하기 표 2에 나타내었다. 또한, 제조예 1 및 비교제조예 1 각각에 따라 제조된 코발트계 촉매에 대한 EXAFS 분석 결과를 도 1에 나타내었다. 도 1을 참조하면, Co 금속(Co foil)인 경우 파란선으로 나타낸 피크가 강하게 발현되는 바, 이는 Co-Co 결합으로서 Co 금속이 존재하는 경우에 나타나는 특성이다. 또한, 통상의 Co 산화물에 상당하는 Co3O4 및 CoO의 피크는 제1 피크(1st peak)의 Co-O 피크 및 제2 피크(2nd peak)의 Co-Co 피크가 관찰된다. 산화물인 경우에는 입자 내 결정질로 존재하여 단위 셀(unit cell)의 구조가 반복되므로 제2 피크가 잘 발달되어 있다. 반면, 비교제조예 1 및 제조예 1 각각에 따라 제조된 Co@SiO2 촉매 및 Co,K@SiO2 촉매는 모두 제1 피크는 잘 발달되어 있으나, 제2 피크는 현저히 감소하는 바, 이는 Co로부터 거리가 멀어지면서 구조가 발달되어 있지 않음을 지시한다(약간의 피크가 존재하는 것은 Co를 지지하고 있는 Si-O 결합을 고려할 때 Co-Si 결합 피크에 해당됨). 따라서, Co@SiO2 촉매(비교제조예 1) 및 Co,K@SiO2 촉매(제조예 1) 모두 Co가 단원자 형태로 존재함을 시사한다. 실험예 1 본 실험예에서는 제조예 1 및 비교제조예 1 각각에 따라 제조된 코발트계 촉매의 존재 하에서 고함량의 파라핀을 함유하는 반응물 가스로부터 올레핀을 합성하기 위한 탈수소화 반응을 수행하였다. 촉매 평가를 위한 탈수소화 반응은 3/4 인치 석영관 반응기(촉매 로딩 영역의 직경은 3/4 인치이고, 이를 제외한 관의 직경은 1/4 인치임)를 사용하여 수행하였다. 각각의 가스의 유량은 질량 흐름 제어기(Mass Flow Controller)를 이용하여 조절하였고, 반응기를 거친 생성물 가스는 온라인 가스크로마토그래피 장치(50m HP-PLOT 컬럼)를 통하여 분석하였다. 5 cc(약 3.3 g)의 촉매를 계량하여 석영 울로 반응관에 지지한 다음, 100 cc/min의 유량으로 N2 (99.999 %, 대성산업가스)를 흘려주면서 상온으로부터 590℃ 까지 분당 5℃/min의 속도로 승온시켰다. 이후, 안정화를 위하여 1 시간 동안 유지하면서 반응기 후단에 설치한 마이크로에어 펌프를 이용하여 반응관 내 압력이 약 0.5 bar가 되도록 감압하였다. 파라핀의 탈수소화 반응을 위하여 반응물 가스는 99.5% 프로판(리가스)을 20 cc/min의 유량으로 반응기 내에 주입되도록 하였다. 반응기를 거친 생성물 가스의 조성은 FID(flame ionization detector)를 이용하여 분석하였다. 그 결과를 도 2에 나타내었다. 도 2에 따르면, 탈수소화 반응 수행 결과, 제조에 1에 따른 촉매의 경우, 비교제조예 1에 따른 촉매에 비하여 촉매 대비 전환율은 다소 낮으나, 초기 선택도에 있어서는 현저히 높은 수준이었다. 이는 올레핀의 수율 면에서는 동등 이상임을 의미한다. 또한, 비교제조예 1에 따라 제조된 단원자 형태의 코발트계 촉매의 존재 하에서 실험예 1에서 프로판 탈수소화 반응을 수행한 후, EXAFS를 통하여 반응 전후의 변화를 관찰한 결과를 도 3에 나타내었다. 도 3을 참조하면, 탈수소화 반응 수행 결과, 비교제조예 1에 따른 촉매의 경우, 탈수소화 반응 후 Co가 단원자 형태로 존재하지 않고, 환원되어 Co 금속이 일부 형성되었다. 실험예 2 본 실험예에서는 제조예 1 및 비교제조예 1 각각에 따라 제조된 코발트계 촉매의 열 안정성을 확인하기 위하여, 고온의 열처리를 수행하였는 바, 구체적으로 공기 분위기 및 800℃에서 3 시간 동안 열처리하였다. 상기 열처리 후 촉매의 변화를 실험예 1에서 수행한 프로판 탈수소화 반응을 수행한 후의 촉매의 변화와 함께 EXAFS를 통하여 관찰한 결과를 도 4에 나타내었다. 도 4를 참조하면, 제조예 1에서와 같이 단원자 형태의 Co를 실리카에 담지하기에 앞서 K로 처리할 경우, 탈수소화 반응을 수행하거나, 또는 고온의 열처리한 후에도 Co가 단원자 형태로 존재하는 반면, 비교제조예 1의 경우에는 탈수소화 반응 또는 열처리 후에 Co 상태가 변화함을 알 수 있다. 비교제조예 2 본 제조예에서는 함침법에 의한 방법으로 코발트 단원자 촉매에 알칼리 금속을 처리하였다. 구체적으로, 비교제조예 1에 따라 제조된 코발트 단원자 촉매 5 g 및 칼륨 전구체로서 K(NO3) 0.065 g을 각각 계량하여 롤 믹서에 의하여 1 시간 동안 혼합하였고, 이에 증류수 5ml를 투입하고 30분 동안 교반하였다. 얻어진 분산액을 계속 교반하면서 70℃로 가열하여 수분을 제거한 후에 90℃로 유지되는 오븐 내에서 충분히 건조시켰다. 건조된 시료를 300℃에서 3 시간 동안 열처리하여 K/Co@SiO2 촉매를 제조하였다. 비교 제조예 3 본 제조예에서는 실리카 지지체에 통상적인 함침법에 의하여 알칼리 금속을 첨가한 후에 코발트를 담지하는 방법을 통하여 알칼리 금속이 첨가된 코발트 단원자 촉매를 제조하였다. 먼저, 실리카 5 g 및 칼륨 전구체로서 K(NO3) 0.065 g을 각각 계량하여 롤믹서에 의하여 1 시간 동안 혼합하였고, 이에 증류수 5ml를 투입하고 30분 동안 교반하였다. 얻어진 분산액을 계속 교반하면서 70℃로 가열하여 수분을 제거한 후에 90℃로 유지되는 오븐 내에서 충분히 건조시켰다. 건조된 시료를 300℃에서 3 시간 동안 열처리하여 알칼리 금속이 첨가된 실리카 지지체를 제조하였다. 이와 같이 제조된 지지체를 50 ml의 증류수에 분산시켰고, 이에 28 중량%의 진한 암모니아수 (삼전화학)를 첨가하여 분산물의 pH가 11이 되도록 조절하였다. 이와 별도로, 비이커에 5 g의 코발트 전구체(Co(NH3)6Cl3)를 50 ml의 증류수에 용해시키고, 28 중량%의 진한 암모니아수 (삼전화학)를 첨가하여 pH가 11이 되도록 조절하여 pH 조절된 코발트 전구체 수용액을 제조하였다. 그 다음, pH 조절된 코발트 전구체 수용액을 신속하게 pH 조절된 실리카 수계 분산물에 첨가하고 10분 동안 상온에서 교반하였다. 교반한 시료를 5분 동안 정치시킨 후에 액상은 버린 다음, 100 ml의 증류수를 다시 붓고 10분 동안 재차 교반하였다. 다시 교반한 시료를 정치시키고 용액을 버린 후에 남은 시료를 감압 여과하고, 증류수로 수회에 걸쳐 세척하였다. 여과된 시료는 상온에서 건조시킨 후, 125 ℃에서 다시 건조시켰다. 건조된 시료는 분당 5℃의 승온 속도로 300℃까지 승온시킨 후, 3 시간 동안 공기 중에 열처리하여 Co@K/SiO2 촉매를 제조하였다. 실험예 3 본 실험예에서는 제조예 1, 그리고 비교제조예 2 및 3 각각에 따라 제조된 알칼리 금속이 첨가된 코발트 단원자 촉매 3종을 이용하여 고함량의 파라핀을 함유하는 반응물 기체로부터 올레핀을 제조하기 위한 탈수소화 반응을 수행하였다. 상기 3종의 촉매를 보다 가혹한 조건 하에서 반응시켜 전환율, 선택도 및 비활성화 속도를 신속하게 확인하기 위하여, 0.8 cc(약 0.5 g)의 촉매를 3/4 인치 석영 관 반응기(촉매 로딩 영역의 직경이 3/4 인치이고 이를 제외한 관의 직경은 1/4 인치임)에 석영 울을 이용하여 지지하고, 100 cc/min의 유량으로 N2(99.999 %, 대성산업가스)를 흘려주면서 상온으로부터 575℃까지 5℃/min의 속도로 승온시켰다. 이후 안정화를 위하여 1 시간 동안 유지하였고, 가혹 조건 하에서 반응시키기 위하여 감압은 수행하지 않았다. 반응기의 온도가 안정화된 후, 파라핀의 탈수소화 반응을 위하여 반응물 기체는 99.5% 프로판을 3 cc/min의 유량으로 반응기 내에 주입되도록 하였다. 각각의 가스의 유량은 질량 흐름 제어기(Mass Flow Controller)를 이용하여 조절하였고, 반응기를 거친 생성물 가스는 온라인 가스크로마토그래피 장치(50m HP-PLOT 컬럼)를 통하여 분석하였다. 반응기를 거친 생성물 가스의 조성은 FID(flame ionization detector)를 이용하여 분석하였다. 그 결과를 도 5에 나타내었다. 도 5의 결과로부터, 단원자 형태의 코발트 담지 후에 칼륨(K)을 후처리한 경우(비교제조예 2) 및 통상의 함침법에 의하여 칼륨(K)을 실리카에 전처리한 후에 단원자 형태의 코발트를 담지한 경우(비교제조예 3), 탈수소화 반응 중 촉매의 활성이 저하되거나 코발트의 안정화 효과가 나타나지 않음을 확인하였다. 실험예 4 본 실험예에서는 제조예 1에 따라 제조된 코발트계 촉매를 사용하여 고함량의 파라핀을 함유하는 반응물 기체로부터 올레핀을 제조하기 위한 탈수소화 반응을 복수 회 반복하였다. 촉매 평가를 위한 탈수소화 반응은 3/4 인치 석영관 반응기(촉매 로딩 영역의 직경은 3/4 인치이고, 이를 제외한 관의 직경은 1/4 인치임)를 사용하여 수행하였다. 각각의 가스의 유량은 질량 흐름 제어기(Mass Flow Controller)를 이용하여 조절하였고, 반응기를 거친 생성물 가스는 온라인 가스크로마토그래피 장치(50m HP-PLOT 컬럼)를 통하여 분석하였다. 5 cc(약 3.3 g)의 촉매를 계량하여 석영 울로 반응관에 지지한 다음, 100 cc/min의 유량으로 N2 (99.999 %, 대성산업가스)를 흘려주면서 상온으로부터 590℃ 까지 분당 5℃/min의 속도로 승온시켰다. 이후, 안정화를 위하여 1 시간 동안 유지하면서 반응기 후단에 설치한 마이크로에어 펌프를 이용하여 반응관 내 압력이 약 0.5 bar가 되도록 감압하였다. 최초 탈수소화 반응을 위하여 반응물 가스는 99.5% 프로판 (리가스)을 20 cc/min의 유량으로 반응기 내에 주입되도록 하였고 100분 동안 유지하였다. 100분 간 탈수소화 반응을 수행한 다음, 30분 동안 N2 100cc/min 분위기 하에서 반응관 내부를 퍼지(purge)시켰다. 다음 촉매의 재생 단계에서는 공기(99.999%)를 100 cc/min의 유량으로 흘려주어 반응 단계에서 생긴 코크를 제거하였고, 이후 다시 30분 동안 N2 가스를 100 cc/min의 유량으로 흘려주어 반응관 내부를 퍼지시켰다. 반응-퍼지-재생-퍼지의 4 단계를 15회 반복한 후의 촉매의 변화를 EXAFS를 통하여 관찰한 결과를 도 6에 나타내었다. 도 6을 참조하면, 제조예 1에 따른 촉매는 약 600℃의 고온에서 반응-재생을 15회 반복해도 촉매 내 Co 성분이 단원자 형태를 안정적으로 유지함을 알 수 있다. 본 발명의 단순한 변형 내지 변경은 이 분야의 통상의 지식을 가진 자에 의하여 용이하게 이용될 수 있으며, 이러한 변형이나 변경은 모두 본 발명의 영역에 포함되는 것으로 볼 수 있다. Disclosed in the present disclosure are: a dehydrogenation catalyst in which a monoatomic type cobalt is supported on an inorganic oxide (specifically, silica) support having a monoatomic type alkali metal fixed by the pretreatment of an alkali metal; a method for producing same; and a method for preparing an olefin corresponding to a paraffin, specially a hard paraffin, by a dehydrogenation reaction of the paraffin in the presence of the dehydrogenation catalyst. 단원자 형태의 코발트계 촉매의 제조방법으로서, a) 실리카-함유 수계 분산물을 제조하는 단계; b) 상기 실리카-함유 수계 분산물 내에 알칼리 금속의 염을 용해시켜 알칼리-처리 실리카의 수계 분산물을 제조하는 단계; c) 상기 알칼리-처리 실리카의 수계 분산물에 염기 성분을 첨가하여 pH를 적어도 10으로 조절함으로써 pH 조절된 알칼리-처리 실리카의 수계 분산물을 제조하는 단계, 여기서 알칼리 금속 이온의 적어도 일부가 정전기적으로 실리카 표면 상에 흡착됨; d) 이와 별도로, 3+의 산화가를 갖는 코발트 전구체의 수용액을 제조하고 염기 성분을 첨가하여 pH를 적어도 10으로 조절함으로써 pH 조절된 코발트 전구체 수용액을 제조하는 단계; e) 상기 pH 조절된 알칼리-처리 실리카의 수계 분산물 및 상기 pH 조절된 코발트 전구체 수용액을 조합하여 3+의 산화가를 갖는 코발트 이온의 적어도 일부가 상기 알칼리 금속 이온이 흡착된 실리카 표면 상에 정전기적으로 흡착되어 있는 수계 분산물을 제조하는 단계; 및 f) 상기 알칼리 금속 이온 및 코발트 이온이 흡착된 실리카의 수계 분산물로부터 실리카 표면에 흡착되지 않은 알칼리 금속 및 코발트를 제거하는 단계; g) 상기 단계 f)로부터 얻어진 상기 알칼리 금속 이온 및 코발트 이온이 흡착된 실리카를 열처리하는 단계, 를 포함하고, 여기서, 상기 코발트계 촉매는, 2+ 산화가를 갖는 코발트 및 1+ 산화가를 갖는 알칼리 금속 각각이 실리카 상에서 단리된(isolated) 단원자 형태로 존재하고, 또한 상기 2+ 산화가를 갖는 코발트는 실리카의 표면에 존재하는 3원 실록산 고리에서 사면체 구조를 형성하며 배위되어 있는 방법. 제1항에 있어서, 상기 실리카는 비정질 실리카인 것을 특징으로 하는 방법. 제1항에 있어서, 상기 단계 a)에서 제조된 실리카-함유 수계 분산물 내 실리카의 함량은 1 내지 30 중량% 범위인 것을 특징으로 하는 방법. 제1항에 있어서, 상기 알칼리 금속은 나트륨(Na), 칼륨(K) 및 세슘(Cs)으로 이루어진 군으로부터 선택된 적어도 하나이고, 그리고 상기 알칼리 금속의 염은 알칼리 금속의 수산화물(hydroxide), 질산염(nitrate), 염화물(chloride), 탄산염(carbonate) 및 황산염(sulfate)으로 이루어진 군으로부터 선택된 적어도 하나인 것을 특징으로 하는 방법. 제1항에 있어서, 상기 단계 b) 중 알칼리 금속의 염은 수계 분산물 내 실리카 중량을 기준으로, 0.001 내지 3 중량% 범위인 것을 특징으로 하는 방법. 제1항에 있어서, 상기 단계 c) 중 염기 성분은 암모늄-함유 염기인 것을 특징으로 하는 방법. 제1항에 있어서, 상기 단계 d) 중 코발트 전구체는 3+의 산화가를 갖는 코발트(Co(III)) 착이온을 포함하는 전구체이고, 그리고 상기 코발트 전구체 수용액 내 코발트 전구체의 농도는 0.1 내지 20 중량% 범위인 것을 특징으로 하는 방법. 제7항에 있어서, 상기 코발트 전구체로서 Co(NH3)6Cl3를 직접 사용하거나, 또는 Co(NO3)2, CoCl2 및 Co(acac)3으로 이루어진 군으로부터 선택된 적어도 하나의 코발트 화합물을 암모니아수로 처리한 후에 여과를 통하여 얻어진 코발트 착이온을 포함하는 전구체를 사용하는 것을 특징으로 하는 방법. 제1항에 있어서, 상기 단계 e) 중 pH 조절된 코발트 전구체 수용액과 pH 조절된 알칼리-처리 실리카의 수계 분산물의 혼합 비는 코발트 전구체가 실리카 중량을 기준으로 1 내지 20 중량%가 되도록 조절되는 것을 특징으로 하는 방법. 제1항에 있어서, 상기 열 처리는 산소-함유 분위기 및 250 내지 1000℃의 온도 조건에서 수행되는 것을 특징으로 하는 방법. 제1항에 있어서, 상기 단계 g)에 앞서 상기 알칼리 금속 이온 및 코발트 이온이 흡착된 실리카를 50 내지 150 ℃로 건조하는 단계를 더 포함하며, 건조 후 코발트 이온의 산화가는 2+인 것을 특징으로 하는 방법. 지지체로서 알칼리 금속이 흡착된 실리카; 및 상기 지지체 상에 담지된 활성 금속으로서 코발트; 를 포함하는 단원자 형태의 코발트계 촉매로서, 2+의 산화가를 갖는 코발트 및 1+의 산화가를 갖는 알칼리 금속 각각이 실리카 상에서 단리된(isolated) 단원자 형태로 존재하고, 또한 상기 2+ 산화가를 갖는 코발트는 실리카의 표면에 존재하는 3원 실록산 고리에서 사면체 구조를 형성하며 배위되어 있는 탈수소화 촉매. 제12항에 있어서, 상기 촉매 내 코발트의 함량은 0.1 내지 10 중량% 범위인 것을 특징으로 하는 탈수소화 촉매. 제13항에 있어서, 상기 촉매 내 알칼리 금속의 함량은 0.00001 내지 1 중량% 범위인 것을 특징으로 하는 탈수소화 촉매. 제14항에 있어서, 상기 촉매 내 코발트(Co)/알칼리 금속의 중량 비는 1 내지 2000 범위인 것을 특징으로 하는 탈수소화 촉매. 파라핀을 함유하는 공급원료를 제공하는 단계; 제12항 내지 제15항 중 어느 한 항에 따른 촉매의 존재 하에서 500 내지 700℃의 온도 및 0.3 내지 2 bar의 압력 조건 하에 상기 공급원료에 대한 탈수소화 반응을 수행하는 단계; 및 상기 탈수소화 반응 생성물 중 상기 경질 파라핀에 대응되는 올레핀을 회수하는 단계; 를 포함하는 파라핀으로부터 올레핀을 제조하는 방법. 제16항에 있어서, 상기 공급원료는 가스 상으로 제공되는 것을 특징으로 하는 파라핀으로부터 올레핀을 제조하는 방법. 제17항에 있어서, 상기 파라핀은 탄소수 2 내지 5의 경질 파라핀인 것을 특징으로 하는 파라핀으로부터 올레핀을 제조하는 방법. 제18항에 있어서, 상기 공급원료 내 경질 파라핀의 함량은 적어도 50 체적%인 것을 특징으로 하는 파라핀으로부터 올레핀을 제조하는 방법. 제16항에 있어서, 상기 탈수소화 반응의 표준상태에서 기상공간속도(GHSV)는 100 내지 2000 hr-1 범위 내에서 설정되는 것을 특징으로 하는 파라핀으로부터 올레핀을 제조하는 방법.CATOFIN Oleflex Uhde SABIC 개발사 Lummus UOP Lrupp-Uhde SABIC 반응기 단열고정층 단열이동층 DH+ODH-단열 단열 고정층 및 FBR 운전방식 사이클릭 연속식 사이클릭 사이클릭 공급원료 C3-C4 C3-C4 C3-C4 C3 촉매 크롬계 담지촉매 Pt-Sn계 담지 촉매 Pt-Sn계 담지 촉매 Pt-Sn계 담지 촉매 반응온도(℃) 565-649 550-620 DH: 550-590ODH: 약 600 560-600 반응압력 (bar) 03-0.5 2-3 5-6 0.1-6 사이클 시간 15-30분 - 8시간 15-30분 Co 함량 (wt%) K 함량 (ppm) 비교제조예 1 3.36 n/d 제조예 1 2.86 60.1