GLUTAMIC ACID GREEN CLEAN FERMENTATION PROCESS
本发明属于氨基酸生产技术领域,具体涉及谷氨酸的绿色清洁发酵工艺。 谷氨酸,是一种酸性氨基酸。分子内含两个羧基,化学名称为α-氨基戊二酸。谷氨酸是里索逊1856年发现的,为无色晶体,有鲜味,微溶于水,而溶于盐酸溶液,等电点3.22。大量存在于谷类蛋白质中,动物脑中含量也较多。谷氨酸在生物体内的蛋白质代谢过程中占重要地位,参与动物、植物和微生物中的许多重要化学反应。谷氨酸钠俗称味精,是重要的鲜味剂,对香味具有增强作用。谷氨酸钠广泛用于食品调味剂,既可单独使用,又能与其它氨基酸等并用。用于食品内,有增香作用。在食品中浓度为0.2%-0.5%,每人每天允许摄入量为0-120微克/千克(以谷氨酸计)。在食品加工中一般用量为0.2-1.5克/公斤。 谷氨酸作为氨基酸生产中产量最大的氨基酸,目前,制备谷氨酸最常用的方法是微生物发酵法。谷氨酸棒杆菌是谷氨酸发酵的常规菌株。影响谷氨酸棒杆菌发酵产酸效率的因素较多,本领域对其改进主要包括以下几个方面:1、微生物在不同的环境条件下、利用不同底物代谢途径是不同的,有目的地对细胞代谢途径进行修饰和改造,改变细胞原有的代谢特征,可以提高目标产物的产量和得率;2、通过提高菌体的细胞膜通透性,增加谷氨酸分泌,进而解除菌体内高浓度谷氨酸的反馈调节作用,提高谷氨酸的产量;3、优化发酵培养基、发酵参数,使得菌体增殖速率提高,从而提高氨基酸的产量。申请人对谷氨酸的发酵作了长足的研究,例如中国发明专利“CN106148445A”公开了一种新的谷氨酸提取工艺,其中对发酵培养以及发酵参数进行了改进,降低了发酵成本,解决现有技术发酵培养基成本高,转化率低、硫酸和液氨消耗较高等缺陷;中国发明专利“CN107227324A”公开了一种谷氨酸生物素亚适量发酵工艺,利用发酵罐和膜偶联技术在发酵过程进行过滤透析,将发酵液中的谷氨酸及时分离,解除了发酵液中高浓度谷氨酸产生反馈调节;通过采用特定的透析发酵培养基配方进行再次发酵,提高菌体利用效率和糖酸转化率;另外,在发酵一定阶段后进行过滤透析可及时分离发酵液中的有毒害副产物,减小了对菌体产酸抑制;本发明所述发酵工艺通过透析发酵实现了菌体的再发酵技术,延长了谷氨酸发酵产酸周期,提高了菌体利用率,提高了糖酸转化率;中国发明专利“CN104099382A”公开了一种利用棉籽饼粉水解液发酵L-谷氨酸的方法,其在于:在L-谷氨酸发酵培养基中添加棉籽饼粉水解液,该棉籽饼粉水解液的氨基氮浓度为0.5-3.0%,所述的L-谷氨酸发酵培养基为温度敏感L-谷氨酸发酵培养基,所述棉籽 饼粉水解液的添加量为15-25ml/l,它通过控制棉籽饼粉水解液的添加量,有效保证L-谷氨酸发酵顺利进行,棉籽饼粉水解液的利用不但拓宽了有机氮源资源而且降低了发酵成本,在发酵行业中有广阔的应用前景。 现有技术的发酵生产中大量用玉米浆、豆粕水解液和糖蜜等色泽深、粘度大以及杂质多的发酵氮源物质,使得发酵过程难以控制,极易造成发酵的不稳定性及分离提取的困难。因此,可以通过对发酵培养基进行调整,采用杂质较少的营养成分,实现发酵的稳定性和分离提取的成本。清洁发酵技术主要是指发酵培养基的相对清洁,通过对发酵培养基的成分进行调整替代,使用成分简单、杂质少的营养物来代替成分复杂、杂质相对较多的营养物质,使得发酵液中杂质含量降低,传质和溶解氧效率得到提升,发酵过程更加稳定。L-谷氨酸发酵培养基中常添加玉米浆、豆粕水解液等作为发酵氮源并提供少量维生素,能够加快菌体生长速度。但是这类氮源含有大量蛋白质、色素和不溶性杂质等物质,使得发酵过程中容易起泡、溶氧效率低以及传质阻力大等问题,另外,由于玉米浆中的生物素含量不稳定,容易造成发酵产酸的波动。同时杂质较多的发酵液为后续的分离提取增加了困难。因此,以对照发酵培养基为根据,通过对发酵氮源的替代优化,最终确定了杂质含量少的清洁发酵培养基,使得发酵过程易于控制,发酵产酸更加稳定。 氨基酸合成代谢途径中,当四碳二羧酸全部由CO2固定反应供给时,最高理论糖酸转化率为81%;而当CO2固定反应完全不起作用,四碳二羧酸只能通过乙醛酸供给,最高理论转化率为54%。谷氨酸生产工艺已经发展相对成熟,主要技术指标为谷氨酸浓度10%-12%,糖酸转化率55%-60%。但是,与国外先进发酵工艺相比较,仍有较大的提升空间。有效地提高转化率,将可以节省原料成本、提升谷氨酸发酵的经济效益。利用谷氨酸棒杆菌进行谷氨酸发酵时的代谢副产物并不多,最主要的副产物是CO2。因此,强化谷氨酸棒杆菌代谢途径中的CO2固定反应,并为此让谷氨酸合成关键酶系有效地、相互协同作用,将有望提高CO2的回用率和糖酸转化率,节省原料成本、增加企业利润。
谷氨酸发酵的一个重点在于发酵培养期间谷氨酸生产菌细胞膜结构与功能上的特异性变化,使细胞膜转变成有利于谷氨酸向膜外渗透,即完成由谷氨酸非积累型细胞向谷氨酸积累型细胞的转变。这样,由于终产物谷氨酸不断地排出细胞外,使细胞内的谷氨酸不能积累到引起反馈调节的浓度,谷氨酸就会在细胞内继续不断地被优先合成,又不断地透过细胞膜,分泌到发酵培养基中,从而得以大量积累。调整细胞膜通透性的物质较多,不同的菌株之间细胞膜结构差异较大,因此并没有规律可循,选择合适的方法来调整细胞膜的通透性也是谷氨酸发酵工艺中需要解决的技术问题。 发明内容 本发明所要解决的技术问题在于提供谷氨酸的绿色清洁发酵工艺,有效解决了谷氨酸发酵过程中的多种问题,包括谷氨酸合成的效率、细胞通透性以及发酵清液培养基优化,提高了发酵效率,降低了谷氨酸分离纯化的难度。 本发明是通过如下技术方案来实现的。 谷氨酸的绿色清洁发酵工艺,其包括如下步骤:将谷氨酸棒杆菌接入装有清洁发酵培养基的发酵罐中进行发酵培养,总发酵时间为30-40h,其中,发酵培养0-8h,进行超声处理,并且通过流加氨水调节发酵液pH值至7.0-7.2;8h以后,往发酵罐中添加发酵调节剂,同时流加液氨调节发酵液的pH值至7.0-7.2。 进一步地,所述超声处理的条件为:超声波功率500W,频率20kHZ,超声时间50s,振幅65%,间隔时间5min。 进一步地,所述清洁发酵培养基为:葡萄糖80g/L,MnSO4·H2O 3mg/L,FeSO4·7H2O 3mg/L,MgSO4·7H2O 2g/L,Na2HPO4·12H2O 4g/L,KCl 2g/L,VB1 10mg/L,黄腐酸1mg/L,生物素7μg/L,菌体酶解液80ml/L。
进一步地,所述发酵调节剂为包含肌醇和甘油的水溶液。 进一步地,所述发酵调节剂为:肌醇1-2g/L,甘油10-20g/L。 进一步地,所述菌体酶解液的制备方法为:取谷氨酸发酵液中的谷氨酸棒杆菌菌体,干燥至水分含量小于5wt%的干菌体,用水稀释至干菌体浓度为50g/L,置于高速剪切机中以10000rpm的速度剪切120s,搅拌均匀得到菌悬液,往菌悬液中添加相同体积的浓度为1mol/L的盐酸溶液,混匀,在95℃下处理1h,之后添加胰蛋白酶进行水解,然后陶瓷膜过滤,收集滤液,即为菌体酶解液。 进一步地,所述胰蛋白酶的水解条件为:pH为8、温度为37℃、水解时间为6h;所述的胰蛋白酶的酶活力为4000U/g,添加量为:酶与底物干质量比为4%。 进一步地,所述陶瓷膜的截留分子量为5000-10000Da。 进一步地,所述高速剪切机的剪切速度为10000rpm,剪切时间为120s。 进一步地,所述工艺包括如下步骤: 将谷氨酸棒杆菌按照10-15%接种量将种子液接入装有清洁发酵培养基的发酵罐中进行发酵培养,发酵温度35-38℃,通风比1∶0.5-2,搅拌转速300-700r/min,溶氧维持在10%-30%,流加质量百分比浓度为80%的葡萄糖维持残糖为1%-2%,流加消泡剂消泡,发酵总时间33-34h;其中,发酵培养0-8h,在发酵开始后,打开超声波控制器,进行超声处理,超声处理的条件为:超声波功率500W,频率20kHZ,超声时间50s,振幅65%,间隔时间5min,并且通过流加25%的氨水调节发酵液pH值至7.0-7.2;8h以后,往发酵罐中一次性 添加发酵调节剂,添加量占发酵液体积的1-5%,同时流加液氨调节发酵液的pH值至7.0-7.2。 与现有技术相比,本发明取得的有益效果主要包括但是并不限于以下几个方面: 通过添加菌体蛋白酶解液来替代玉米浆,研究数据发现,随着菌体蛋白酶解液的添加,菌体浓度和谷氨酸含量均有所提升,但是添加过多的菌体蛋白酶解液不但造成浪费,而且使得发酵过程中容易起泡、溶氧效率低以及传质阻力大等问题,造成发酵效率下降。而对于清洁发酵的发酵上清液,影响其透光率的物质主要来自菌体的代谢,随着菌体产生杂质的增多而不断下降,但是其总体透光率远远高于玉米浆发酵,对后续的谷氨酸分离提取而言,可以大幅度降低生产成本。黄腐酸中含有大量酚羟基、羰基等基团,电解程度较高,促进谷氨酸合成过程中利用O2作为氢受体,进而减少丙酮酸作为氢受体,因此副产物乳酸和丙氨酸的生成量减少,进而提高谷氨酸的产量。本发明培养基的优化不但使得谷氨酸发酵过程更加稳定,易于控制,而且提高了谷氨酸产量和糖酸转化率,提高了发酵液的质量,降低了谷氨酸提取的成本,综合效益得到了提高。
实现各营养元素的合理配比,最大发挥菌体的产酸能力,以提高发酵转化率和产酸;谷氨酸产生菌增殖到较大值,谷氨酸生成酶系形成完全时,加入适量的肌醇,既可以强化CO2固定反应,削弱乙醛酸循环,保证三羧酸循环不被中断和源源不断供给α-酮戊二酸,通过还原氨基化反应,大量积累谷氨酸,提高发酵转化率;甘油提供碳骨架,促进谷氨酸的合成,并且能够提高细胞膜通透性,促进谷氨酸分泌到发酵液中。
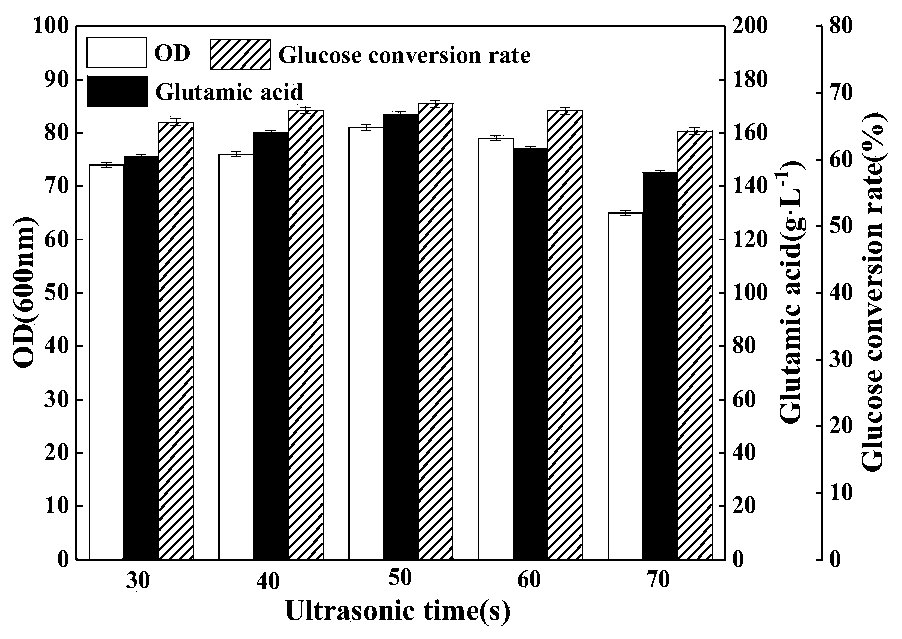
本发明通过单因素和正交试验,确定了最佳的超声波参数,包括强度、时间、振幅等,能够提高细胞膜的通透性,促进菌体活力、谷氨酸产量以及溶氧效率的提高,糖酵解所产生的丙酮酸不会过量积累,更多的进入三羧酸循环,相应地,丙酮酸所产生的代谢副产物乳酸和丙氨酸也有所降低。通过本研究可知,超声波辅助谷氨酸发酵,在适当的超声环境中,其能够有效提高菌体细胞膜的通透性,增加谷氨酸分泌,提高了谷氨酸的产量,也降低了发酵副产物,实现了谷氨酸发酵效益的提升。 图1:超声时间对谷氨酸发酵的影响; 图2:超声振幅对谷氨酸发酵的影响; 图3:间隔时间对谷氨酸发酵的影响; 图4:最佳超声条件发酵与对照发酵的对比; 图5:最佳超声条件对菌体转型时间和副产物的影响。 为了使本技术领域的人员更好地理解本申请中的技术方案,下面将结合本申请具体实施 例,对本申请的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。 实施例1 本实验选用的菌株为谷氨酸棒杆菌GDK-9(又名黄色短杆菌GDK-9,来源于天津科技大学,菌株出处也可参见“L-谷氨酸发酵的变温控制工艺研究,天津化工2010年”)。 谷氨酸的绿色清洁发酵工艺,其包括如下步骤:将谷氨酸棒杆菌GDK-9按15%接种量将种子液(OD600nm为10)接入装有30L清洁发酵培养基的50L全自动发酵罐中进行发酵培养,发酵温度38℃,通风比1∶0.7,搅拌转速500r/min,溶氧维持在20%,流加质量百分比浓度为80%的葡萄糖维持残糖为1.5%,流加消泡剂消泡,发酵总时间33h;其中,发酵培养0-8h(第一阶段),在发酵罐中插入耐高温超声波探头,在发酵开始后,打开超声波控制器,在一定的条件下进行超声处理,超声处理的条件为:超声波功率500W,频率20kHZ,超声时间50s,振幅65%,间隔时间5min,并且通过流加25%的氨水调节发酵液pH值至7.0-7.2;8h以后(第二阶段,选择第二阶段起始时添加发酵调节剂),往发酵罐中一次性添加发酵调节剂,添加量占发酵液体积的2%,同时流加液氨调节发酵液的pH值至7.0-7.2。
所述清洁发酵培养基为:葡萄糖80g/L,MnSO4·H2O 3mg/L,FeSO4·7H2O 3mg/L,MgSO4·7H2O2g/L,Na2HPO4·12H2O 4g/L,KCl 2g/L,VB1 10mg/L,黄腐酸1mg/L,生物素7μg/L,菌体酶解液80ml/L;在115℃下灭菌15min。
所述清洁发酵培养基对常规培养基进行了改进,其中: 使用菌体酶解液替代玉米浆作为发酵氮源; 定量添加生物素替代玉米浆中的生物素; 在发酵培养基中添加黄腐酸; 所述菌体酶解液的制备方法为:取谷氨酸发酵液中的谷氨酸棒杆菌菌体,干燥至水分含量小于5wt%的干菌体,用水稀释至干菌体浓度为50g/L,置于高速剪切机中以10000rpm的速度剪切120s,得到菌悬液,往菌悬液中添加相同体积的浓度为1mol/L的盐酸溶液,混匀,在95℃下处理1h,之后添加胰蛋白酶进行水解,然后陶瓷膜过滤,收集滤液;陶瓷膜的截留分子量为10000Da;过滤去除难以被菌株利用的大分子物质,包括细胞壁组分、大分子蛋白等。 即得到蛋白质含量为231mg/g(干菌体)、总游离氨基酸含量为367mg/g(干菌体)的菌体蛋白酶解液。 所述的胰蛋白酶的水解条件为:pH为8、温度为37℃、水解时间为6h;所述的胰蛋白酶 的酶活力为4000U/g,添加量为:酶与底物干质量比为4%。 实施例2 谷氨酸的绿色清洁发酵工艺,其包括如下步骤:将谷氨酸棒杆菌GDK-9按10%接种量将种子液(OD600nm为14)接入装有30L清洁发酵培养基的50L全自动发酵罐中进行发酵培养,发酵温度37℃,通风比1∶0.8,搅拌转速300-700r/min,溶氧维持在25%,流加质量百分比浓度为80%的葡萄糖维持残糖为1%,流加消泡剂消泡,发酵总时间34h;其中,发酵培养0-8h,在发酵罐中插入耐高温超声波探头,在发酵开始后,打开超声波控制器,在一定的条件下进行超声处理,超声处理的条件为:超声波功率500W,频率20kHZ,超声时间50s,振幅65%,间隔时间5min,并且通过流加25%的氨水调节发酵液pH值至7.0-7.2;8h以后,往发酵罐中一次性添加发酵调节剂,添加量占发酵液体积的3%,同时流加液氨调节发酵液的pH值至7.0-7.2。
所述清洁发酵培养基为:葡萄糖80g/L,MnSO4·H2O 3mg/L,FeSO4·7H2O 3mg/L,MgSO4·7H2O2g/L,Na2HPO4·12H2O 4g/L,KCl 2g/L,VB1 10mg/L,黄腐酸1mg/L,生物素7μg/L,菌体酶解液80ml/L。
所述清洁发酵培养基对常规培养基进行了改进,其中: 使用菌体酶解液替代玉米浆作为发酵氮源; 定量添加生物素替代玉米浆中的生物素; 在发酵培养基中添加黄腐酸; 所述发酵调节剂为:肌醇1.5g/L,甘油15g/L。 实施例3 谷氨酸发酵培养基的优化。 1、菌体蛋白酶解液的添加量对发酵液中菌体浓度以及谷氨酸产量的影响,选择添加量为20,40,60,80,100,120(ml/L)五个浓度梯度,结果发现,随着添加量的增加发酵液中菌体 表1 通过添加菌体蛋白酶解液来替代玉米浆(10g/L,发酵液中OD600nm为65.8,谷氨酸产量151g/L,透光率(T430)为0.98),数据发现,随着菌体蛋白酶解液的添加,菌体浓度和谷氨酸含量均有所提升,当添加到10mg/L时,菌体浓度和谷氨酸含量达到峰值,添加过多的菌体蛋白酶解液不但造成浪费,而且使得发酵过程中容易起泡、溶氧效率低以及传质阻力大等问题,造成发酵效率下降。而对于清洁发酵的发酵上清液,影响其透光率的物质主要来自菌体的代谢,随着菌体产生杂质的增多而不断下降,结束发酵时透光率为6.1,但是其总体透光率远远高于玉米浆发酵,对后续的谷氨酸分离提取而言,可以大幅度降低生产成本。
2、黄腐酸的添加量对发酵液中谷氨酸和丙氨酸产量的影响,选择添加量为0,0.5,1,2,4(mg/L)五个浓度梯度,具体见表2: 表2 黄腐酸中含有大量酚羟基、羰基等基团,电解程度较高,促进谷氨酸合成过程中利用O2作为氢受体,进而减少丙酮酸作为氢受体,因此副产物乳酸和丙氨酸的生成量减少,进而提高谷氨酸的产量。随着黄腐酸添加量的增加,丙氨酸的含量逐步降低,伴随着谷氨酸产量的增加,当增加到1mg/L后,丙氨酸和谷氨酸的变化量不大,考虑到成本因素,选择1mg/L的添加量最为合适。
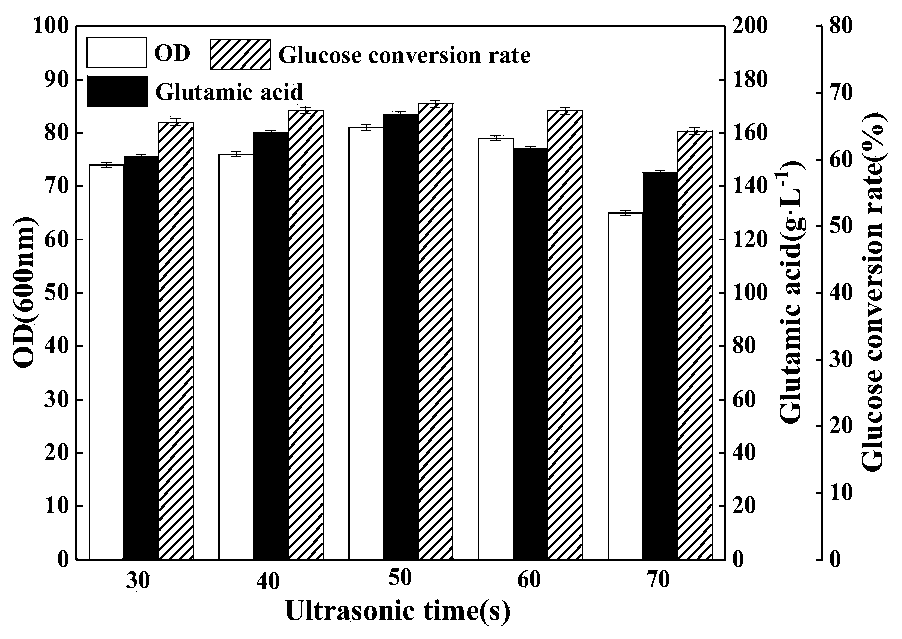
总之,本发明培养基的优化不但使得谷氨酸发酵过程更加稳定,易于控制,而且提高了谷氨酸产量和糖酸转化率,提高了发酵液的质量,降低了谷氨酸提取的成本,综合效益得到了提高。 实施例4 发酵调节剂对转化率和谷氨酸产量的影响。 设置对照组,其中: 对照组1:不添加发酵调节剂,其余同实施例1; 对照组2:发酵调节剂只包含肌醇,其余同实施例1; 对照组3:发酵调节剂只包含甘油,其余同实施例1; 实验组为实施例1。 各组转化率和谷氨酸浓度见表3。 表3 结论:设置对照组,研究发酵调节剂中肌醇和甘油两种组分对转化率和谷氨酸产量的影响,由表3可见,二者具备一定的协同效果,能够明显提高转化率和谷氨酸产量。 实施例5 超声对谷氨酸发酵的影响。 1、超声时间对谷氨酸发酵的影响 在超声振幅为70%,间隔时间为10min的条件下,不同超声时间对谷氨酸发酵的影响如图1。从图1中可以看出,随着超声时间的增加,菌体OD600nm值、谷氨酸产量和糖酸转化率也不断上升,在连续超声时间为50s时达到最大值,之后随着超声时间的延长,三者开始下降,尤其以菌体OD600nm值和谷氨酸产量下降较快。分析可知,适当时长的超声处理可以提高细胞膜的通透性,提高菌体的酶活力,加快菌体生长速度,进而能够提高谷氨酸的分泌和糖酸转化率。但是当连续超声时间过长,势必会对菌体细胞膜造成一定程度的损伤,也会扰乱正常的菌体代谢活动,降低菌体的生长能力和产酸量。选择最佳的超声时间才能达到较好的效果,因此选取50s作为连续超声时间。
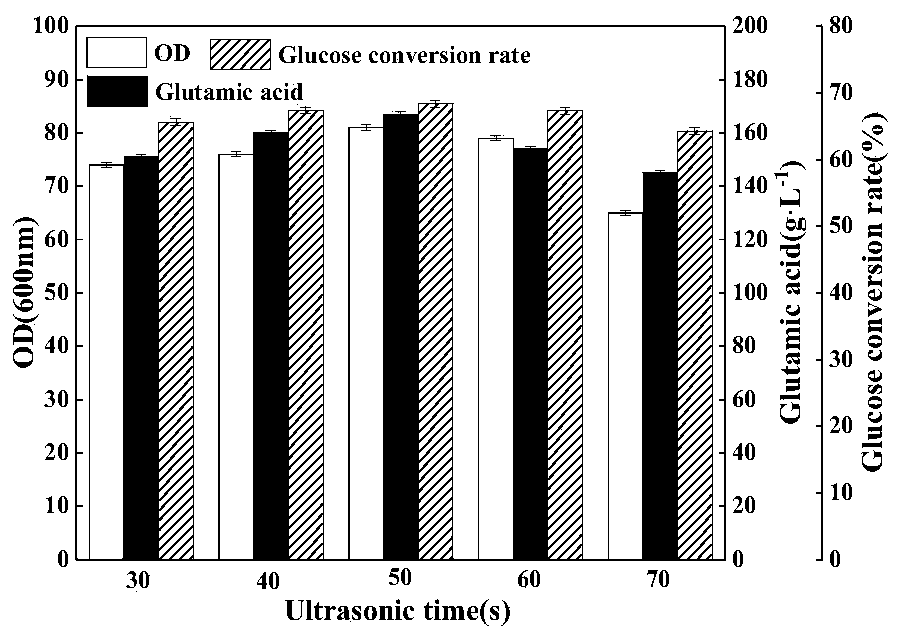
2、超声振幅对谷氨酸发酵的影响 在最佳超声时间为50s,间隔时间为10min的条件下,不同超声振幅对谷氨酸发酵的影响如图2所示。可以明显的看出,在超声振幅为55-65%范围内时,OD600nm值、谷氨酸产量和糖酸转化率不断增加,尤其是菌体量和谷氨酸产量增加十分明显;当超声振幅高于65%后,三者出现明显的下降,尤其是菌体量的降低。其主要原因是,适当强度的超声振幅能够提高菌体生长速度和产酸速率,而过高的超声振幅会对菌体的正常生长产生较大的损害,降低菌体活力,不利于菌体生长和谷氨酸合成。因此选择65%作为最佳超声振幅。
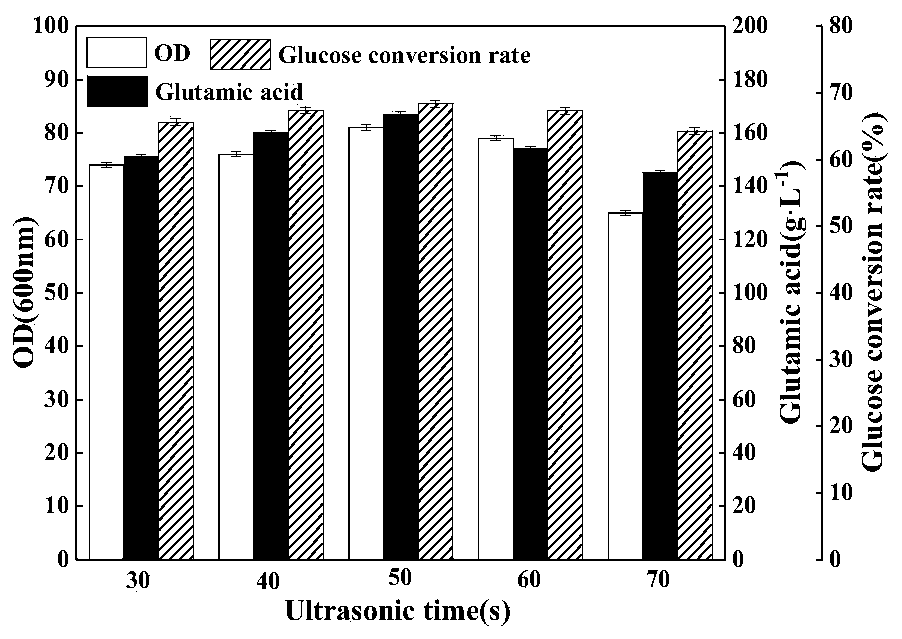
3、间隔时间对谷氨酸发酵的影响 在最佳超声时间为50s,最佳超声振幅为65%的条件下,不同超声间隔时间对谷氨酸发酵的影响如图3所示。从图中可以看出,超声时间间隔对菌体OD600nm值、谷氨酸产量和糖酸转化率的影响是很明显的。间隔时间(4min)太短,也就是超声频率高,超声强度较大,对菌体的损害比较严重,不但不能促进菌体生长和谷氨酸分泌,反而对菌体有一定程度的抑制作用。随着间隔时间(6min)的增加,超声强度刚好适宜,菌体OD600nm值、谷氨酸产量和糖酸转化率都得到了提升。而当间隔时间过长时,虽然OD600nm值的增长不太明显,但是对细胞膜的损伤效果太低,又由于菌体自身的细胞膜修复功能,因此细胞膜的通透性并未得到提高,并未对菌体产生实质性的效果,因此谷氨酸产量和糖酸转化率开始往普通发酵水平靠近。故选择6min作为最佳超声间隔时间。
4、正交试验结果分析 在上述单因素试验结果的基础上,进行正交试验设计,其实验结果见表4,方差分析见表5。 表4超声波辅助谷氨酸发酵正交试验设计及结果 表5方差分析 一方面,由正交试验结果和极差(R)分析可知,对于菌体OD600nm值的影响次序为A>B>C,即超声时间>振幅>间隔时间,最佳条件为A2B2C3,即超声时间50s、振幅65%、间隔时间7min;对谷氨酸产量的影响次序为B>A>C,即振幅>超声时间>间隔时间,最佳条件为A2B2C1,即超声时间50s、振幅65%、间隔时间5min;对糖酸转化率的影响次序为B>A>C,即振幅>超声时间>间隔时间,最佳条件为A2B2C1,即超声时间50s、振幅65%、间隔时间5min。另一方面,由方差分析可知,超声时间和振幅对OD600nm值、谷氨酸产量都有显著影响,间隔时间对OD600nm值影响显著。综合考虑以上试验结果,在既能够达到一定量OD600nm值的同时,又能够提高谷氨酸产量和糖酸转化率,因此最佳超声条件选择A2B2C1,即超声时间50s、振幅65%、间隔时间5min。
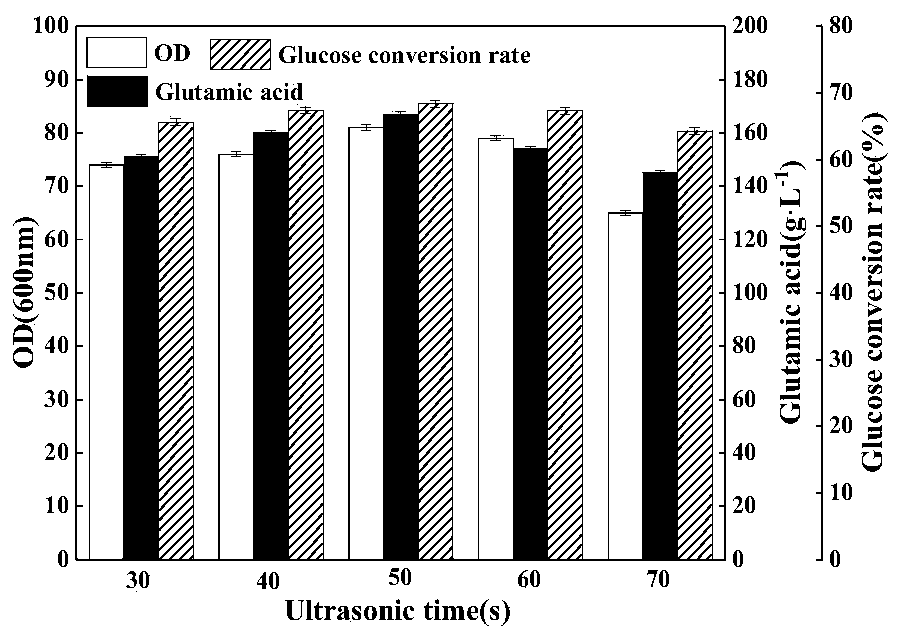
5、验证实验结果分析 依据正交试验所得最佳超声条件,进行3批次平行发酵验证,所得试验结果如图4所示。由图4分析可知,无论是菌体OD600nm值,还是谷氨酸产量和糖酸转化率,超声发酵都比对照发酵有一定程度的提升。对照发酵的开始产酸时间(即谷氨酸菌体开始完成由谷氨酸非积累型菌体向谷氨酸积累型菌体的转变)一般为4h左右,而超声发酵开始能够检测到谷氨酸的时间为发酵2h,并且产酸速率迅速上升。同时结合镜检发现,2h时超声发酵的部分谷氨酸菌体已经拉长、膨大成为了产酸型菌体,开始菌体的转型。因此,对比对照发酵,超声发酵开始产酸的时间提前了2h。超声结束时间之所以选在发酵8h,一方面是因为谷氨酸棒状杆菌的细胞壁较厚,对细胞膜有一定的保护作用,超声时间太短,并不能起到损伤细胞膜以提高其通透性的作用;另一方面,菌体自身也有一定的细胞膜修复能力,因此要有足够的超声时长才能够维持细胞膜通透性的提高。8h时对超声发酵进行镜检发现,几乎所有菌体已完成谷氨酸菌体的转型,不需要对细胞膜进行更多的损伤,同时菌体的OD600nm值也即将达到最大值(14h左右),菌体的活力即将达到最高,如果继续进行超声处理,可能会对菌体造成严重损害,并会降低菌体活力,因此选择8h结束超声处理。总的来看,超声发酵的OD600nm值为82.5,较对照发酵的72.5,提高了13.8%;谷氨酸产量为168g/L,较对照发酵的151g/L,提高了11.3%;糖酸转化率为68.2%,较对照发酵的65.4%,提高了4.3%。图4中,A、C、E分别为对照发酵的OD600nm值、谷氨酸产量和糖酸转化率;B、D、F分别为最佳超声条件发酵的OD600nm 值、谷氨酸产量和糖酸转化率。
此外,由于菌体活力、谷氨酸产量的提高,溶氧效率的提高,可知TCA循环的速率和通量也得到了提升,而由糖酵解所产生的丙酮酸并不会过量积累,反而会更多的进入三羧酸循环,因此由丙酮酸所产生的代谢副产物乳酸和丙氨酸也有所降低。如图5所示,分别由对照发酵(不采用超声)的3.6g/L、2.54g/L降低至超声发酵的2.3g/L、1.75g/L,分别降低了36.11%、31.10%。 通过以上研究可知,超声波辅助谷氨酸发酵,在适当的超声环境中,其能够有效提高菌体细胞膜的通透性,增加谷氨酸分泌,提高了谷氨酸的产量,也降低了发酵副产物,实现了谷氨酸发酵效益的提升。 以上列举的仅是本发明的最佳具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。 A glutamic acid fermentation process, comprising the following steps: introducing Corynebacterium glutamicum into a fermentation tank filled with a clean fermentation medium for fermentation culture, performing ultrasonic treatment, and adjusting the pH value of the fermentation broth. 谷氨酸的绿色清洁发酵工艺,其特征在于,所述工艺包括如下步骤:将谷氨酸棒杆菌接入装有清洁发酵培养基的发酵罐中进行发酵培养,总发酵时间为30-40h;其中,发酵培养0-8h,进行超声处理,并且通过流加氨水调节发酵液pH值至7.0-7.2;8h以后,往发酵罐中添加发酵调节剂,同时流加液氨调节发酵液的pH值至7.0-7.2。 根据权利要求1所述的工艺,其特征在于,所述超声处理的条件为:超声波功率500W,频率20kHZ,超声时间50s,振幅60-65%,间隔时间5-6min,超声总时间为8h;优选地,振幅65%,间隔时间5min。 根据权利要求1-2任其一所述的工艺,其特征在于,所述清洁发酵培养基为:葡萄糖80g/L,MnSO4·H2O 3mg/L,FeSO4·7H2O 3mg/L,MgSO4·7H2O 2g/L,Na2HPO4·12H2O 4g/L,KCl 2g/L,VB110mg/L,黄腐酸1mg/L,生物素7μg/L,菌体酶解液80ml/L。
根据权利要求1-3任其一所述的工艺,其特征在于,所述发酵调节剂为包含肌醇和甘油的水溶液。 根据权利要求1-4任其一所述的工艺,其特征在于,所述发酵调节剂为:肌醇1-2g/L,甘油10-20g/L。 根据权利要求3所述的工艺,其特征在于,所述菌体酶解液的制备方法为:取谷氨酸发酵液中的谷氨酸棒杆菌菌体,干燥至水分含量小于5wt%的干菌体,用水稀释至干菌体浓度为50g/L,置于高速剪切机中剪切,得到菌悬液,往菌悬液中添加相同体积的浓度为1mol/L的盐酸溶液,混匀,在95℃下处理1h,之后添加胰蛋白酶进行水解,然后陶瓷膜过滤,收集滤液,即为菌体酶解液。 根据权利要求6所述的工艺,其特征在于,所述胰蛋白酶的水解条件为:pH为8、温度为37℃、水解时间为6h。 根据权利要求6所述的工艺,其特征在于,所述陶瓷膜的截留分子量为5000-10000Da。 根据权利要求6所述的工艺,其特征在于,所述高速剪切机的剪切速度为10000rpm,剪切时间为120s。 根据权利要求1-9任其一所述的工艺,其特征在于,所述工艺包括如下步骤: 将谷氨酸棒杆菌按照10-15%接种量将种子液接入装有清洁发酵培养基的发酵罐中进行发酵培养,发酵温度35-38℃,通风比1∶0.5-2,搅拌转速300-700r/min,溶氧维持在10%-30%,流加质量百分比浓度为80%的葡萄糖维持残糖为1%-2%,流加消泡剂消泡,发酵总时间33-34h;其中,发酵培养0-8h,在发酵开始后,打开超声波控制器,进行超声处理, 超声处理的条件为:超声波功率500W,频率20kHZ,超声时间50s,振幅65%,间隔时间5min,并且通过流加25%的氨水调节发酵液pH值至7.0-7.2;8h以后,往发酵罐中一次性添加发酵调节剂,添加量占发酵液体积的1-5%,同时流加液氨调节发酵液的pH值至7.0-7.2。技术领域
背景技术
附图说明
具体实施方式
20 60.7 143.6 40 68.9 152.1 60 75.3 159.8 80 81.8 167.0 100 80.1 163.5 120 76.9 156.9 0 3.3 160.5 0.5 2.4 163.8 1 1.8 167.0 1.5 1.7 166.8 2 1.7 167.1 对照组1 60.4 151.7 对照组2 64.7 159.6 对照组3 62.8 162.9 实验组 68.5 169.2