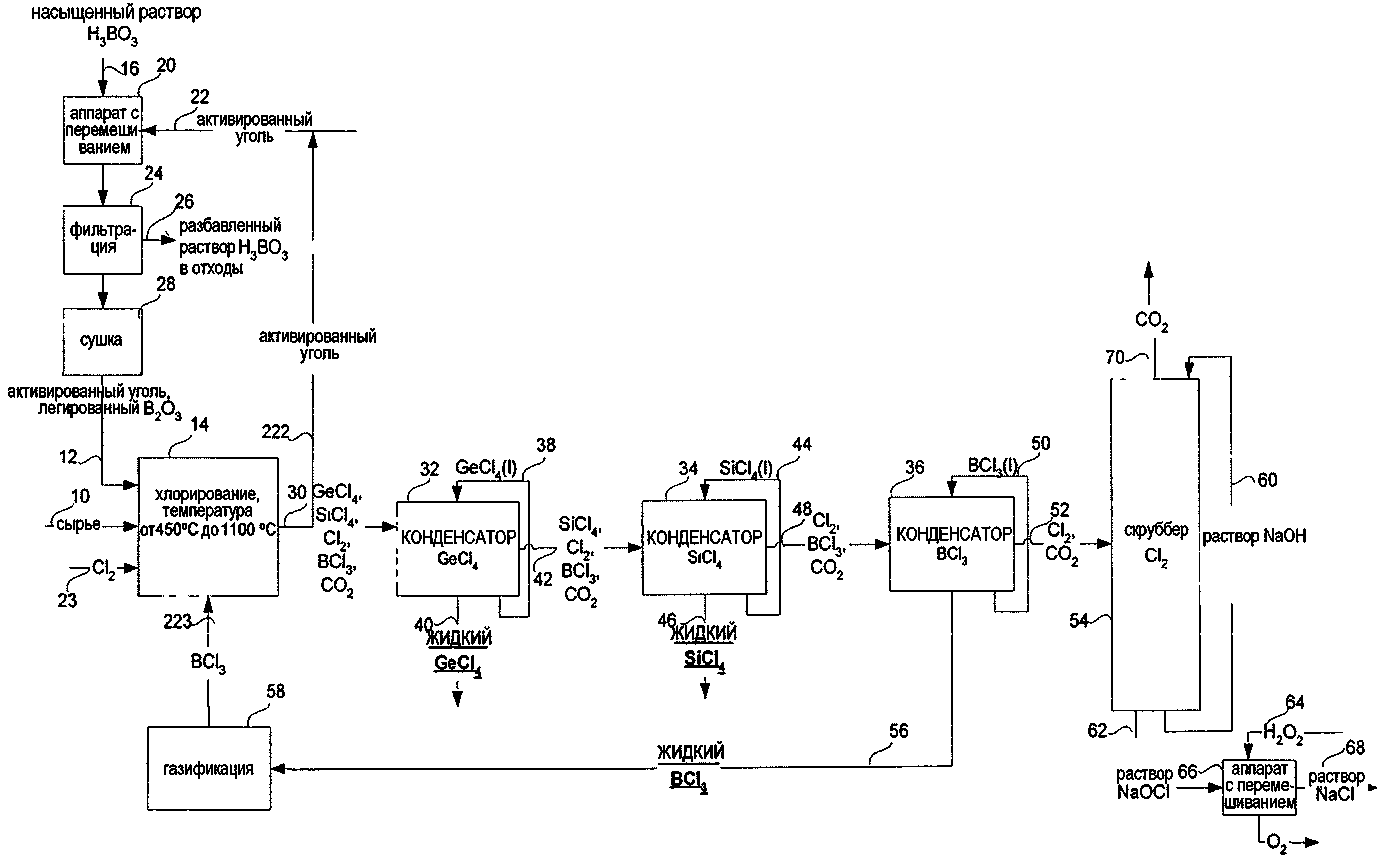
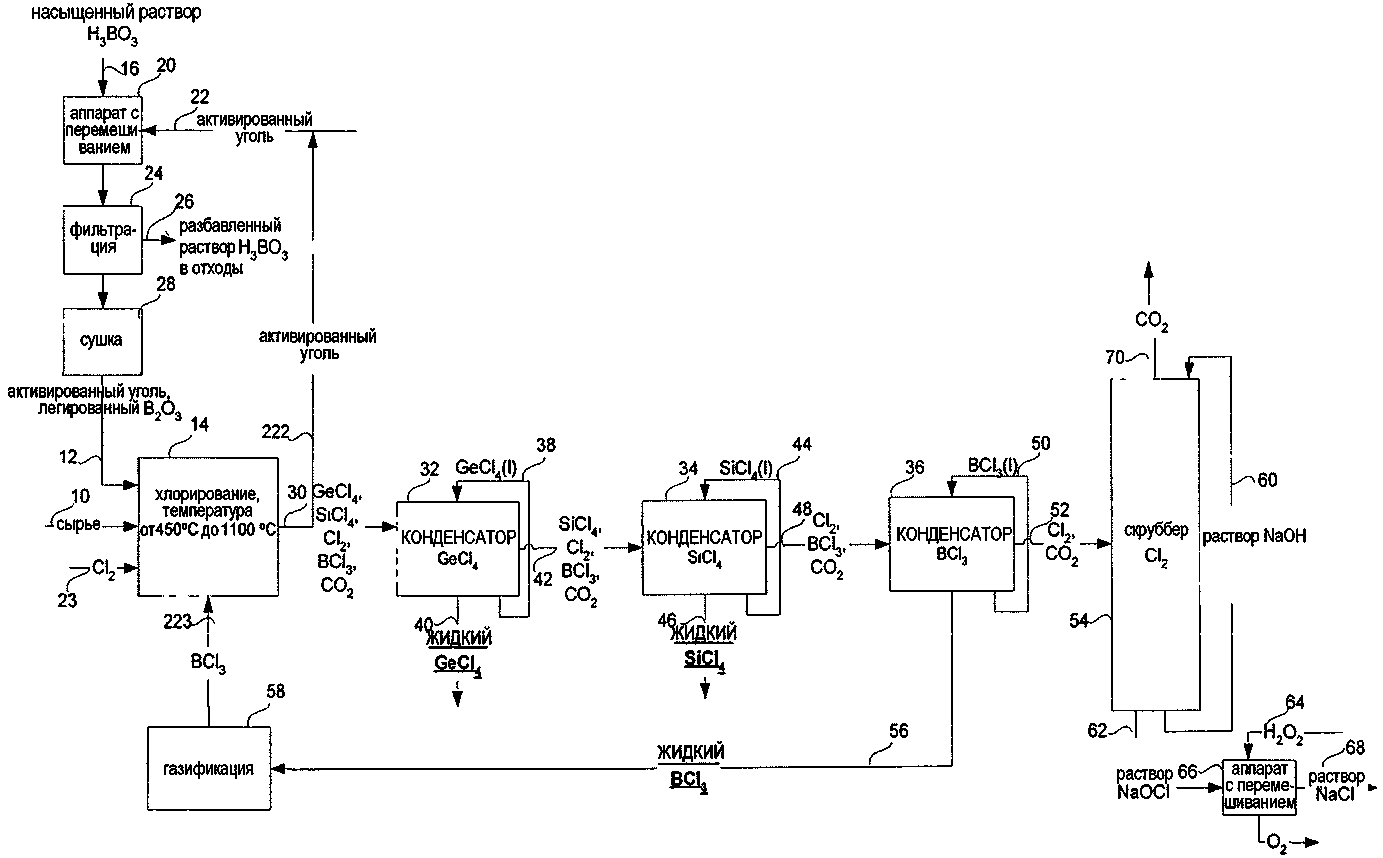
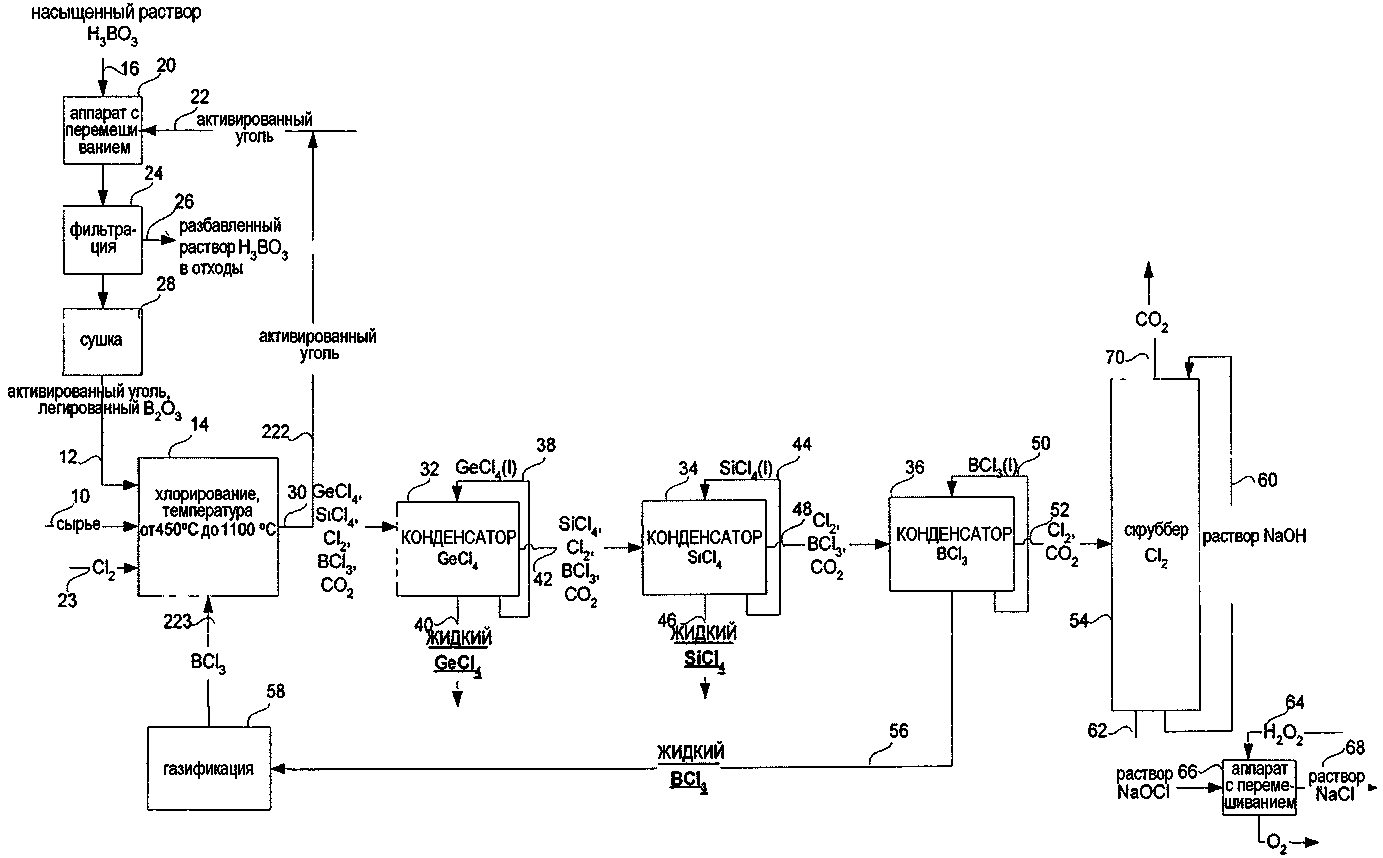
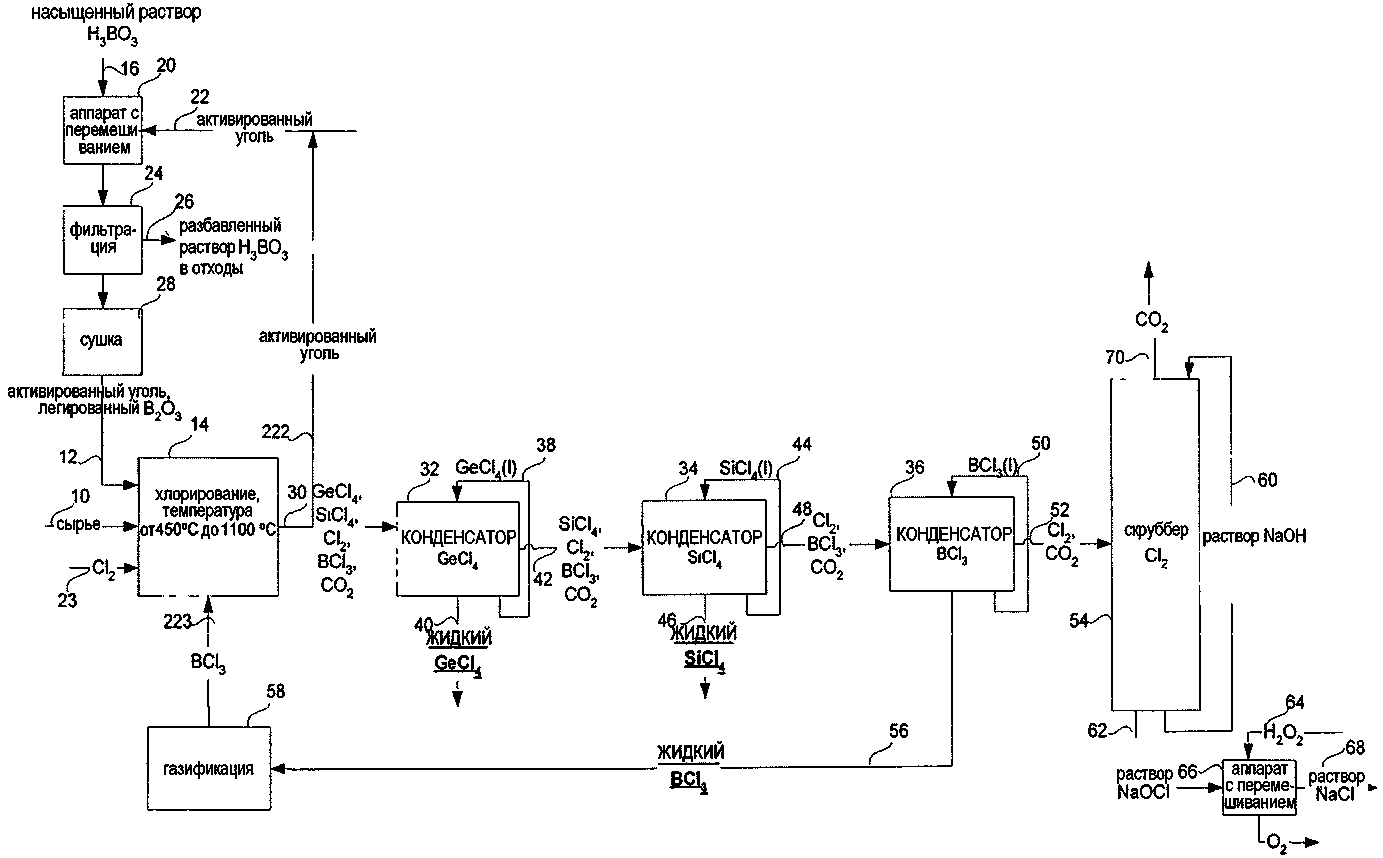
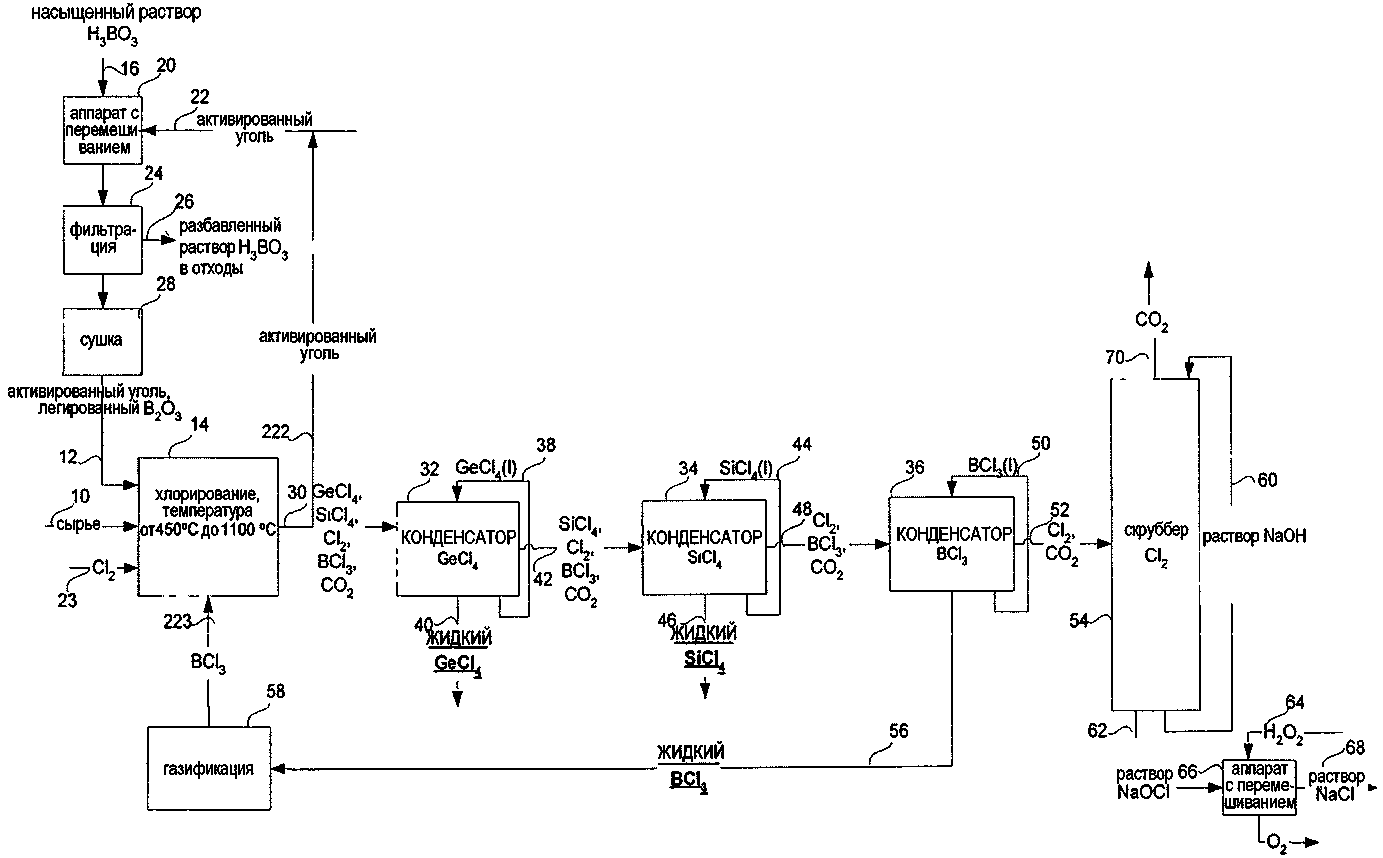
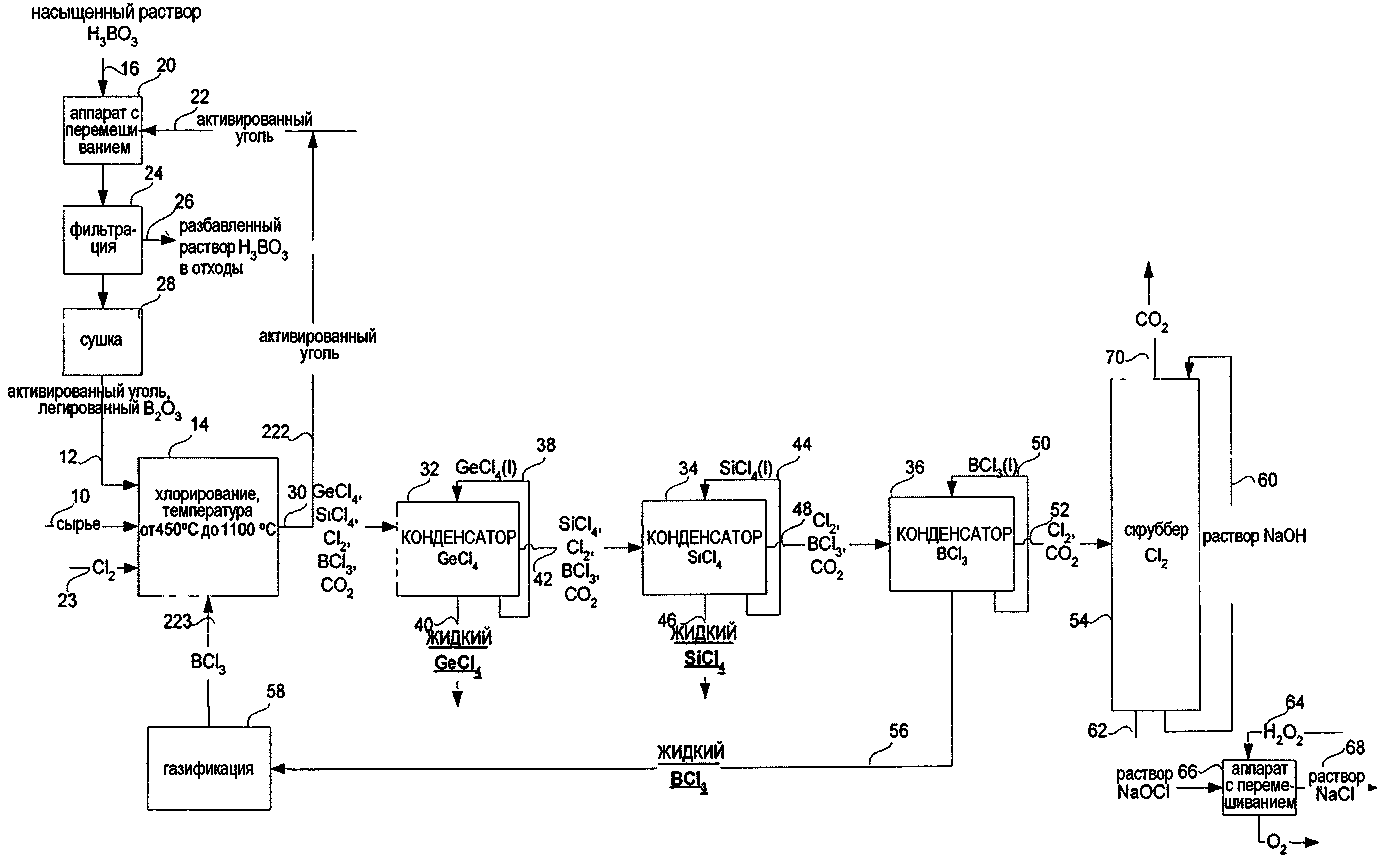
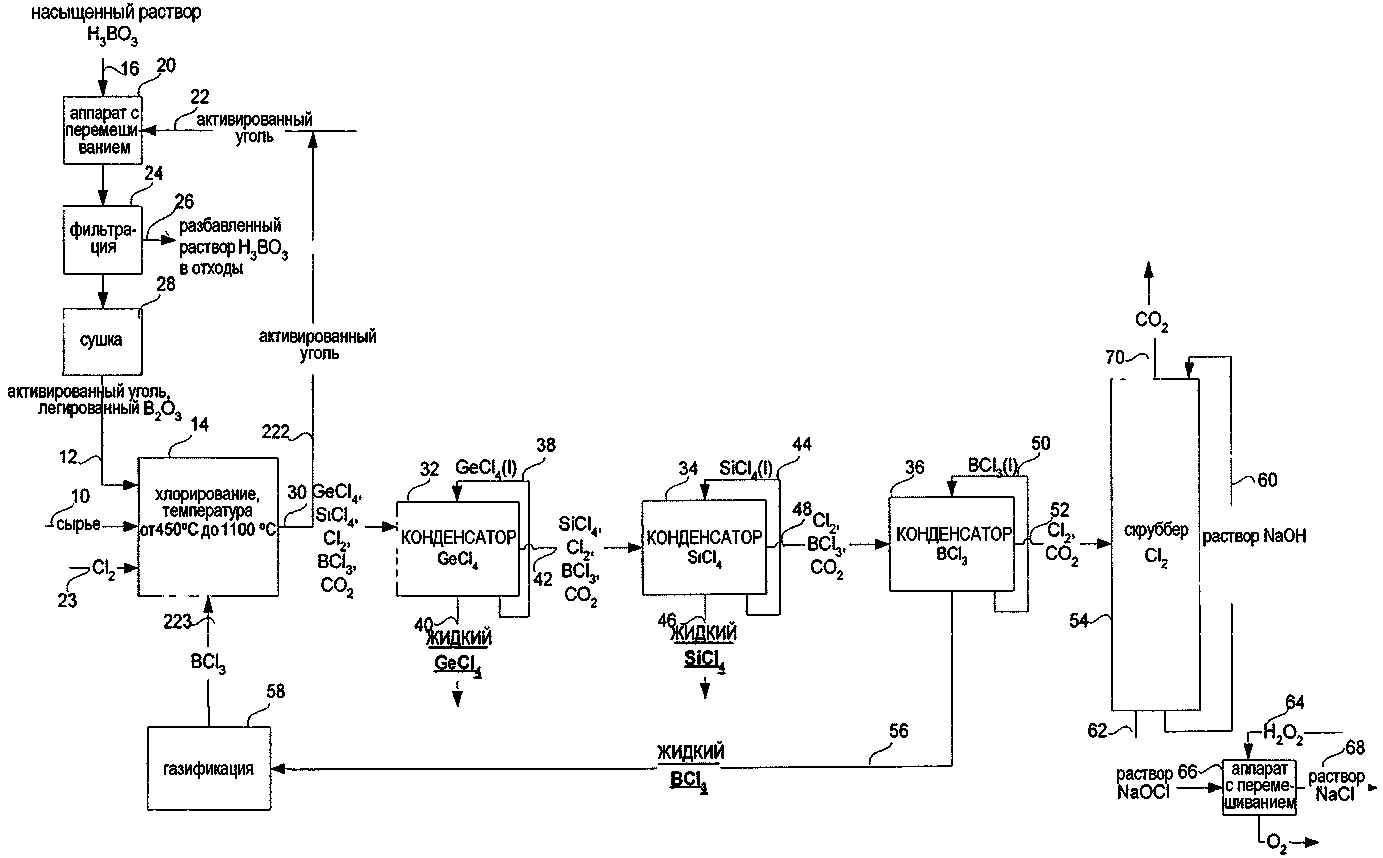
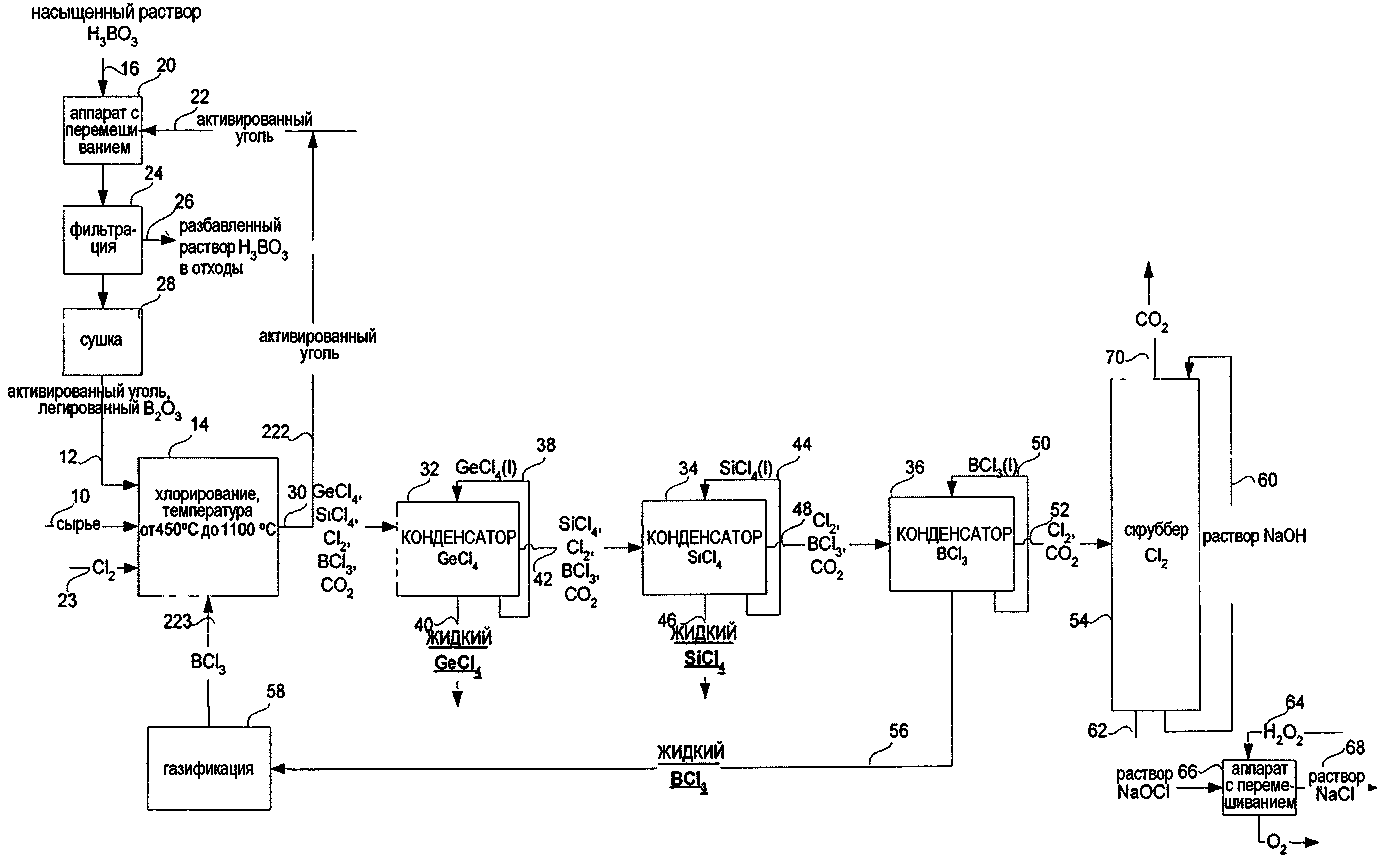
СПОСОБ ИЗВЛЕЧЕНИЯ GeCl4 И/ИЛИ SiCl4 ИЗ ОПТИЧЕСКИХ ВОЛОКОН ИЛИ СТЕКЛЯННЫХ ОТХОДОВ ДЛЯ ПОЛУЧЕНИЯ SiCl4 ИЗ МАТЕРИАЛОВ, СОДЕРЖАЩИХ SiO2
Изобретение относится к способу извлечения германия и кремния из оптических волокон и, в частности, оно относится к способу извлечения хлоридов германия и кремния из оптических волокон, содержащих оксиды германия и кремния. Изобретение относится к способу получения SiCl4 из оксидов кремния, таких как SiO2, и к способу одновременного получения SiCl4 и GeCl4 из стеклянных отходов, таких как оптические волокна. В способах изготовления оптических кабелей, содержащих в себе оптические волокна в качестве активных компонентов для пропускания светового сигнала, обычно различают три основные стадии: а) изготовление заготовки, b) вытягивание оптического волокна и с) свивание волоконно-оптического кабеля (Williams, 2000, The case of high purity silicon and its application in IT and renewable energy (Пример кремния высокой чистоты и его применение в ИТ (информационных технологиях) и возобновляемых источниках энергии), UNU/IAS.145 р.). Оптические волокна имеют сердцевину, обеспечивающую высокий показатель преломления, окруженную оболочкой с более низким показателем преломления (Alwayn, 2004, Optical network design and implementation, Cisco Press, 840 p.). Сердцевину часто изготавливают из плавленого кварца, содержащего оксид германия, использующийся в качестве легирующей примеси для увеличения показателя преломления кварца (диоксида кремния). Оболочку обычно изготавливают из чистого кварца. Получение оптических волокон основано на реакции дехлорирования, в ходе которой хлориды превращаются в оксиды в химическом реакторе, нагретом до температуры около 1000°С. Оксиды осаждаются на твердую подложку, изготовленную из кварца. Существуют три основные системы осаждения (Williams, 2000). Во-первых, модифицированное химическое осаждение из паровой фазы (MCVD) - оксиды при этом осаждаются внутри трубки, изготовленной из высокочистого кварца, а реакции дехлорирования проводятся до тех пор, пока трубка не заполнится. Получающийся в результате стеклянный стержень вплавлен в заготовку, а полученная заготовка уже готова для стадии вытяжки. Во-вторых, система с наружным осаждением (ODS) - в этом случае стеклянный стержень используется в качестве подложки, на которую наносятся частицы оксидов, а реакции дехлорирования проводятся до тех пор, пока не будет получен требуемый диаметр стержня. Затем стержень вплавляют в заготовку. И, наконец, процесс осевого осаждения из паровой фазы (AVD), аналогичный процессу в системе ODS, за исключением того, что наращивание оксидного материала осуществляют из точки, в отличие от всей длины стержня. Получающийся в результате тонкодисперсный порошок вплавляется в заготовку. Реакции дехлорирования, протекающие в ходе процесса MCVD получения оптических волокон, изготовленных из SiO2 и GeO2 (Tandon, 2005, Int. J. Appl. Ceram. Technol., 2, 6, 504-513), имеют следующий вид: Для процессов ODS и AVD реакции дехлорирования имеют вид (Williams, 2000): Исходными химическими компонентами во всех трех случаях являются SiCl4 и GeCl4. Путем тщательного подбора соответствующей реакционной смеси с помощью этих способов получают заготовки, состоящие из сердцевины, обогащенной оксидом с заданным высоким показателем преломления, окруженной оболочкой из чистого кварца. Заготовки помещают на вертикальный вал. Нижний конец необработанной заготовки расплавляют с помощью небольшой печи. Расплавленный материал вытягивают в виде оптического волокна, на которое наносят покрытие и наматывают на катушку (Yin and Jaluria, 1998, Trans. ASME, 120, 916-930). Чтобы получить оптические волокна, изготовленные из чистых оксидов, при производстве оптических волокон используют особо чистые исходные хлориды, оцениваемые как оптической чистоты (99,999999 мас.%, 6 девяток после запятой). Такая чистота необходима для того, чтобы гарантировать отсутствие искажения передаваемых оптических сигналов (Alwayn, 2004). Из-за требуемой высокой степени чистоты хлориды, используемые в реакциях дехлорирования, являются очень дорогостоящими. Это особенно справедливо в отношении тетрахлорида германия, германий является элементом, редко встречающимся в земной коре (Höll, R, Kling, M, Schroll, E: Metallogenesis of germanium - a review (Металлогенезис германия - обзор). Ore Geology Reviews 30(2007), 145-180). Производство оптических волокон сопровождается значительными потерями. В процессе производства повреждается или теряется количество высокочистого стекла, по существу, равное количеству полученного оптического волокна (Ma, Ogura, Kobayashi and Takahashi, Solar Energy Materials and Solar Cells (Материалы для солнечной энергетики и солнечные элементы), 2004, 81, 477-483). Оптические волокна, часто называемые стеклянными компонентами, содержащиеся в кабелях к концу срока службы, в настоящее время рассматриваются как компонент с нулевым значением. При проведении рециклинга оптических кабелей стеклянные компоненты помещают в цементные печи либо используют в качестве сырьевого материала для строительных работ (NTT Group, Environmental protection activity annual report (Годовая сводка активности по охране окружающей среды), 2004). Таким образом, существует потребность в эффективном способе переработки поврежденных оптических волокон, снижении потерь высокочистого стекла, имеющих место при изготовлении оптических волокон, и переработке оптических волокон, присутствующих в оптических кабелях к концу срока службы. Автор японской патентной публикации № 2003-37904 Takahashi сообщает об использовании новой термоплазменной системы, при помощи которой высокочистый SiO2 из отходов оптических волокон превращают в кремний солнечного качества (SOG-Si), используемый для изготовления панелей солнечных батарей. Авторы южнокорейской патентной публикации № 2004-5357 Jin, Kang и Lee сообщают об извлечении неосадившегося во время заполнения заготовки SiO2. Неосадившиеся стеклянные частицы возвращают на коллектор стеклянных частиц. Эти частицы перерабатывают в новую заготовку, используя специальное оборудование для вдувания. В других патентах, упоминаемых ниже, описаны способы разборки оптических кабелей до их основных компонентов, а потому они не имеют отношения к извлечению высокочистых компонентов из оптических волокон. Автор японской патентной публикации № 2004-38788 Nakane сообщает о рециклинге пластмасс и резины из отработанных оптических кабелей с целью извлечения высокочистого полиэтилена и алюминия. Японская патентная публикация № 2004-376291, авторы Ito, Usami и Masura, относится к выделению органической оболочки из отходов оптических волокон, полученных при разделении оптических кабелей. Способ включает в себя экстракцию растворителем и фильтрование с получением чистого кварцевого стекла, повторно используемого в качестве компонента цемента, и покрытых смол, повторно используемых в качестве твердого топлива. Авторы японской патентной публикации № 2005-339701 Ito, Usami и Masura сообщают о рециклинге оптических кабелей путем дробления и просеивания в используемые материалы. Эти три предшествующих документа показывают, что существуют технологии, позволяющие выделять стеклянные компоненты из оптических кабелей. Все эти подходы основаны на низкозатратных технологиях, таких как дробление, просеивание и экстракция растворителями, позволяющих отделять стеклянные компоненты от других компонентов оптического кабеля. Имеются две публикации, относящиеся к рециклингу стеклянных отходов от производства оптических волокон или отработанных оптических кабелей в виде высокочистых продуктов. Эти две публикации основаны на японской патентной публикации № 2003-37904, Takahashi, касающейся рециклинга высокочистых стеклянных материалов с помощью термоплазменной системы. Первая из них, авторы Ma, et al., (2004), представляет собой описанную ранее технологию. Вторая, под авторством Ogura, Astuti, Yoshikawa, Morita и Takahashi (2004, Ind. Eng. Chem. Res., 43, 1890-1893), описывает способ, использующий плазменно-дуговую печь, с помощью которого получают смесь карбида кремния и кремния из сырья -отработанных оптических волокон. При рециклизации продукта, содержащего карбид кремния, в технологической печи выход высокочистого кремния возрастает. Этот способ осуществляют при повышенной температуре и получают кремний в качестве исходного сырья для изготовления панелей солнечных батарей. Кроме того, Bohrer, Amelse, Narasimham, Tariyal, Tumipseed, Gill, Moebuis и Bodeker (1985, Journal of Light Wave Technology, LT-3, 3, 699-705) открыли способ извлечения неиспользованного GeCl4 в реакциях (2) и (4), покидающего систему осаждения и присутствующего в сточных водах данного технологического процесса. GeCl4 улавливают в газовом скруббере в виде растворимых германат-ионов. По истечении определенного времени рециркуляции, необходимого для постепенного увеличения концентрации, германат-ионы реагируют с сульфатом магния с образованием осадка германата магния, который отфильтровывают, сушат, упаковывают в мешки и продают предприятиям-изготовителям. В патентном документе US 4490344 раскрыто использование BCl3 в качестве хлорирующего агента для получения SiCl4 из SiO2 Таким образом, задачей настоящего изобретения является решение упомянутых выше проблем. Согласно общему аспекту предложен способ получения GeCl4 из GeO2-содержащего материала, включающий в себя стадии взаимодействия тонко измельченных остатков материала, содержащего оксид германия, с реагентом, включающим в себя углеродсодержащий восстановитель, хлор и соединение бора, с получением газообразного продукта, содержащего газообразный GeCl4 и газообразный BCl3, в соответствии с реакциями: и конденсации газообразных GeCl4 и BCl3 с образованием жидких GeCl4 и BCl3 путем снижения температуры газообразного продукта ниже температур конденсации GeCl4 и BCl3. В одном из вариантов осуществления изобретения способ дополнительно включает разделение смеси на жидкий GeCl4 и жидкий BCl3 при помощи фракционной перегонки с получением высокочистого жидкого GeCl4 и высокочистого жидкого BCl3. В одном из вариантов осуществления изобретения GeO2-содержащий материал также содержит оксид кремния, при этом указанный способ включает стадии взаимодействия тонко измельченных отходов материала, содержащего оксид германия и оксид кремния, с реагентом, содержащим твердый углеродсодержащий восстановитель, хлор и соединение бора, с получением газообразного продукта, содержащего газообразный GeCl4, газообразный SiCl4 и газообразный BCl3, в соответствии с реакциями: и конденсации газообразных GeCl4, SiCl4 и BCl3 с получением жидких GeCl4, SiCl4 и BCl3 путем снижения температуры газообразного продукта ниже температур конденсации GeCl4, SiCl4 и BCl3. Получающиеся в результате GeCl4 и/или SiCl4 можно использовать для получения исходных компонентов для производства оптических волокон. Согласно другому общему аспекту предложен способ получения SiCl4 из SiO2-содержащего материала, включающий в себя стадии взаимодействия тонко измельченного SiO2-содержащего материала с реагентом, содержащим твердый углеродсодержащий восстановитель, соль, выбранную из группы, состоящей из KCl, CsCl и RbCl, соединение бора и необязательно хлор (Cl2), с получением газообразного продукта, содержащего газообразный SiCl4, в соответствии с реакциями: и конденсации газообразного SiCl4 с образованием жидкого SiCl4 путем снижения температуры газообразного продукта ниже температуры конденсации SiCl4. В одном из вариантов осуществления изобретения SiO2-содержащий материал представляет собой стеклянные отходы. SiO2-содержащий материал также может содержать GeO2, и в ходе реакции также образуется GeCl4 в соответствии с реакцией: при этом способ дополнительно включает в себя конденсацию газообразных SiCl4 и GeCl4 с образованием жидких SiCl4 и GeCl4 путем снижения температуры газообразного продукта ниже температур конденсации SiCl4 и GeCl4. В одном из вариантов осуществления изобретения BCl3 конденсируют одновременно с конденсацией SiCl4 путем снижения температуры газообразного продукта ниже температур конденсации SiCl4 и BCl3. Полученные GeCl4 и SiCl4 можно использовать в качестве исходных компонентов для изготовления оптических волокон. В одном из вариантов осуществления изобретения хлор (Cl2) отсутствует. Согласно другому общему аспекту предложен способ получения SiCl4 из SiO2-содержащего материала, включающий в себя стадии взаимодействия тонко измельченного SiO2-содержащего материала с реагентом, содержащим твердый углеродсодержащий восстановитель, соль, выбранную из группы, состоящей из KCl, RbCl и CsCl, хлор и соединение бора, с получением газообразного продукта, содержащего газообразный SiCl4; и конденсации газообразного SiCl4 с образованием жидкого SiCl4 путем снижения температуры газообразного продукта ниже температуры конденсации SiCl4 и выше температуры конденсации BCl3. Этот способ может дополнительно включать конденсацию хлоридных примесей путем снижения температуры газообразного продукта выше температуры конденсации SiCl4 перед проведением стадии конденсации SiCl4. Твердый углеродсодержащий восстановитель может представлять собой металлургический кокс или активированный уголь. Соединение бора может включать в себя газообразный BCl3. Реакционную стадию можно проводить при температуре в диапазоне от 450 до 1100°С в коррозионно-стойком реакторе. Согласно общему аспекту предложен способ получения GeCl4 из оптических волокон, включающий в себя стадии взаимодействия тонко измельченных оптических волокон, содержащих оксид германия, с реагентом, включающим в себя углеродсодержащий восстановитель, хлор и соединение бора, с получением газообразного продукта, содержащего газообразный GeCl4 и газообразный BCl3, в соответствии с реакциями: и конденсации газообразных GeCl4 и BCl3 с образованием жидких GeCl4 и BCl3. Согласно другому общему аспекту предложен способ получения GeCl4 в качестве исходного компонента для изготовления оптических волокон. Способ включает в себя стадии взаимодействия тонко измельченных стеклянных отходов оптических волокон, содержащих оксиды германия и кремния, с реагентом, содержащим твердый углеродсодержащий восстановитель, хлор и соединение бора, с получением газообразного продукта, содержащего газообразный GeCl4 и газообразный BCl3; и конденсации газообразных GeCl4 и BCl3 с образованием жидких GeCl4 и BCl3. Согласно еще одному общему аспекту предложен способ хлорирования GeO2, входящего в состав стекла. Способ включает в себя стадии взаимодействия тонко измельченных стекол с реагентом, содержащим твердый углеродсодержащий восстановитель, хлор и соединение бора, с получением газообразного продукта, содержащего газообразный GeCl4 и газообразный BCl3; и конденсации газообразных GeCl4 и BCl3 с образованием жидких GeCl4 и BCl3. Стекло может быть стеклом на основе SiO2, а газообразный продукт может содержать газообразный SiCl4. В одном из вариантов стадию конденсации осуществляют путем снижения температуры газообразного продукта ниже температуры конденсации GeCl4, SiCl4 и BCl3 (если присутствует) с образованием жидких GeCl4, SiCl4 и BCl3 (если присутствует). Согласно еще одному общему аспекту предложен способ получения GeCl4 из оптических волокон. Способ включает в себя стадии: взаимодействия оптических волокон, содержащих оксид германия, с реагентом, содержащим восстановитель и BCl3, с получением газообразного продукта, содержащего газообразный GeCl4 и газообразный BCl3; и конденсации газообразных GeCl4 и BCl3 с образованием жидких GeCl4 и BCl3. Согласно другому аспекту предложены способы получения GeCl4 из оптических волокон, стеклянных отходов оптических волокон или любых других отходов, содержащих GeO2, как определено выше, где отходы также содержат SiO2, включающий в себя стадии взаимодействия отходов, содержащих оксиды германия и кремния, с реагентом, содержащим твердый углеродсодержащий восстановитель, хлор и соединение бора, с получением газообразного продукта, содержащего газообразный GeCl4, газообразный SiCl4 и газообразный BCl3 в соответствии с реакциями: и конденсации газообразных GeCl4, SiCl4 и BCl3 с получением жидких GeCl4, SiCl4 и BCl3. Согласно еще одному аспекту изобретения предложены способы, как определено выше, где жидкий GeCl4 и/или жидкий SiCl4, и/или жидкий BCl3 разделяют при помощи фракционной перегонки. Согласно общему аспекту предложен способ получения GeCl4 и SiCl4 из оптических волокон, включающий в себя стадии: взаимодействия тонко измельченных оптических волокон, содержащих оксиды германия и кремния, с реагентом, содержащим твердый углеродсодержащий восстановитель, хлор и соединение бора, с получением газообразного продукта, содержащего газообразный GeCl4, газообразный SiCl4 и газообразный BCl3, в соответствии с реакциями: конденсации газообразного GeCl4 с образованием жидкого GeCl4 путем снижения температуры газообразного продукта ниже температуры конденсации GeCl4 и выше температуры конденсации SiCl4; и последующей конденсации газообразного SiCl4 с образованием жидкого SiCl4 путем снижения температуры газообразного продукта ниже температуры конденсации SiCl4 и выше температуры конденсации BCl3. В одном из вариантов твердый углеродсодержащий восстановитель легируют соединением бора. В одном из вариантов этот способ дополнительно включает в себя адсорбирование в аппарате с перемешиванием соединения бора на твердый углеродсодержащий восстановитель из раствора, содержащего соединение бора, с образованием твердого углеродсодержащего восстановителя, легированного соединением бора; отделение фильтрацией твердого углеродсодержащего восстановителя, легированного адсорбированным соединением бора, от раствора; и сушку твердого углеродсодержащего восстановителя, легированного адсорбированным соединением бора, перед проведением реакционной стадии. Соединение бора может представлять собой H3BO3. Раствор можно насыщать соединением бора. Стадию сушки можно проводить при температуре в диапазоне от 450 до 550°С. Твердый углеродсодержащий восстановитель может являться металлургическим коксом или активированным углем. Соединение бора может включать в себя газообразный BCl3. Реакционную стадию можно проводить при температуре в диапазоне от 450 до 1100°С в коррозионно-стойком реакторе. Способ может дополнительно включать в себя рециклизацию твердого углеродсодержащего восстановителя после реакционной стадии для повторного использования в составе реагента для реакционной стадии. Газообразные продукты могут также содержать Cl2 и СО2, при этом способ также включает в себя отведение газообразного продукта, содержащего газообразные Cl2 и СО2, в по меньшей мере одну систему нейтрализации и систему рециркуляции. Способ может дополнительно включать нейтрализацию газообразного Cl2 в скруббере, где газообразный Cl2 реагирует с NaOH с образованием NaOCl. Способ может дополнительно включать сжатие гзообразного Cl2 в баллонах для повторного использования в составе реагента для реакционной стадии. Способ может дополнительно включать рециркуляцию жидкого BCl3 для повторного использования в составе реагента для реакционной стадии. Указанная стадия рециркуляции может также включать в себя газификацию жидкого BCl3. Этот способ может дополнительно включать очистку по меньшей мере одного жидкого GeCl4 с получением высокочистого жидкого GeCl4 и жидкого SiCl4 с получением высокочистого жидкого SiCl4. Стадию очистки можно выполнять путем по меньшей мере одной фракционной перегонки. Способ может дополнительно включать измельчение оптических волокон до получения тонко измельченных оптических волокон, имеющих размер частиц в пределах от 10 до 250 мкм. Оптические волокна могут происходить из отходов от производства оптических волокон или отработанных оптических волокон. Согласно другому общему аспекту предложен способ получения GeCl4 и SiCl4 в качестве исходных компонентов для изготовления оптических волокон. Способ включает в себя стадии взаимодействия тонко измельченных стеклянных отходов оптических волокон, содержащих оксиды германия и кремния, с реагентом, содержащим твердый углеродсодержащий восстановитель, хлор и соединение бора, с получением газообразного продукта, содержащего газообразный GeCl4, газообразный SiCl4 и газообразный BCl3; во-первых, конденсации газообразного GeCl4 с получением жидкого GeCl4 путем снижения температуры газообразного продукта ниже температуры конденсации GeCl4 и выше температуры конденсации SiCl4; и, во-вторых, конденсации газообразного SiCl4 с получением жидкого SiCl4 путем снижения температуры газообразного продукта ниже температуры конденсации SiCl4 и выше температуры конденсации BCl3. Согласно еще одному общему аспекту предложен способ хлорирования GeO2, входящего в состав стекол на основе SiO2. Способ включает в себя стадии взаимодействия тонко измельченных стекол на основе SiO2 с реагентом, содержащим твердый углеродсодержащий восстановитель, хлор и соединение бора, с получением газообразного продукта, содержащего газообразный GeCl4, газообразный SiCl4 и газообразный BCl3; и конденсации газообразного GeCl4 с образованием жидкого GeCl4 путем снижения температуры газообразного продукта ниже температуры конденсации GeCl4 и выше температуры конденсации SiCl4. Данный способ может включать последующую конденсацию газообразного SiCl4 с образованием жидкого SiCl4 путем снижения температуры газообразного продукта ниже температуры конденсации SiCl4 и выше температуры конденсации BCl3. В одном из вариантов твердый углеродсодержащий восстановитель легируют соединением бора. Твердый углеродсодержащий восстановитель может представлять собой металлургический кокс или активированный уголь. Соединение бора может включать газообразный BCl3. В одном из вариантов реакционную стадию проводят при температуре в диапазоне от 450 до 1100°С в коррозионно-стойком реакторе. Согласно другому общему аспекту предложен способ получения GeCl4 и SiCl4 из оптических волокон. Способ включает в себя стадии взаимодействия оптических волокон, содержащих оксиды германия и кремния, с реагентом, содержащим восстановитель и BCl3, с получением газообразного продукта, содержащего газообразный GeCl4, газообразный SiCl4 и газообразный BCl3; и конденсации газообразного GeCl4 с образованием жидкого GeCl4 путем снижения температуры газообразного продукта ниже температуры конденсации GeCl4 и выше температуры конденсации SiCl4. Согласно еще одному общему аспекту предложен способ получения SiCl4 из стеклянных отходов оптических волокон, включающий в себя стадии взаимодействия тонко измельченных стеклянных отходов оптических волокон с реагентом, содержащим твердый углеродсодержащий восстановитель, соль, выбранную из группы, состоящей из KCl, CsCl и RbCl, и соединение бора, с получением газообразного продукта, содержащего газообразный SiCl4, в соответствии с реакцией: и конденсации газообразного SiCl4 и BCl3 с образованием жидкого SiCl4 и BCl3. Необязательно в качестве реагента может быть добавлен газообразный хлор. Кроме того, согласно еще одному общему аспекту предложен способ получения SiCl4 и, необязательно, GeCl4 из стеклянных отходов оптических волокон, включающий в себя стадии взаимодействия тонко измельченных стеклянных отходов оптических волокон с реагентом, содержащим твердый углеродсодержащий восстановитель, соль, выбранную из группы, состоящей из: KCl, CsCl и RbCl, соединение бора, и, необязательно хлор, с получением газообразного продукта, содержащего газообразный SiCl4 и необязательно GeCl4, в соответствии с реакциями: и конденсации газообразного SiCl4, GeCl4, если присутствует, и BCl3 с образованием жидких SiCl4, GeCl4 и BCl3. Согласно еще одному общему аспекту, предложен способ получения SiCl4 и GeCl4 из стеклянных отходов оптических волокон, включающий в себя стадии взаимодействия тонко измельченных стеклянных отходов оптических волокон с реагентом, содержащим твердый углеродсодержащий восстановитель, соль, выбранную из группы, состоящей из KCl, CsCl и RbCl, хлор и соединение бора, с получением газообразного продукта, содержащего газообразный GeCl4 и газообразный SiCl4, в соответствии с реакциями: конденсации газообразного GeCl4 с образованием жидкого GeCl4 путем снижения температуры газообразного продукта ниже температуры конденсации GeCl4 и выше температуры конденсации SiCl4; и последующей конденсации газообразного SiCl4 с образованием жидкого SiCl4 путем снижения температуры газообразного продукта ниже температуры конденсации SiCl4 и выше температуры конденсации BCl3. В одном из вариантов соотношение между массой восстановителя и массой стеклянных отходов лежит в пределах от 0,3 до 1. В одном из вариантов соотношение массы соли и суммарной массы стеклянных отходов, массы твердого углеродсодержащего восстановителя и массы соли лежит в пределах от 0,03 до 0,15. Способ может дополнительно включать тонко измельченных стеклянных отходов при температуре в диапазоне от 400 до 600°С перед проведением реакционной стадии. В одном из вариантов твердый углеродсодержащий восстановитель является металлургическим коксом, графитом или активированным углем. Соединение бора может включать газообразный BCl3. В одном из вариантов реакционную стадию проводят при температуре в диапазоне от 450 до 1100°С в коррозионно-стойком реакторе. Способ может дополнительно включать рециклизацию твердого углеродсодержащего восстановителя после реакционной стадии для повторного использования в составе реагента для реакционной стадии. Газообразные продукты могут содержать Cl2 и СО2, при этом способ также включает в себя перенос газообразного продукта, содержащего газообразные Cl2 и СО2, по меньшей мере в одну систему нейтрализации и систему рециркуляции. Способ может дополнительно включать нейтрализацию газообразного Cl2 в скруббере, где газообразный Cl2 реагирует с NaOH с образованием NaOCl. Способ может дополнительно включать сжатие газообразного Cl2 в баллонах для повторного использования в составе реагента для реакционной стадии. Способ может дополнительно включать рециркуляцию жидкого BCl3 для повторного использования в составе реагента для реакционной стадии. Стадия рециркуляции может дополнительно включать в себя газификацию жидкого BCl3. Способ может дополнительно включать очистку по меньшей мере одного жидкого GeCl4 с получением высокочистого жидкого GeCl4 и очистку жидкого SiCl4 с получением высокочистого жидкого SiCl4. Стадию очистки можно осуществлять с помощью по меньшей мере одной фракционной перегонки. Способ может дополнительно включать измельчение стеклянных отходов с получением тонко измельченных стеклянных отходов, имеющих размер частиц в пределах от 10 до 250 мкм. Стеклянные отходы оптических волокон могут происходить из отходов от производства оптических волокон или из отработанных оптических волокон. Согласно другому общему аспекту предложен способ получения GeCl4 и SiCl4 в качестве исходных компонентов для изготовления оптических волокон. Способ включает в себя стадии взаимодействия тонко измельченных стеклянных отходов оптических волокон с реагентом, содержащим твердый углеродсодержащий восстановитель, соль, выбранную из группы, состоящей из KCl, CsCl и RbCl, хлор и соединение бора, с получением газообразного продукта, содержащего газообразный GeCl4 и газообразный SiCl4; во-первых, конденсации газообразного GeCl4 с образованием жидкого GeCl4 путем снижения температуры газообразного продукта ниже температуры конденсации GeCl4 и выше температуры конденсации SiCl4; и, во-вторых, конденсации газообразного SiCl4 с образованием жидкого SiCl4 путем снижения температуры газообразного продукта ниже температуры конденсации SiCl4 и выше температуры конденсации BCl3. Согласно еще одному общему аспекту предложен способ получения SiCl4 из материала, содержащего SiO2. Способ включает в себя стадии взаимодействия тонкоизмельченного материала, содержащего SiO2, с реагентом, содержащим твердый углеродсодержащий восстановитель, соль, выбранную из группы, состоящей из KCl, CsCl и RbCl, хлор и соединение бора, с получением газообразного продукта, содержащего газообразный SiCl4; и конденсации газообразного SiCl4 с образованием жидкого SiCl4 путем снижения температуры газообразного продукта ниже температуры конденсации SiCl4 и выше температуры конденсации BCl3. Согласно другому общему аспекту предложен способ получения SiCl4 из стеклянных отходов. Способ включает в себя стадии: взаимодействия стеклянных отходов с твердым углеродсодержащим восстановителем, солью, выбранной из группы, состоящей из KCl, CsCl и RbCl, соединением хлора и бором, с получением газообразного продукта, содержащего газообразный SiCl4; и конденсации газообразного SiCl4 с образованием жидкого SiCl4 путем снижения температуры газообразного продукта ниже температуры конденсации SiCl4. Фиг. 1 представляет собой блок-схему способа в соответствии с вариантом осуществления при использовании реагента, содержащего активированный уголь, легированный В2О3; фиг. 2 представляет собой блок-схему способа в соответствии с другим вариантом осуществления при использовании реагента, содержащего газообразный BCl3; фиг. 3 представляет собой блок-схему способа хлорирования SiO2 и GeO2 в соответствии с вариантом осуществления при использовании реагента, содержащего активированный уголь, легированный В2О3; фиг. 4 представляет собой блок-схему способа хлорирования SiO2 и GeO2 в соответствии с другим вариантом осуществления при использовании реагента, содержащего активированный уголь; фиг. 5 представляет собой блок-схему способа хлорирования SiO2 в соответствии с еще одним вариантом осуществления при использовании исходного сырья, обогащенного SiO2; фиг. 6 представляет собой блок-схему способа хлорирования SiO2 в соответствии с еще одним вариантом осуществления при использовании исходного сырья, обогащенного SiO2; фиг. 7 представляет собой схематическое изображение в перспективе экспериментальной установки в соответствии с одним из вариантов осуществления; и фиг. 8 представляет собой схематическое изображение в перспективе экспериментальной установки, изображенной на фиг. 7, на котором показано расположение стакана с образцом. Следует отметить, что на всех прилагаемых рисунках одинаковые части имеют одинаковые номера позиций. На рисунках и, в частности на фиг. 1 и 2, проиллюстрированы способы одновременного получения тетрахлорида германия и тетрахлорида кремния из оптических волокон. Согласно этим способам оксиды германия и кремния (GeO2 и SiO2), содержащиеся в оптических волокнах, превращают в хлориды германия и кремния (GeCl4 и SiCl4). Полученные хлориды идентичны хлоридам обычно применяемым при изготовлении оптических волокон. Например, оптические волокна, используемые в качестве сырьевого материала 10, могут быть стеклянными отходами от производства оптических волокон, то есть стеклянными отходами с оборудования для производства оптических волокон или частицами оксидов, уносимыми в скрубберный блок оборудования для производства оптических волокон, либо стеклянными отходами от отработанных оптических волокон, то есть оптических волокон, остающихся при разборке использованных оптических кабелей. Стеклянные отходы, используемые в качестве сырьевого материала 10, сначала сушат и тонко измельчают перед введением в реактор 14 хлорирования. Стеклянные отходы могут быть раздроблены либо измельчены до частиц, имеющих средний размер в диапазоне от микрометров до миллиметров. Например, средний размер частиц может варьироваться от 10 до 250 мкм. Согласно одному варианту осуществления, частицы имеют, по существу, одинаковый размер. Такие стеклянные отходы могут иметь покрытие из смолы. Это покрытие из смолы не мешает процессу получения GeCl4 и SiCl4. Напротив, покрытие из смолы может оказывать на процесс положительное влияние, поскольку органическое покрытие может использоваться в качестве восстановителя во время процесса карбохлорирования. Как упоминалось выше, при изготовлении оптических волокон проводят реакции дехлорирования с (1) по (4). Для извлечения кремния и германия, содержащихся в стеклянных отходах в виде оксидов, эти реакции реверсируют. Согласно другому аспекту изобретения в качестве эффективного хлорирующего агента для GeO2 и SiO2 используют треххлористый бор. В частности, имеют место следующие реакции: Действие BCl3 на SiO2 с образованием SiCl4 и В2О3 исследовано при температуре около 350°С (Kroll, Metal Industry, 1952, 81, (13), 243-6; Savel'ev et al., Neorganicheskie Materialy, 1973, 9, (2), 325-6). Кроме того, В2О3 может хлорироваться (или регенерироваться) до BCl3 под действием Cl2 и восстановителя, такого как кокс или активированный уголь (Alam et al., 2004, Kirk-Othmer Encyclopedia of chemical technology (Химико-технологическая энциклопедия), 138-168). Для извлечения кремния и германия, содержащихся в стеклянных отходах в виде оксидов, в качестве эффективного хлорирующего агента, работающего при относительно низкой температуре процесса, в настоящее время используют BCl3. В частности, BCl3 является хлорирующим агентом для GeO2, содержащегося в SiO2 стекле. Вследствие этого указанные выше реакции могут быть использованы для одновременного получения GeCl4 и SiCl4 из стеклянных отходов оптических волокон, содержащих оксиды кремния и германия. Как будет более подробно описано ниже, BCl3 может добавляться в газообразном виде, либо он может генерироваться in situ посредством реакции (7). Для проведения реакций хлорирования в дополнение к сырьевому материалу 10 из стеклянных отходов подают смесь реагентов, содержащую восстановитель 22, 122, хлор (Cl2) 23, 123 и бор 16, 116 (фиг. 1 и 2). Восстановителем может быть твердый углеродсодержащий восстановитель, например, такой как металлургический кокс или активированный уголь. На фиг. 1 показано, что согласно одному из вариантов осуществления восстанавливающий агент и бор, входящие в состав реакционной смеси, подают в виде восстановителя 12, легированного соединением бора. В частности, соединение бора перед стадией 14 хлорирования адсорбируют на твердый восстановитель. Согласно изображенному варианту осуществления твердым восстановителем 22 является активированный уголь. Как подробнее будет описано ниже, в случаях, когда реакционная смесь содержала восстановитель с адсорбированным борсодержащим соединением, были получены высокие степени превращения GeO2 и SiO2. Восстановитель 12 с адсорбированным борсодержащим соединением получают из раствора, насыщенного соединением бора 16, например, таким как Н3ВО3. В аппарате 20 с перемешиванием насыщенный раствор перемешивают с твердым восстановителем 22, например, таким как активированный уголь. Твердый углеродсодержащий восстановитель, содержащий адсорбированное соединение бора, выделяют фильтрацией 24, например, из раствора 26, после чего он может быть высушен 28 при температуре 500°С в течение трех часов. Согласно альтернативному варианту осуществления, твердый углеродсодержащий восстановитель, содержащий адсорбированное соединение бора, может быть высушен при температуре в диапазоне от 450 до 550°С в течение от 30 мин до 3 ч. Стадия сушки 28 может проводиться в инертной атмосфере, например, такой как атмосфера азота. На стадии сушки 28 удаляют любую офрму воды, которая может повредить процессу хлорирования. Стадии адсорбции, фильтрации и сушки 20, 24, 28 обычно проводят за пределами реактора хлорирования. На фиг. 2 показано, что согласно альтернативному варианту осуществления восстановитель 122, например, такой как активированный уголь, и бор 116, подают по отдельности. Бор подается не адсорбированным на восстановителе 122, а отдельно в виде газообразного BCl3 116. Обратимся теперь одновременно к фиг. 1 и 2, на которых показано, что реакцию хлорирования проводят в реакторе 14 хлорирования при температуре в диапазоне от 450 до 1100°С. Согласно варианту осуществления, реактор 14 изготовлен из материала, устойчивого к коррозионной природе газов, содержащихся в нем. В реакторе 14 хлорирования получают газообразный продукт 30. Газообразный продукт 30 включает в себя, наряду с прочим, газообразные GeCl4 и SiCl4. В реакторе хлорирования поддерживается непрерывный ток хлора (Cb), при этом GeCl4 и SiO4 покидают реактор 14 хлорирования в виде паровой фазы и уносятся потоком газообразных продуктов в зоны конденсации 32, 34, 36. Газообразный продукт 30, покидающий реактор 14, состоит, по существу, из GeCl4, SiCl4, Cl2, BCl3 и СО2. На выходе из реактора 14 хлорирования, газообразный продукт 30 и твердый восстановитель 222 разделяют при помощи фильтровальной системы (не показана). Твердый восстановитель 222 собирают в приемный бункер и повторно используют в процессе хлорирования в качестве восстановителя. Газообразный продукт 30 накапливают в системе трубопроводов, соединяющей реактор 14 хлорирования с первым конденсационным блоком 32. Систему трубопроводов термостатируют, то есть регулируют температуру газа внутри системы трубопроводов. Таким образом, температура может поддерживаться выше точки кипения GeCl4 (84°C), одного из компонентов газообразного продукта. Точки кипения других компонентов газообразного продукта, покидающего реактор 14 хлорирования, ниже точки кипения GeCl4. Вследствие этого все компоненты газообразного продукта в системе трубопроводов, расположенной между реактором 14 хлорирования и первым конденсационным блоком 32, остаются в газообразном виде. В первом конденсационном блоке 32 избирательно конденсируется GeCl4(г) из других компонентов газообразного продукта и, в частности, SiCl4(г), BCl3(г), Cl2(г), СО2(г). Для осуществления такой избирательной конденсации GeCl4 температуру внутри блока 32 устанавливают чуть ниже точки кипения GeCl4 и чуть выше точки кипения SiCl4 (57,6°C). Газообразный продукт 30 охлаждают и промывают жидким GeCl4 38. Блок 32 заполнен перфорированными сферами, изготовленными из устойчивого материала. Петля рециркуляции жидкого GeCl4, соединенная с распылительной насадкой, находящейся в верхней части блока, обеспечивает достаточную перколяцию и контактирование между жидкой фазой 38 и газообразным продуктом 30. Сконденсировавшийся жидкий GeCl4 40 накапливают в резервуаре, расположенном у основания конденсационного блока 32. Газообразный продукт 42, покидающий конденсатор 32, по существу, состоит из SiCl4(г), BCl3(г), Cl2(г) и СО2(г). Его направляют через вторую систему трубопроводов во второй конденсационный блок 34, где конденсируется газообразный SiCl4, как подробнее будет описано ниже. Как и в случае с первой системой трубопроводов, идущей от реактора 14 хлорирования к первому конденсационному блоку 32, вторую систему трубопроводов термостатируют. Так, температура может поддерживаться выше точки кипения SiCl4 (57,6°C) и ниже точки киипения GeCl4 (84°C). Таким образом, все компоненты газообразного продукта во второй системе трубопроводов, расположенной между первым и вторым конденсационными блоками 32, 34, остаются в газообразном виде. Второй конденсационный блок 34 аналогичен первому конденсационному блоку 32, за исключением того, что температуру внутри блока 34 устанавливают несколько ниже температуры конденсации SiCl4, a газообразный продукт 42, покидающий конденсатор 34, промывают SiCl4 44 в жидкой фазе. Такие технологические условия позволяют осуществлять избирательную конденсацию SiCl4 46, который собирают в резервуар, размещенный у основания блока 34. Вследствие этого, газообразный продукт 48, покидающий второй блок 34, по существу, включает в себя BCl3(г), Cl2(г), СО2(г). Его направляют в третий конденсационный блок 36, где осуществляют конденсацию BCl3, через посредство третьей системы трубопроводов. Как и в случае описанных выше систем трубопроводов, третью систему трубопроводов термостатируют, а температуру в ней поддерживают выше температуры кипения BCl3 (12,5°С) и ниже температуры кипения SiCl4 (57,6°C). Вследствие этого в третьей системе трубопроводов, расположенной между вторым и третьим конденсационный блоками 34, 36, компоненты газообразного продукта BCl3(г), Cl2(г), СО2(г) остаются в газообразной виде. В третьем конденсационном блоке 36, конденсируют газообразный BCl3. Температуру внутри блока 36 устанавливают немного ниже температуры конденсации BCl3, а газ, покидающий блок 36, промывают жидким BCl3 50, обеспечивая его избирательную конденсацию. Газообразный продукт 52, покидающий блок 36, содержит Cl2(г) и СО2(г), и его направляют в системы 54 очистки и нейтрализации газов. Жидкий BCl3 56, полученный на данной стадии конденсации, может быть рециклизован в виде реагента 223 в реактор 14 хлорирования после стадии газификации 58. Количество рециклизованного BCl3 223, используемого для хлорирования оптиковолокнистого сырья 10, при необходимости выравнивают за счет дополнительного ввода BCl3 116 или твердого борсодержащего соединения 16. Хлор (Cl2) из газообразного продукта 52 удаляют в скруббере 54. Это устройство для промывки газа состоит из вертикального цилиндра, содержащего перфорированные пластмассовые сферы. Скруббер 54 заполняют до определенного уровня раствором NaOH 60. Система, включающая в себя насос, связанный с петлей рециркуляции, и распылительную насадку, расположенную в верхней части скруббера 54, обеспечивает промывку газообразного продукта 52 и контактирование его с раствором NaOH 60. Между хлором, содержащимся в газообразном продукте 52, и раствором NaOH 60 протекает следующая реакция: Величину рН регулируют при помощи подачи концентрированного раствора NaOH. Раствор NaOCl 62, образующийся в результате промывки, далее обрабатывают Н2О2 64 в аппарате 66 с перемешиванием с получением раствора хлорида натрия 68 по реакции Газ, выходящий из верхней части скруббера, по существу, состоит из СО2 70. При необходимости СО2 70, покидающий процесс, может улавливаться либо нейтрализоваться с использованием существующей дополнительной технологии, предназначенной для улавливания СО2. Согласно альтернативному варианту осуществления скруббер 54 для промывки хлора может быть заменен компрессором хлора, позволяющим осуществлять сжатие газообразного хлора с образованием сжиженного хлора и тем самым отделять его от газообразного СО2. Сжатый хлор может храниться в газовых баллонах для последующего использования, такого как в качестве одного из реагентов процесса хлорирования. Способ, описанный выше, позволяет превращать стеклянные отходы оптических волокон в хлоридные формы, которые могут быть напрямую использованы в качестве сырьевого материала для изготовления оптических волокон. Жидкие хлориды, избирательно отделенные во время процесса и собранные с использованием конденсационных блоков для конденсации GeCl4 и SiCl4, имеют относительно высокую чистоту. При необходимости могут быть проведены дополнительные стадии очистки выделенных хлоридов, полученных с помощью описанного способа. Эти дополнительные стадии очистки могут включать в себя один или несколько методов, таких как перегонка, фракционная перегонка, экстракция растворителем и очистка с помощью смол. Обратимся, в частности, к фиг. 3 - 5, на которых проиллюстрирован способ получения хлоридов из сырьевого материала, содержащего оксиды. В частности, на фиг. 3 и 4 проиллюстрирован способ одновременного получения тетрахлорида германия и тетрахлорида кремния из стеклянных отходов оптических волокон. Согласно этому способу оксиды германия и кремния (GeO2 и SiO2), присутствующие в оптических волокнах или других стеклянных отходах, превращают в тетрахлориды германия и кремния (GeCl4 и SiCl4). Полученные тетрахлориды идентичны тетрахлоридам, обычно применяемым при изготовлении оптических волокон. На фиг. 5 проиллюстрирован способ получения тетрахлорида кремния из материала, обогащенного SiO2. Оксид кремния (SiO2), присутствующий в материале, обогащенном SiO2, превращают в тетрахлорид кремния (SiCl4). Например, оптические волокна, используемые в качестве сырьевого материала 10, могут быть стеклянными отходами от производства оптических волокон, то есть стеклянными отходами с оборудования для производства оптических волокон или частицами оксидов, уносимыми в скрубберный блок оборудования для производства оптических волокон, стеклянными отходами от отработанных оптических волокон, то есть оптических волокон, остающих при разборке использованных оптических кабелей, или стеклянными отходами, выделенными из отработанных оптических кабелей. Такие стеклянные отходы, используемые в качестве сырьевого материала, могут иметь покрытие из смолы. Это покрытие из смолы не оказывает отрицательного воздействия на способ получения GeCl4 и SiCl4. С другой стороны, покрытие из смолы может положительно влиять на способ, поскольку органическое покрытие может играть роль восстановителя во время процесса карбохлорирования. Согласно альтернативному варианту осуществления, сырьевой материал 110 (см. фиг. 5) может включать в себя материал, обогащенный SiO2, по существу не содержащий GeO2, такой как кварц, который может быть превращен в SiCl4 в реакторе 14 хлорирования. Согласно этому варианту осуществления материал, обогащенный SiO2, содержит более 90 мас.% SiO2. Для обогащенного SiO2 сырья, по существу, не содержащего GeO2, стадия фракционной перегонки упрощается, поскольку в смеси отсутствует GeCl4. При необходимости на выходе из реактора может быть добавлен первый конденсационный блок для удаления нежелательных примесей высококипящих хлоридов. Сырьевой материал 10, 110, или стеклянные отходы либо материал, обогащенный SiO2, сначала сушат и тонко измельчают перед подачей в реактор 14 хлорирования. Сырьевой материал 110 может быть раздроблен, размолот или раскрошен до частиц, имеющих средний размер в диапазоне от микрометров до миллиметров. Например, средний размер частиц может составлять от 10 до 250 мкм. Согласно варианту осуществления частицы имеют, по существу, одинаковый размер. Согласно альтернативному варианту осуществления размолотый сырьевой материал 10, 110 подают в реактор 14 без предварительной сушки. Стадия сушки может осуществляться внутри реактора 14, или же способ может не содержать стадии сушки. Например, сырьевой материал 10, 110 может быть высушен при температуре в пределах от 400 до 600°С в течение от 0,5 до 3 ч. Кроме того, реакционная смесь или только ее часть может быть введена в реактор 14 во время проведения стадии сушки, как подробнее будет описано ниже. Стадия сушки может проводиться в инертной атмосфере, например, под азотом. На стадии сушки удаляются все формы воды, которые могут быть неблагоприятны для процесса хлорирования. Как упоминалось выше, при производстве оптических волокон проводят реакции дехлорирования с (1) по (4). Для извлечения кремния и германия, содержащихся в стеклянных отходах в виде оксидов, эти реакции реверсируют в направлении хлорирования. Для проведения реакций хлорирования реакционную смесь, содержащую восстановитель 12, 22, соль 27, такую как KCl, RbCl и CsCl, хлор (Cl2) 23 и соединение бора, В2О3 (фиг. 3) или треххлористый бор (BCl3) 29 (фиг. 4 и 5), подают вместе с сырьевым материалом 10, 110 или стеклянными отходами либо материалом, обогащенным SiO2. На фиг. с 3 по 5 солью, входящей в состав реакционной смеси, является KCl. Масса соли составляет от 3 до 15 мас.% от общей массы всего твердого сырья, то есть от массы сырьевого материала, массы восстановителя и массы соли. В частности, используют KCl. Более конкретно, при использовании KCl газообразный хлор (Cl2) может быть успешно исключен. Восстановителем 12, 22 может быть твердый углеродсодержащий восстановитель, например, такой как металлургический кокс или активированный уголь. Соотношение между массой восстановителя и массой сырьевого материала лежит в пределах от 0,3 до 1. Согласно одному из вариантов осуществления изобретения часть реакционной смеси добавляют в тонко измельченный сырьевой материал 10, 110 перед проведением стадии сушки. В качестве неограничивающего примера восстановитель 12, 22 и соль 27, то есть твердые компоненты реакционной смеси, могут быть добавлены в тонко измельченный сырьевой материал 10, 110 перед проведением стадии сушки. Как упоминалось выше, стадия сушки может проводиться, например, при температуре в диапазоне от 400 до 600°С в течение от 0,5 до 3 ч. Как только стадия сушки заканчивается, к высушенным твердым компонентам добавляют другие компоненты (Cl2 и BCl3) реакционной смеси. На фиг. 3 показано, что согласно варианту осуществления восстановитель 12 подают в виде восстановителя, легированного соединением бора, а сырьевой материал 10 включает в себя стеклянные отходы. В частности, соединение бора адсорбируют на твердый восстановитель перед стадией хлорирования. Согласно изображенному варианту осуществления твердым восстановителем 22 является активированный уголь. Восстановитель с адсорбированным борсодержащим соединением 12 получают из раствора, насыщенного соединением бора 16, например, таким как Н3ВО3. В аппарате 20 с перемешиванием насыщенный раствор смешивают с твердым восстановителем 22, например, таким как активированный уголь. Твердый углеродсодержащий восстановитель, содержащий адсорбированное соединение бора, отделяют, например, фильтрацией 24 от раствора 26, после чего он может быть высушен 28 при температуре 500°С в течение трех часов. Согласно альтернативному варианту осуществления твердый углеродсодержащий восстановитель, содержащий адсорбированное соединение бора, может быть высушен при температуре в диапазоне от 450 до 550°С в течение от 30 мин до трех часов. Стадия сушки 28 может проводиться в инертной атмосфере, например, такой как атмосфера азота. На стадии сушки 28 удаляются все формы воды, которые могут неблагоприятно сказаться на процессе хлорирования. Стадии адсорбции, фильтрации и сушки 20, 24, 28 обычно проводят за пределами реактора 14 хлорирования. Согласно этому варианту осуществления реагент не обязательно включает в себя подачу 29 свежего BCl3 (см. фиг. 4 и 5). При этом, как подробнее будет описано ниже, в реагент может быть добавлен рециклизованный BCl3. Обратимся теперь к фиг. 4, где показано, что согласно альтернативному варианту осуществления восстановитель 22, например, такой как активированный уголь, подают отдельно от бора. В этом случае в реагент добавляют порцию 29 свежего BCl3. Как и в случае варианта осуществления, описанного выше применительно к фиг. 3, сырьевой материал включает в себя стеклянные отходы. Обратимся теперь к фиг. 5, где показано, что согласно другому альтернативному варианту осуществления сырьевой материал 110 включает в себя материал, обогащенный SiO2, а восстановитель 22, например, такой как активированный уголь, подают отдельно от бора. Согласно варианту осуществления, изображенному на фиг. 5 и описанному ниже, реагент включает в себя порцию 29 свежего BCl3. Следует отметить, что согласно альтернативному варианту осуществления с сырьевым материалом, обогащенным SiO2, также может быть использован восстановитель, легированный соединением бора. Обратимся теперь одновременно к фиг. 3-5, на которых показано, что реакцию хлорирования проводят в реакторе 14 хлорирования при температуре в пределах от 450 до 1100°С, причем согласно альтернативному варианту осуществления температура варьируется в диапазоне от 750 до 950°С. Согласно варианту осуществления реактор 14 изготовлен из материала, устойчивого к коррозионной природе газов, содержащихся в нем. В реакторе 14 хлорирования получают газообразный продукт 30. Газообразный продукт 30 содержит, наряду с прочим, газообразные GeCl4 и SiCl4, если сырьевой материал 10 включает в себя стеклянные отходы (фиг. 3 и 4), либо газообразный SiCl4, если сырьевой материал 110 включает в себя материал, обогащенный SiO2 (фиг. 5). В реакторе хлорирования поддерживают непрерывный ток хлора (Cl2) 23, и газообразный продукт 30, содержащий газообразный SiCl4 и GeCl4, если таковой имеется, покидает реактор хлорирования 14 в виде паровой фазы и переносится в зоны конденсации 32, 34, 36, 132, как подробнее будет описано ниже. Газообразный продукт 30, покидающий реактор 14 хлорирования, по существу, состоит из GeCl4, SiCl4, Cl2, BCl3 и СО2, если сырьевой материал включает в себя стеклянные отходы (фиг. 3 и 4), или SiCl4, Cl2, BCl3, СО2 и, возможно, другие хлоридные примеси, если сырьевой материал включает в себя материал, обогащенный SiO2 (фиг. 5). Muetterties (Journal of the American Chemical Society, 1957, vol., 79, 6563-6564) продемонстрировал, что тетрахлорборатые соли типа KBCl4, RbBCl4 и CsBCl4 могут быть получены взаимодействием при высокой температуре соответствующей соли, такой как KCl, с газообразным BCl3. В реакциях хлорирования согласно описанному способу BCl4- используют в качестве эффективного хлорирующего агента для стекол SiO2 и стекол GeO2, содержащихся в оптических волокнах, и для SiO2, содержащегося в материале, обогащенном SiO2. В частности, при одновременном получении GeCl4 и SiCl4 из стеклянных отходов протекают следующие реакции: Если сырьевой материал, по существу, не содержит GeO2, протекают те же самые реакции, за исключением реакции (11). Реакции проводят при температуре в диапазоне от 450 до 1100°С, согласно альтернативному варианту осуществления при температуре в диапазоне от 800 до 900°С, согласно еще одному альтернативному варианту осуществления при температуре в диапазоне от 825 до 875°С. При температуре, близкой к 850°С, KBCl4 находится в жидкой фазе, поскольку эта температура выше точки плавления KCl (776°С). Частицы оксида и углерода, вероятно, частично окружены жидкой средой, содержащей ионы K+ и BCl4-. Ион BCl4- является хлорирующим агентом, Cl- перемещается к оксидной поверхности через в результате реакций (11) и (12), приводящих к образованию газообразной фазы, содержащей BCl3, SiCl4, GeCl4, если таковой имеется, и СО2, которая высвобождается из жидкой среды KBCl4. Далее газообразный BCl3 попадает в газообразную атмосферу реактора, в которой поддерживается ток BCl3 и Cl2∙BCl3 является сильной кислотой Льюиса (Alam et al., 2004, Kirk-Othmer Encyclopedia of chemical technology, 138-168) и, вследствие этого часть BCl3 реагирует с Cl2 с образованием: Ион BCl4 может затем вернуться в жидкую среду с помощью иона K+ по реакции (10): Ион Cl+, образующийся по реакции (13), возможно реагирует с открытой поверхностью углеродсодержащего восстановителя (металлургического кокса, графита или активированного угля) в активных положениях, где имеется высокая плотность неспаренных электронов (Bandosz и Ania, in: Activated carbon surfaces in environmental remediation (Поверхности активированного угля в природовосстановлении), Elsevier 2006, p. 159-229), как показано уравнением: В реакторе 14, в котором проводятся реакции, GeCl4, если таковой имеется, и SiCl4 присутствуют в виде газов. Поскольку в системе поддерживается непрерывный ток Cl2 23, GeCl4, если таковой имеется, и SiCl4 покидают реактор в паровых фазах и переносятся газовым потоком в зоны конденсации процесса, которые более подробно будут описаны ниже. Газы, покидающие реактор 14, включают в себя GeCl4, если таковой имеется, SiCl4, Cl2, BCl3 и СО2. Газообразный продукт 30 отделяют от твердого восстановителя 22 с помощью сепаратора твердой и газовой фаз (не показан). Твердый восстановитель 22 собирают в приемный бункер и повторно используют при хлорировании в качестве восстановителя. Для извлечения кремния и германия, содержащихся в стеклянных отходах в виде оксидов, в качестве эффективного хлорирующего агента при относительно низкой температуре процесса используют BCl4-. В частности, BCl4- является хлорирующим агентом для GeO2, входящего в состав SiO2 стекол. Таким образом, упомянутые выше реакции могут использоваться для одновременного получения GeCl4 и SiCl4 из стеклянных отходов оптических волокон, содержащих оксиды кремния и германия. BCl4- также является хлорирующим агентом для SiO2, содержащегося в сырьевом материале, обогащенном SiO2, с получением SiCl4. Как описано выше и более подробно будет описано ниже, BCl3 может быть добавлен в виде газа (фиг. 4 и 5) либо может генерироваться in situ (фиг. 3) по реакции Газообразный продукт 30 собирают в систему трубопроводов, соединяющую реактор 14 хлорирования и первый конденсационный блок 32 (фиг. 3 и 4) или первичный конденсатор 132 (фиг. 5). Систему трубопроводов термостатируют, то есть температура газа внутри трубопровода не позволяет газу конденсироваться прежде, чем он достигнет конденсационного блока. Так, температура может поддерживаться выше температуры кипения/конденсации GeCl4 (84°C), если система включает в себя первый конденсационный блок 32 (фиг. 3 и 4), и выше температуры кипения/конденсации SiCl4 (57,6°C), если система включает в себя первичный конденсатор 132 (фиг. 5). Для сырьевого материала в виде стеклянных отходов точки кипения других компонентов газообразного продукта, выходящих из реактора 14, будет ниже, чем точка кипения GeCl4. Таким образом, все компоненты газообразного продукта в системе трубопроводов, соединяющих реактор 14 хлорирования и первый конденсационный блок 32 или первичный конденсатор 132, остаются в газовой фазе. Первый конденсационный блок: GeCl4 (фиг. 3 и 4). Если сырьевой материал 10 включает в себя стеклянные отходы и, следовательно, газообразный продукт 30 включает в себя газообразный GeCl4, в первом конденсационном блоке 32 из других компонентов газообразного продукта, в частности, SiCl4 (г), BCl3 (г), Cl2 (г), CO2 (г), будет избирательно конденсироваться GeCl4 (г), как показано на фиг. 1 и 2. Для избирательной конденсации GeCl4 температуру внутри блока 32 устанавливают чуть ниже точки кипения GeCl4 и чуть выше точки кипения SiCl4 (57,6°С). Газообразный продукт 30 охлаждают и промывают жидким GeCl4 38. Блок 32 заполнен перфорированными сферами, изготовленными из устойчивого материала. Петля рециркуляции жидкого GeCl4, соединенная с распылительной форсункой, размещенной в верхней части блока, обеспечивает достаточную перколяцию и контактирование между жидкой фазой 38 и газообразным продуктом 30. Сконденсировавшийся жидкий GeCl4 40 собирают в резервуар, размещенный у основания конденсационного блока 32. Газообразный продукт 42, покидающий блок 32, по существу, состоит из SiCl4 (г), BCl3 (г), Cl2 (г) и СО2 (г). Его направляют через вторую систему трубопроводов во второй конденсационный блок 34, где конденсируется газообразный SiCl4, как подробнее будет описано ниже. Как и первую систему трубопроводов, идущую от реактора 14 к первому конденсационному блоку 32, вторую систему трубопроводов термостатируют. Так, температура может поддерживаться выше температуры кипения SiCl4 (57,6°С) и ниже температуры кипения GeCl4 (84°C). Таким образом, все компоненты газообразного продукта во второй системе трубопроводов, расположенной между первым и вторым конденсационными блоками 32, 34, остаются в газовой фазе. Если сырьевой материал 110 включает в себя материал, обогащенный SiO2, по существу не содержащий GeO2, первый конденсационный блок 32 может быть заменен первичным конденсатором 132, как показано на фиг. 5, поскольку газообразный продукт 30 также, по существу, не будет содержать газообразного GeCl4. Следует понимать, что первый конденсационный блок 32 может быть байпасирован либо удален. Такую первичную стадию конденсации проводят для сырьевого материала, обогащенного SiO2, содержащего существенные количества оксидов, отличных от GeO2. Эти оксиды, а также SiO2, превращают в хлориды и выводят за пределы реактора 14 хлорирования в виде газов. Эти хлориды (MClx) должны быть сконденсированы отдельно от SiCl4 во избежание загрязнения последующих стадий процесса. Таким образом, в первичном конденсаторе 132 от других компонентов газообразного продукта, в частности, SiCl4 (г), BCl3 (г), Cl2 (г) и СО2 (г), в виде смеси конденсацией отделяются хлоридные примеси. Для выполнения этой избирательной конденсации первичный конденсатор 132 находится в гидравлической связи с реактором 14 хлорирования и содержит дефлекторы с большой поверхностью, предназначенные для сбора таких хлоридных примесей. Температуру внутри первичного конденсатора 132 регулируют таким образом, чтобы она была немного выше температуры кипения/конденсации SiCl4 (57,6°C), чтобы обеспечить максимальное удаление нежелательных хлоридов и позволить SiCl4 покидать первичный конденсатор 132 в виде газа 42. Сконденсированные хлориды 140 собирают в резервуар, размещенный на базе первичного конденсатора 132. Газообразный продукт 42, покидающий конденсатор 132, по существу, состоит из SiCl4 (г), BCl3 (г), Cl2 (г) и СО2 (г). Его направляют через вторую систему трубопроводов во второй конденсационный блок 34, где конденсируется газообразный SiCl4, как подробнее будет описано ниже. Как и в случае первой системы трубопроводов, идущей от реактора 14 хлорирования к первичному конденсатору, вторую систему трубопроводов термостатируют. Соответственно, температура может поддерживаться выше температуры кипения SiCl4 (57,6°C). Таким образом, во второй системе трубопроводов, идущей между первичным конденсатором 132 и вторым конденсационным блоком 34, все компоненты газообразного продукта остаются в газообразной фазе. Этот второй конденсационный блок 34 аналогичен первому конденсационному блоку 32, за исключением того, что температуру внутри блока 34 устанавливают немного ниже точки конденсации SiCl4 и выше точки конденсации BCl3, а газообразный продукт 42, покидающий блок 34, промывают SiCl4 44 в жидкой фазе. Согласно варианту осуществления температура внутри блока 34 лежит в пределах от 15 до 25°С. Такие рабочие условия позволяют осуществлять селективную конденсацию SiCl4 46, который собирают в резервуар, расположенный в основании блока 34. В результате газообразный продукт 48, покидающий второй конденсационный блок 34, по существу, включает в себя BCl3(г), Cl2(г), СО2(г). Его направляют в третий конденсационный блок 36, где проводят конденсацию BCl3 с использованием третьей системы трубопроводов. Как и в случае предыдущих систем трубопроводов, третью систему трубопроводов термостатируют и поддерживают в ней температуру выше температуры кипения BCl3 (12,5°С) и ниже температуры кипения SiCl4 (57,6°C). Таким образом, компоненты газообразного продукта BCl3(г), Cl2(г), СО2(г) в третьей системе трубопроводов, расположенной между вторым и третьим конденсационными блоками 34, 36, остаются в газовой фазе. В третьем конденсационном блоке 36 конденсируется газообразный BCl3. Температуру внутри блока 36 устанавливают немного ниже точки конденсации BCl3, а газ, покидающий блок 36, промывают жидким BCl3 50, обеспечивая его селективную конденсацию. Согласно варианту осуществления температура внутри блока 36 лежит в пределах от 0 до 10°С. Газообразный продукт 52, покидающий блок 36, содержит Cl2 (г) и СО2 (г), и его направляют в системы очистки и нейтрализации газов. Жидкий BCl3 56, полученный на этой стадии конденсации, может быть рециклизован в виде реагента 223 в реактор 14 хлорирования после стадии газификации 58. Количество рециклизованного BCl3 223, использованного для хлорирования оптиковолоконного сырья 10 и обогащенного SiO2 сырья 110, при необходимости выравнивают с помощью дополнительной подачи BCl3 29 или твердого соединения бора 16. Хлор (Cl2) из газообразного продукта 52 удаляют в скруббере 54. Этот скруббер 54 состоит из вертикального цилиндра, содержащего перфорированные пластмассовые сферы. Скруббер 54 заполняют до определенного уровня раствором NaOH 60. Система, включающая в себя насос, связанный с петлей рециркуляции и распылительной насадкой, расположенной в верхней части скруббера 54, обеспечивает промывку газообразного продукта 52 и его контактирование с раствором NaOH 60. Между хлором, содержащимся в газообразном продукте 52, и раствором NaOH 60 протекает следующая реакция: Величину рН раствора регулируют с помощью внешней подачи концентрированного раствора NaOH. Раствор NaOCl 62, образующийся в результате очистки газа, далее обрабатывают Н2О2 64 в аппарате 66 с перемешиванием с получением раствора хлорида натрия 68 по реакции Газ, покидающий верхнюю часть скруббера, по существу, состоит из СО2 70. При необходимости СО2 70, покидающий процесс, может улавливаться или нейтрализоваться с помощью существующей дополнительной технологии улавливания выделений СО2. Согласно альтернативному варианту осуществления скруббер 54 для промывки хлора может быть заменен хлорным компрессором, позволяющим осуществлять сжатие газообразного хлора с образованием жидкого хлора, тем самым отделяя его от газообразного СО2. Сжатый хлор может храниться в газовых баллонах для последующего использования, такого как в качестве одного из реагентов процесса хлорирования. Способ, описанный выше, превращает стеклянные отходы оптических волокон или любой материал, обогащенный SiO2, в хлоридные формы, которые могут быть прямо или косвенно использованы в качестве сырьевого материала для изготовления оптических волокон, различных элементов электронного оборудования или панелей солнечных батарей. Жидкие тетрахлориды, селективно разделенные в ходе процесса и собранные на базе конденсатора GeCl4 и конденсатора SiCl4, имеют относительно высокую чистоту. При необходимости могут быть проведены дополнительные стадии очистки выделенных хлоридов, полученных с помощью способа. Эти дополнительные стадии очистки могут включать в себя один или несколько методов, таких как перегонка, фракционная перегонка, экстракция растворителем, очистка с помощью смол или с помощью эффекта общего поля. Или же газ, покидающий реактор 14 и содержащий SiCl4 и GeCl4, конденсируют в отдельном конденсационном блоке 44. После этой стадии конденсации компоненты полученной жидкой смеси разделяют с помощью фракционной перегонки 76, позволяющей получать чистые SiCl4 72 и GeCl4 74. Конденсацию газовой фазы, выходящей из реактора, в соответствующем конденсационном блоке с образованием жидкости проводят при температуре, при которой давление газовых паров является достаточно низким для получения жидкости, содержащей Cl2, BCl3, SiCl4 и GeCl4. Полученную жидкость далее подают на колонну для фракционной перегонки. При необходимости газовую фазу, выходящую из конденсационного блока, нейтрализуют в скруббере 54, при этом Cl2 превращается в NaOCl 62, а остаточные BCl3, SiCl4 и GeCl4 - в их соответствующие оксиды и/или гидроксиды. Колонна для фракционной перегонки работает таким образом, что сначала в верхней части колонны конденсируется Cl2. Когда Cl2 полностью удаляется из смеси, рабочие параметры изменяют для получения в верхней части колонны BCl3 56, который также конденсируется независимо. После полного удаления BCl3 из смеси параметры регулируют для получения в верхней части колонны чистого SiCl4 72, который собирают отдельно. В конце стадии перегонки SiCl4 в кубе будет содержаться только GeCl4 74. Такая процедура перегонки позволяет извлекать четыре независимых жидких соединения: Cl2, BCl3, SiCl4 и GeCl4. Жидкий Cl2 после соответствуюющей стадии газификации может быть рециркулирован в качестве реагента для способа. Жидкий BCl3 после соответствующей стадии газификации также может быть рециркулирован в качестве реагента для способа. На фиг. 7 и 8 показана экспериментальная установка для проведения описанного выше процесса. Опыты проводили в цилиндрическом горизонтальном реакторе 310, включающем в себя кварцевую трубку, имеющую инертную футеровку и нагреваемую при помощи электропечи 312, в виде реакционной трубки. К реакционной трубке 310 подсоединяли баллоны с газообразными Cl2, BCl3 и N2 314. Для получения количественного распределения газов в реакционной трубке 310 использовали регуляторы давления и регуляторы расхода 316 (фиг. 7). Газы, покидающие реактор 310, очищали в скруббере 318 с помощью раствора NaOH, дозируемого периодически. СО (г) и СО2 (г), нейтрализовали в скруббере 318 и удаляли при помощи лабораторного вытяжного устройства (не показано). Небольшое количество опытов проводили, используя в качестве восстановителя СО. В этих случаях в экспериментальную установку добавляли четвертый газовый баллон и соответствующий расходомер. В стандартном опыте выполняли следующие стадии. Определенный тип отходов оптических заготовок измельчали до минус 20 мкм. Этот измельченный материал помещали в стакан 320 (фиг. 8), при необходимости, как подробнее будет описано ниже применительно к уравнениям 10 и 11, добавляли твердый восстановитель и Н3ВО3 (непосредственно либо адсорбированным на твердом восстановителе). Или же, измельченный материал помещали в стакан 320 и при необходимости добавляли твердый восстановитель с или без KCl в качестве соли для реакционной смеси. Стакан 320 помещали в центр реакционной трубки 310 (фиг. 8). Систему продували N2, и твердые вещества сушили в течение часа при температуре 500°С. В конце стадии сушки температуру в печи устанавливали в пределах от 450 до 1100°С. По достижении температуры реакции ток N2 прекращали и в систему подавали Cl2 при общем расходе в пределах от 0,1 до 0,4 л в минуту, с использованием или без использования СО либо BCl3 в зависимости от требований. В случае использования СО соотношение расходов Cl2/CO устанавливали одинаковым для большинства опытов. При использовании BCl3 устанавливали расход 0,1 л в минуту. По истечении установленного времени получали GeCl4(г) и SiCl4(г), которые покидали печь 312 и очищались. Степени превращения GeO2 и SiO2 для данного опыта рассчитывали исходя из изменений масс GeO2 и SiO2 между исходной массой и массой, полученной в конце опыта для твердого остатка, остающегося в стакане 320. Изменения массы относили на счет превращений GeO2 и SiO2 в их соответствующие тетрахлориды (GeCl4 и SiCl4). Эти тетрахлориды, будучи летучими при температуре в исследуемом диапазоне, уносились за пределы стакана 320, содержащего образец заготовки, и очищались в скруббере с помощью раствора NaOH. Изменения массы рассчитывали исходя из веса образца и веса твердого остатка, общего для соответствующих концентраций GeO2 и SiO2. Анализы выполняли путем сплавления с метаборатом лития с последующим растворением в HNO3 и HCl, образующиеся в результате жидкости анализировали при помощи атомно-эмиссионного спектрометра с индуктивно связанной плазмой (ICP-AES). -1: (масса KCl/общая масса образца) × 100; н/а: не анализировали; В2О3 АУ: В2О3, адсорбированный на активированном угле. Для всех опытов использованные экспериментальные параметры и полученные степени превращения представлены в табл. 1 и 2. Опыты, описанные в табл. 1 и 2, проводили с заготовкой для оптического волокна, содержащей 99 мас.% SiO2 и 1 мас.% GeO2. Дополнительные детали содержатся в приведенных ниже конкретных примерах. Для оценки влияния природы восстановителя проводили другой процесс хлорирования, названный здесь высокотемпературным процессом. При таком высокотемпературном процессе для превращения оксидных фаз в хлориды и, в частности, для превращения компонентов оптических волокон в их хлоридные предшественники, GeCl4 и SiCl4, используется газообразный хлор или газообразный HCl в комбинации с газообразным СО. На стадии карбохлорирования протекают следующие реакции: и Опыты, проводившиеся при температуре 1200°С, показали, что менее 5% SiO2, одного из двух основных целевых химических веществ, было превращено в хлоридную форму. Таким образом, этот высокотемпературный процесс рассматривался как относительно неэффективный. Пример 1. Определение основных параметров, влияющих на одновременное превращение Чтобы минимизировать количество опытов по определению основных параметров, регулирующих превращение GeO2 и SiO2 в GeCl4 и SiCl4, была построена ортогональная матрица Тагучи, использующая четыре параметра: а) время реакции, b) температура реакции, с) добавление бора, d) тип восстановителя. Время реакции варьировали от 20 до 90 мин. Температуру варьировали от 700 до 1200°С. Изучаемыми твердыми восстановителями были металлургический кокс и газообразный СО. Бор добавляли непосредственно в виде Н3ВО3. Изученные параметры и полученные степени превращения в соответствии с заданной ортогональной матрицей представлены в табл. 1 для опытов № 1-10. Для этих опытов только коэффициент превращения SiO2 рассматривался как значащий для вариационного анализа, поскольку погрешность анализа в случае степени превращения GeO2 была больше чем в случае SiO2, и вводились дополнительные погрешности определения входящих параметров. Высокие степени превращения SiO2 благоприятствуют более высоким степеням превращения GeO2 вследствие физической природы GeO2-SiO2 стекол. В частности, основной компонент SiO2 эффективно удаляется в виде газа и, вследствие этого оставляет GeO2 открытым к воздействию химических реагентов, присутствующих в реакторе. Степени превращения SiO2 изменялись в диапазоне от 1 до 30% в зависимости от условий эксперимента. Вариационный анализ для изученных параметров рассчитывали, используя программное обеспечение Optimum, распространяемое TDC software. В результате проведенного анализа было сделано три важных наблюдения. Во-первых, добавление бора в виде Н3ВО3 всегда приводило к самыми высоким степеням превращения SiO2. Один только этот параметр является причиной 66% изменения результатов. Это наблюдение согласуется с экспериментальными данными, доступными из научной литературы, как описано выше в разделе хлорирования. Во-вторых, металлургический кокс в качестве восстановителя оказался более эффективным, чем СО в чистом виде или в комбинации с металлургическим коксом. В-третьих, время реакции в пределах выделенного матричного интервала, то есть в диапазоне от 30 до 90 мин, как оказалось, оказывает незначительное влияние на степень превращения SiO2. Второе и третье наблюдения были аналогичными. Твердые углеродсодержащие восстановители, такие как металлургический кокс, ускоряют реакции хлорирования. Это связывают с образованием на их поверхностях атомного хлора или активных частиц хлора с последующей десорбцией. Далее эти частицы реагируют с поверностью соединения, подлежащего хлорированию (Korshunov, 1992, Metallurgical Review of MMIJ, 8, (2), pp. 1-33). Важным является расстояние между данным углеродсодержащим твердым восстановителем и поверхностью оксида. Если это расстояние увеличивается до определенного уровня, атомарный хлор или активированный хлор, высвободившийся в газовой фазе, может рекомбинировать в результате столкновения частиц и стать дезактивированным. Во время реакций хлорирования поверхности углеродсодержащего восстановителя, контактирующие либо находящиеся рядом с оксидами, расходуются, вследствие чего расстояния, разделяющие твердые восстановители и оксиды, постоянно увеличиваются и в конечном итоге достигают точки, в которой концентрации атомного хлора или частиц снижаются вследствие реакций рекомбинации. Затем скорости реакций снижаются, и реакция протекает по механизму с участием молекулярного хлора (Barin и Schuler, 1980, Metallurgical Transactions В, 11В, pp. 199-207). Таким образом, для данной реакции хлорирования, проводимой в статическом реакторе с использованием в качестве твердого восстановителя угля, различают две кинетические зоны. Сначала идет быстрая зона, характеризующаяся быстрыми кинетическими реакциями, обусловленными наличием атомного хлора или частиц активированного хлора. Более поздняя медленная зона характеризуется реакциями с медленной кинетикой, протекающими с участием молекулярного хлора. Вероятно, что выбранные величины времени реакции оказались такими, что реакции хлорирования уже достигли медленной кинетической зоны, проявляя лишь незначительное увеличение степени превращения SiO2 с течением времени. Эти наблюдения использовали для разработки опытов по увеличению степеней превращения GeO2 и SiO2. Уравнения с 5 по 7 показывают, что лишь в уравнении 7 требуется использование хлора в присутствии твердого углеродсодержащего восстановителя. Предполагается, что как только образуется BCl3, реакции с GeO2 и SiO2 будут протекать быстро и не будут идти по диффузионному механизму, подразумевающему наличие атомного хлора или частиц активированного хлора. BCl3 является очень сильной кислотой Льюиса (Alam et al., 2004) и должен быстро реагировать с двумя свободными электронными парами каждого атома кислорода в GeO2 и SiO2. Оптимизация кинетики реакции 9, при условии, что образование BCl3 является медленной стадией, должна увеличивать общую кинетику химической системы. Следующй пример иллюстрирует влияние оптимизации образования BCl3 на степени превращения GeO2 и SiO2. Пример 2. Оптимизация образования BCl3 и ее влияние на степени превращения GeO2 и SiO2. Для того чтобы максимально увеличить контакт между данным соединением бора и твердым углеродсодержащим восстановителем, раствор, насыщенный борной кислотой, помещали в химический стакан с активированным углем. Массу затем перемешивали и фильтровали. Полученный твердый остаток сушили в течение ночи в печи при температуре 150°С. Полученный в результате активированный уголь, легированный бором, использовали для опытов. Известно, что BCl3 реагирует с водой, фактически с любыми соединениями, содержащими кислород, как описано выше. Для того чтобы свести к минимуму побочные реакции BCl3 с водой, было сделано дополнение к описанной выше методике опыта. Реагент, помещенный в печь, сушили при температуре 500°С в течение 3 ч в атмосфере азота, прежде чем подвергнуть воздействию газообразного хлора. Экспериментальные параметры и результаты этих опытов представлены в табл. 1 для опытов № 11 и 12. Для этих двух опытов степени превращения GeO2 являются высокими, 79 и 76%, соответственно для опытов 11 и 12. Аналогично, степени превращения SiO2 также являются высокими, 67 и 65%, соответственно для опытов 11 и 12. Как и ожидалось, существует прямая зависимость между степенями превращения GeO2 и SiO2. По сравнению с опытом 11, время реакции в опыте 12 увеличилось с 20 до 60 мин. При этом никакого существенного улучшения степени превращения не наблюдалось; степени превращения, полученные для опыта 12, были в пределах погрешностей степеней превращения опыта 11. Пример 3. Влияние "имитированного частичного перемешивания" на степени превращения GeO2 и SiO2. Опыты с 1 по 12 проводили в статическом горизонтальном реакторе. Невозможно переработать экспериментальную установку, изображенную на фиг. 7, в динамическую без введения существенных изменений в систему. Тем не менее, для опыта 13 методика опыта была модифицирована, чтобы имитировать один или несколько эпизодов частичного перемешивания. По истечении заданного времени реакции ток хлора выключали и кварцевую реакционную трубку продували N2. Температуру печи понижали от заданной температуры опыта до 350°С. Стеклянный стакан, содержащий порошок, вынимали из печи еще горячим, используя стеклянный стержень. Затем порошок перемешивали стеклянной ложкой в течение нескольких минут в вытяжном шкафу. После этого стакан с порошком снова помещали в печь, температуру доводили до заданной температуры опыта, поддерживая в реакционной трубке ток N2. По достижении заданной температуры опыта N2 отключали и в систему подавали Cl2. Опыт 13 из табл. 1 представляет экспериментальные параметры и полученные степени превращения. В данном конкретном опыте были использованы два эпизода частичного перемешивания, каждый после 20 мин времени реакции. Общее время реакции в атмосфере хлора составило 60 мин. Степени превращения, полученные для GeO2 и SiO2, составили 84 и 72%, соответственно. Эти результаты были полностью сопоставимыми с опытом 12, в котором все экспериментальные параметры соответствуют параметрам опыта 13, за исключением того, что не использовалось никакого частичного перемешивания. Это сравнение показывает, что имитированное частичное перемешивание приводит к увеличению степени превращения GeO2 на 8%, с 76 до 84%, и к увеличению степени превращения SiO2 на 7%, с 65 до 72%. Несомненно, что перемешивание положительно сказывается на степени превращения. Как обсуждалось ранее в примере 1, любые химические методы, такие как адсорбция, или физические методы, такие как перемешивание, увеличивают контакты между частицами оксидов и частицами твердого углеродсодержащего восстановителя, приводя к увеличению общей эффективности способа хлорирования. Способ, описанный выше, позволяет получать высокочистые хлориды из стеклянных отходов от производств оптических волокон или выделенных из отработанных оптических кабелей. Способ позволяет напрямую получать GeCl4 и SiCl4 из стандартных компонентов стеклянных отходов оптических волокон, GeO2 и SiO2, без образования промежуточных компонентов, таких как кремний и элементарный германий. Кроме того, полученные GeCl4 и SiCl4 отделяются друг от друга и могут использоваться в качестве исходных реагентов в реакциях дехлорирования для таких процессов, как MCVD, ODS, AVD и других аналогичных процессов. GeO2 и SiO2, содержащиеся в стеклянных отходах оптических волокон, одновременно выделяют из стеклянных отходов оптических волокон в виде GeCl4 и SiCl4 соответственно. Кроме того, их выделяют в виде газообразных GeCl4 и SiCl4, выходящих из реактора в виде газов. Газообразные GeCl4 и SiCl4, покидающие реактор, конденсируются по отдельности в виде жидкостей в соответствующих конденсаторах, размещенных на выходе из реактора хлорирования. В первом конденсаторе выделяется и конденсируется в основном GeCl4, тогда как во втором конденсаторе выделяется и конденсируется в основном SiCl4. Полученные GeCl4 и SiCl4 могут быть использованы непосредственно в качестве высокочистых химических реагентов для получения оптических волокон или в других процессах, требующих применения высокочистых реагентов. Или же, полученные GeCl4 и SiCl4 могут быть подвергнуты известному способу очистки, такому как фракционная перегонка, для достижения необходимой степени чистоты. Кроме того, имеются методики нейтрализации и/или рециркуляции реагентов, необходимых для процесса. Пример 4. Хлориющий агент - BCL4-. Хотя реакции хлорирования могут осуществляться различными способами, следует отметить, что твердые углеродсодержащие восстановители, такие как металлургический кокс и активированный уголь, обычно ускоряют реакции хлорирования. Это объясняется образованием на их поверхностях атомного хлора, частиц активированного хлора или ионного хлора (Cl- и/или Cl+) с последующей десорбцией. Эти частицы, в данном контексте называемые активным хлором, далее реагируют с поверхностью соединения, подлежащего хлорированию (Korshunov, 1992, Metallurgical Review of MMIJ, 8, (2), pp. 1-33). Кроме того, относительно важным является расстояние между данным углеродсодержащим твердым восстановителем и поверхностью оксида. Если это расстояние превышает определенный порог, активный хлор, высвободившийся в газовой фазе, может рекомбинировать и дезактивироваться. Во время реакции хлорирования поверхности углеродсодержащих восстановителей, контактирующих с оксидами или находящихся рядом с ними, расходуются, и вследствие этого расстояние, разделяющее твердый восстановитель и оксиды, в процессе протекания реакций хлорирования постоянно растет и в конечном итоге достигает точки, где концентрация активного хлора оказывается низкой из-за реакций рекомбинации. При этом скорость реакции замедляется, и реакция протекает по механизму с участием молекулярного хлора (Barin and Schuler, 1980, Metallurgical Transactions В, 11 В, pp. 199-207). Таким образом, в случае реакций хлорирования быстрая кинетика связана, во-первых, с образованием активного хлора и, во-вторых, со стабильностью активного хлора во времени. Планирование опытов с целью получения высоких степеней превращения SiO2 и GeO2 было основано на этих двух наблюдениях. Действие BCl3 на SiO2 с получением SiCl4 и В2О3 изучали при температуре около 350°С (см., например Kroll, Metal Industry, 1952, 81, (13), 243-6; Savel'ev et al., Neorganicheskie Materialy, 1973, 9, (2), 325-6). В2О3 может хлорироваться (или регенерироваться) до BCl3 под действием Cl2 и восстановителя, такого как кокс или активированный уголь (Alam et al., 2004, Kirk-Othmer Encyclopedia of chemical technology (Химико-технологическая энциклопедия), 138-168). В патентном документе US 4490344 раскрыта комбинация BCl3, Cl2 и кокса для получения SiCl4 из SiO2 в соотвествии со следующими реакциями: Эти реакции не проводили с активным хлором, таким как (Cl- и или Cl+). Более того, в реакциях 6, 7, 14 и 15 не рассматривается стабильность активного хлора. Для получения активного хлора и иона BCl4- BCl3 реагировал с KCl с получением солевого расплава KBCl4. Для хлорирования SiO2 и GeO2 использовали следующую химическую систему: Чтобы оценить эффективность реакции хлорирования с использованием BCl4-, проводили серию опытов. Результаты представлены в табл. 2 для образцов под номерами с 1 по 11. Наивысшие степени превращения были получены для образцов с 1 по 7. В частности, степени превращения SiO2 и GeO2, соответственно в SiCl4 и GeCl4, были равны или превышали 94 мас.%. Температуру реакции поддерживали 850°С, содержание KCl в реакционной смеси варьировали от 13 до 23 мас.%. Длительность реакции изменяли в диапазоне от 30 до 60 мин, а соотношение (масса оксида)/(масса активированного угля) варьировали в пределах от 0,14 до 1. Для образца под номером 7 соотношение (масса оксида)/(масса активированного угля) доводили до 2. В случае данного конкретного образца степени превращения SiO2 и GeO2 составляли 94 мас.% и 95 мас.% соответственно. Результаты, полученные для образцов 8, 9 и 11, показали, что уменьшение добавки KCl приводило к более низким степеням превращения как для SiO2, так и для GeO2. Более высокие степени превращения SiO2 и GeO2 были получены при добавлении KCl в пределах от 12 до 15 мас.% и согласно варианту осуществления при приблизительно 13 мас.%. В случае образца 10 снижение температуры реакции с 850 до 700°С приводило в уменьшению степеней превращения до 72 мас.%, и для SiO2, и для GeO2. Один из опытов останавливали спустя 10 мин и стекла SiO2-GeO2 анализировали с использованием микропробы для оценки наличия В2О3. В2О3 в анализируемом образце обнаружен не был. Это свидетельствовало о том, что реакции хлорирования протекали в соответствии с уравнениями с 10 по 15 без промежуточного образования В2О3. Результаты показали, что хлорирование SiO2 и GeO2 эффективно осуществляется с помощью реакционной смеси, включающей в себя BCl3, KCl, Cl2 и активированный уголь, химической системы, способствующей образованию BCl4- в качестве хлорирующего агента. Степени превращения SiO2 и GeO2 в их тетрахлориды SiCl4 и GeCl4, равные или превышающие 94 мас.%, были получены при температурах около 850°С и в течение времени реакции, составляющего приблизительно 30 мин. Пример 5. Хлорирующий агент - BCL3. Чтобы продемонстрировать, что химическая система, в которой используется BCl4-, описанная в предыдущем примере, является более эффективной, чем система с использованием в качестве хлорирующего агента BCl3 (например, патентный документ US № 4490344), проводили опыты с использованием реакционной смеси, содержащей BCl3, но, по существу, не содержащей KCl. Результаты представлены в табл. 2 для образцов под номерами 12 и 13. Образец 12 хлорировали в экспериментальных условиях, идентичных образцу 5, за исключение того, что в реакционную смесь не добавляли KCl. Для образца 12 степени превращения SiO2 и GeO2 составили соответственно 61 мас.% и 68 мас.%. Для образца 5, в случае реакционной смеси, содержащей 14 мас.% KCl, степени превращения составили 96 мас.% как для SiO2, так и для GeO2. Полученные данные отчетливо показывают влияние добавления KCl в реакционную смесь. Добавление KCl в реакционную смесь приводит к увеличению степени превращения SiO2 на 57% и к увеличению степени превращения GeO2 на 41%. Для образца под номером 13 активированный уголь в реакционной смеси заменяли СО. Как и в случае образца 12, реакционная смесь, по существу, не содержала KCl. Полученные степени превращения составили 51 мас.% для SiO2 и 49 мас.% для GeO2. Более высокие степени превращения как для SiO2, так и для GeO2, были получены не с СО, а при использовании в реакционной смеси в качестве твердого восстановителя активированного угля. Пример 6. Хлорирование с помощью В2О3 в качестве исходного химического компонента. BCl3 может быть получен при помощи хлорирования из В2О3 (Alam et al., 2004). При определенных условиях можно успешно получать BCl3 из В2О3 путем хлорирования, при этом полученный BCl3 используется в качестве хлорирующего агента. Проводили опыты по изучению влияния добавки KCl в таких случаях. Как показано на фиг. 3, для получения твердого восстановителя раствор, насыщенный борной кислотой, помещали в химический стакан с активированным углем. Затем массу перемешивали и фильтровали. Полученный твердый остаток сушили в течение ночи в печи при температуре 150°С. Полученный в результате активированный уголь, легированный бором, использовали для опытов по хлорированию. Известно, что BCl3 энергично реагирует с водой. Чтобы минимизировать побочные реакции BCl3 с водой, в методику опыта вводили дополнительную стадию. В частности, загрузку сушили в печи при температуре 500°С в течение 3 ч в атмосфере азота перед обработкой реакционной смесью, содержащей газообразный хлор. Экспериментальные параметры и результаты этих опытов представлены в табл. 2 для образцов под номерами 14 и 15. Для образца 14, где реакционная смесь включает в себя 13 мас.% KCl, степени превращения, полученные для SiO2 и GeO2, составили соответственно 79 и 78 мас.%. В случае реакционной смеси, по существу, не содержащей KCl, при тех же экспериментальных параметрах степени превращения снизились до 60 мас.% в случае SiO2 и до 64 мас.% в случае GeO2, образец 15. Добавление в реакционную смесь KCl приводило к увеличению степеней превращения SiO2 и GeO2. Пример 7. Влияние использования только Cl2 и восстановителя. Кроме того, проводили опыты с использованием Cl2 в качестве единственного хлорирующего агента в присутствии восстановителя. Изучаемыми восстановителями были СО и металлургический кокс. При использовании СО на стадии карбохлорирования протекают следующие реакции: При замене СО металлургическим коксом протекают реакции: Результаты, представленные в табл. 2 для образцов под номерами с 16 по 18, показали, что степени превращения SiO2 составляют менее или равны 6 мас.%. Возможно, что экспериментальные параметры для образцов с 16 по 18 не способствуют образованию высокой концентрации активного хлора. Вследствие этого эффективность хлорирования снижается по сравнению с экспериментальными условиями, при которых используется реакционная смесь, содержащая KCl и BCl3, при аналогичных температурах реакции (850 и 1000°С) и времени реакции. Технология, описанная выше, позволяет получать тетрахлориды высокой чистоты из стеклянных отходов от производства оптических волокон или выделенных из отработанных оптических кабелей. Технология также описывает способ получения SiCl4 из материала, обогащенного SiO2 и, по существу, не содержащего GeO2. Она позволяет получать напрямую и одновременно GeCl4 и SiCl4 из традиционных компонентов стеклянных отходов оптических волокон, GeO2 и SiO2, без образования промежуточных компонентов, таких как кремний и элементарный германий. Кроме того, полученные и отделенные друг от друга GeCl4 и SiCl4 могут быть использованы в качестве исходных реагентов для реакции дехлорирования для таких процессов, как MCVD, ODS, AVD и другие родственные методы, поскольку они идентичны соединениям, обычно применяемым при изготовлении оптических волокон. GeO2 и SiO2, содержащиеся в стеклянных отходах оптических волокон, одновременно выделяют из стеклянных отходов оптических волокон соответственно в виде GeCl4 и SiCl4. Более того, их выделяют в виде газообразных GeCl4 и SiCl4, которые покидают реактор в виде газов. Согласно альтернативному варианту осуществления SiO2, содержащийся в обогащенном SiO2 материале, может быть преобразован главным образом в газообразный SiCl4, который далее конденсируют на выходе из реактора хлорирования. Газообразные GeCl4 и SiCl4, покидающие реактор, конденсируют по отдельности в виде жидкости в соответствующих конденсаторах, размещенных на выходе из реактора хлорирования. В первом конденсаторе отделяют и конденсируют в основном GeCl4, тогда как во втором конденсаторе отделяют и конденсируют главным образом SiCl4. Полученные GeCl4 и SiCl4 могут быть напрямую использованы в виде высокочистых химических реагентов для получения оптических волокон или в других процессах, требующих применения высокочистых реагентов. Или же, полученные GeCl4 и SiCl4 могут быть подвергнуты существующему способу очистки, такому как фракционная перегонка, для достижения необходимой степени чистоты. Кроме того, имеются методики для нейтрализации и/или рециклизации реагентов, необходимых для процесса. Варианты осуществления изобретения, описанные выше, приведены исключительно в качестве примеров. Например, следует понимать, что могут быть использованы любые средства для распределения, транспортировки и перемещения твердых веществ, газов, жидкостей и суспензий между различными элементами процесса. Вследствие этого предполагается, что объем изобретения должен быть ограничен лишь объемом прилагаемой формулы изобретения. Предложен способ получения GeCl4 с или без SiCl4 из оптических волокон, включающий в себя стадии взаимодействия тонко измельченных оптических волокон, содержащих оксиды германия и, необязательно, оксиды кремния, с реагентом, содержащим твердый углеродсодержащий восстановитель, хлор и соединение бора, с получением газообразного продукта, содержащего газообразный GeCl4, газообразный SiCl4 и газообразный BCl3 в соответствии с реакциями и затем конденсации газообразного GeCl4, BCl3 и, необязательно, SiCl4 с образованием жидкого GeCl4, BCl3 и, необязательно, SiCl4. Изобретение также предлагает способ получения SiCl4 (и необязательно GeCl4) из стеклянных отходов от производства оптических волокон и из отработанных оптических кабелей. Способ включает в себя стадии взаимодействия тонко измельченных стеклянных отходов с реагентом, содержащим твердый углеродсодержащий восстановитель, соль, соединение бора, с получением газообразного продукта, содержащего SiCl4, BCl3 и, необязательно, GeCl4; и затем конденсации газообразных SiCl4, BCl3 (с или без GeCl4) с образованием жидких SiCl4, BCl3 и GeCl4. Также предложен способ получения SiCl4 из SiO2-содержащего материала. 1. Способ получения GeCl4 и SiCl4 из оптических волокон, включающий стадии взаимодействия тонко измельченных оптических волокон, содержащих оксиды германия и кремния, с реагентом, содержащим твердый углеродсодержащий восстановитель, легированный соединением бора, и хлор, с получением газообразного продукта, содержащего газообразный GeCl4, газообразный SiCl4 и газообразный BCl3, в соответствии с реакциями: конденсации газообразного GeCl4 с получением жидкого GeCl4 путем снижения температуры газообразного продукта ниже температуры конденсации GeCl4 и выше температуры конденсации SiCl4; и последующей конденсации газообразного SiCl4 с получением жидкого SiCl4 путем снижения температуры газообразного продукта ниже температуры конденсации SiCl4 и выше температуры конденсации BCl3. 2. Способ по п.1, дополнительно включающий адсорбирование в аппарате с перемешиванием соединения бора на твердый углеродсодержащий восстановитель из раствора, содержащего соединение бора, с образованием твердого углеродсодержащего восстановителя, легированного соединением бора; отделение фильтрацией твердого углеродсодержащего восстановителя, легированного адсорбированным соединением бора, от раствора; и сушку твердого углеродсодержащего восстановителя, легированного адсорбированным соединением бора, перед проведением реакционной стадии. 3. Способ по п.1 или 2, где соединение бора представляет собой H3BO3. 4. Способ по п.2 или 3, где раствор насыщают соединением бора. 5. Способ по любому из пп.2-4, где стадию сушки проводят при температуре в диапазоне от 450 до 550°С. 6. Способ получения SiCl4 из SiO2-содержащего материала, включающий стадии взаимодействия тонко измельченного SiO2-содержащего материала с реагентом, содержащим твердый углеродсодержащий восстановитель, соль, выбранную из группы, состоящей из KCl, CsCl и RbCl, и соединение бора, с получением газообразного продукта, содержащего газообразный SiCl4, в соответствии с реакциями: конденсации газообразного SiCl4 с образованием жидкого SiCl4 путем снижения температуры газообразного продукта ниже температуры конденсации SiCl4. 7. Способ по п.6, где SiO2-содержащий материал включает стеклянные отходы. 8. Способ по п.6 или 7, где SiO2-содержащий материал также содержит GeO2, и в ходе реакции также образуется GeCl4 в соответствии с реакцией: также включающий в себя конденсацию газообразных SiCl4 и GeCl4 с образованием жидких SiCl4 и GeCl4 путем снижения температуры газообразного продукта ниже температур конденсации SiCl4 и GeCl4. 9. Способ по любому из пп.6-8, где BCl3 конденсируют одновременно с конденсацией SiCl4 путем снижения температуры газообразного продукта ниже температур конденсации SiCl4 и BCl3. 10. Способ по любому из пп.6-9, где реагент дополнительно содержит хлор (Cl2). 11. Способ по любому из пп.6-10, где соотношение массы твердого углеродсодержащего восстановителя и массы стеклянных отходов лежит в пределах от 0,3 до 1. 12. Способ по любому из пп.6-11, где соотношение массы соли и суммарной массы стеклянных отходов, массы твердого углеродсодержащего восстановителя и массы соли лежит в пределах от 0,03 до 0,15. 13. Способ по любому из пп.1-12, где твердый углеродсодержащий восстановитель является металлургическим коксом, графитом или активированным углем, а соединение бора включает в себя газообразный BCl3. 14. Способ по п.7, в котором перед выполнением стадии взаимодействия тонко измельченные стеклянные отходы сушат при температуре от 400 до 600°С. 15. Способ по любому из пп.6-12, в котором стадию взаимодействия выполняют при температуре от 450 до 1100°С в коррозионно-стойком реакторе.Область техники
Предшествующий уровень техники
Сущность изобретния
Краткое описание графических материалов
Подробное описание изобретения
Стадии хлорирования и предварительной подготовки
Первый конденсационный блок: GeCl4
Второй конденсационный блок: SiCl
Третий конденсационный блок: BCl3
Промывка и нейтрализация газа
Cl2 компрессор
Жидкий GeCl4 и жидкий SiCl4
Альтернативный вариант осуществления
Стадии предварительной подготовки
Хлорирование
Первичный конденсатор (фиг. 5)
Второй конденсационный блок: SiCl4
Третий конденсационный блок: BCl3
Очистка и нейтрализация
Cl2 компрессор
Жидкий GeCl4 и жидкий SiCl4
Альтернативный вариант осуществления (фиг. 6)
Экспериментальная установка (фиг. 7 и 8)
Таблица 1. Экспериментальные параметры и результаты
Таблица 2. Экспериментальные параметры и результаты
Примеры