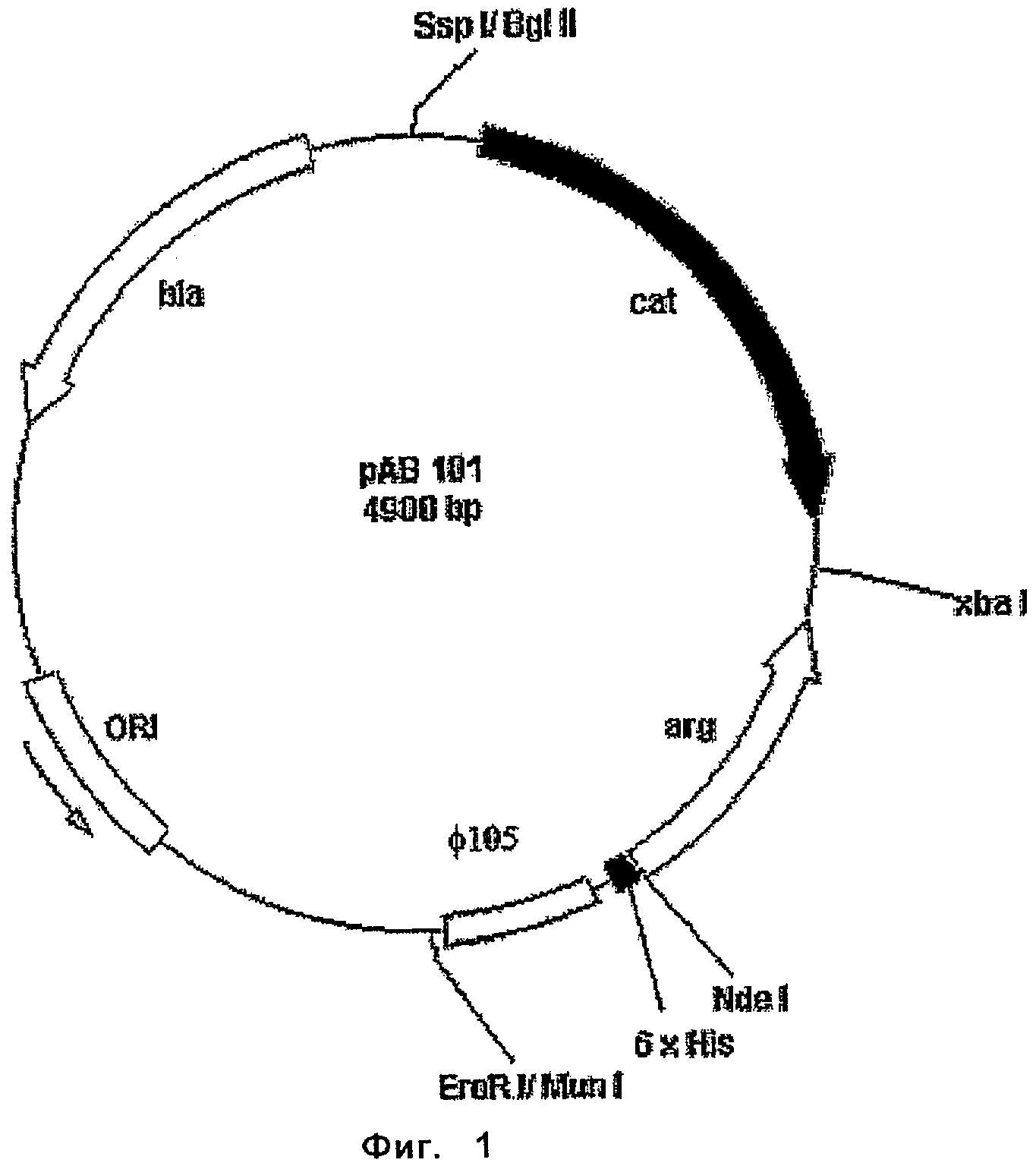
ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ И СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ У ЧЕЛОВЕКА С ПОМОЩЬЮ АРГИНИНОВОЙ ДЕПРИВАЦИИ
Текст описания приведен в факсимильном виде. Изобретение относится к биотехнологии. Описана выделенная и модифицированная рекомбинантная аргиназа I человека, имеющая чистоту 80-100%, приводящая к периоду полужизни в плазме in vivo, по меньшей мере, приблизительно 3 дня и к удельной активности, по меньшей мере, 250 МЕ/мг, где указанная аргиназа модифицирована сшиванием с не иммуногенной молекулой. Представлена фармацевтическая композиция для снижения уровня аргинина, содержащая описанную рекомбинантную аргиназу I человека в эффективном количестве. Предложен способ лечения злокачественных опухолей человека, предусматривающий введение описанной рекомбинантной аргиназы I человека или фармацевтической композиции, содержащей описанную аргиназу, внутрь пациента. Изобретение позволяет эффективно снижать уровень аргинина у пациентов с опухолями и может быть использовано для лечения злокачественных опухолей человека. 5 н. и 12 з.п. ф-лы, 47 ил., 3 табл. 1. Выделенная и модифицированная рекомбинантная аргиназа I человека, имеющая чистоту 80-100%, приводящая к периоду полужизни в плазме in vivo, по меньшей мере, приблизительно 3 дня и к удельной активности, по меньшей мере, 250 МЕ/мг, где указанная аргиназа модифицирована сшиванием с неиммуногенной молекулой. 2. Рекомбинантная аргиназа I человека по п.1, в которой указанная модификация ковалентно прикрепляет, по меньшей мере, одну частицу полиэтиленгликоля (PEG) к указанной аргиназе с использованием связующего вещества. 3. Рекомбинантная аргиназа I человека по п.2, имеющая удельную активность от 500 до 600 МЕ/мг. 4. Рекомбинантная аргиназа I человека по п.2, имеющая чистоту, по меньшей мере, 90%. 5. Рекомбинантная аргиназа I человека по п.2, где указанный связывающий агент выбран из группы, состоящей из 2,4,6-трихлор-s-триазина (циануринхлорида, СС) и сукцинимида пропионовой кислоты (SPA). 6. Рекомбинантная аргиназа I человека по п.1, имеющая значение Km ниже примерно 3,2×10-3 М. 7. Рекомбинантная аргиназа I человека по п.6, имеющая значение Km примерно (2,9±0,3)×10-3 М. 8. Фармацевтическая композиция для снижения уровня аргинина, содержащая рекомбинантную аргиназу I человека по любому из предыдущих пунктов в эффективном количестве. 9. Фармацевтическая композиция по п.8, где указанная композиция далее приготовлена в фармацевтически приемлемом носителе. 10. Фармацевтическая композиция по п.9, где указанное приготовление указанной фармацевтической композиции осуществляют в форме, приемлемой для перорального использования, в форме стерильного раствора для инъекций или стерильной суспензии для инъекций. 11. Фармацевтическая композиция по п.8, где указанная рекомбинантная аргиназа I человека имеет удельную ферментативную активность, по меньшей мере, 250 МЕ/мг. 12. Фармацевтическая композиция по п.11, где указанная рекомбинантная аргиназа I человека имеет удельную ферментативную активность 500-600 МЕ/мг. 13. Фармацевтическая композиция по п.8, где указанная рекомбинантная аргиназа I человека имеет период полужизни в плазме пациента, по меньшей мере, 3 дня. 14. Применение аргиназы I человека по п.1 для приготовления лекарственного средства, где указанное лекарственное средство используется для лечения злокачественных опухолей у человека. 15. Применение по п.14, где указанные злокачественные опухоли человека представляют собой опухоль печени, рак молочной железы, рак ободочной или прямой кишки. 16. Способ лечения злокачественных опухолей человека, предусматривающий введение рекомбинантной аргиназы I человека по любому из предыдущих пунктов внутрь пациента. 17. Способ лечения злокачественных опухолей человека у пациента, предусматривающий введение фармацевтической композиции по пп.10-14, которая снижает физиологический уровень аргинина у указанного пациента до уровня ниже 10 мкМ, по меньшей мере, в течение 3 дней.