СПОСОБ ПОЛУЧЕНИЯ САМОВОССТАНАВЛИВАЮЩИХСЯ ПОЛИМЕРНЫХ МАТЕРИАЛОВ ПОВЫШЕННОЙ ТЕПЛОСТОЙКОСТИ, ПОЛУЧЕННЫХ НА ОСНОВЕ ТАНДЕМНОЙ РЕАКЦИИ ДИЛЬСА-АЛЬДЕРА
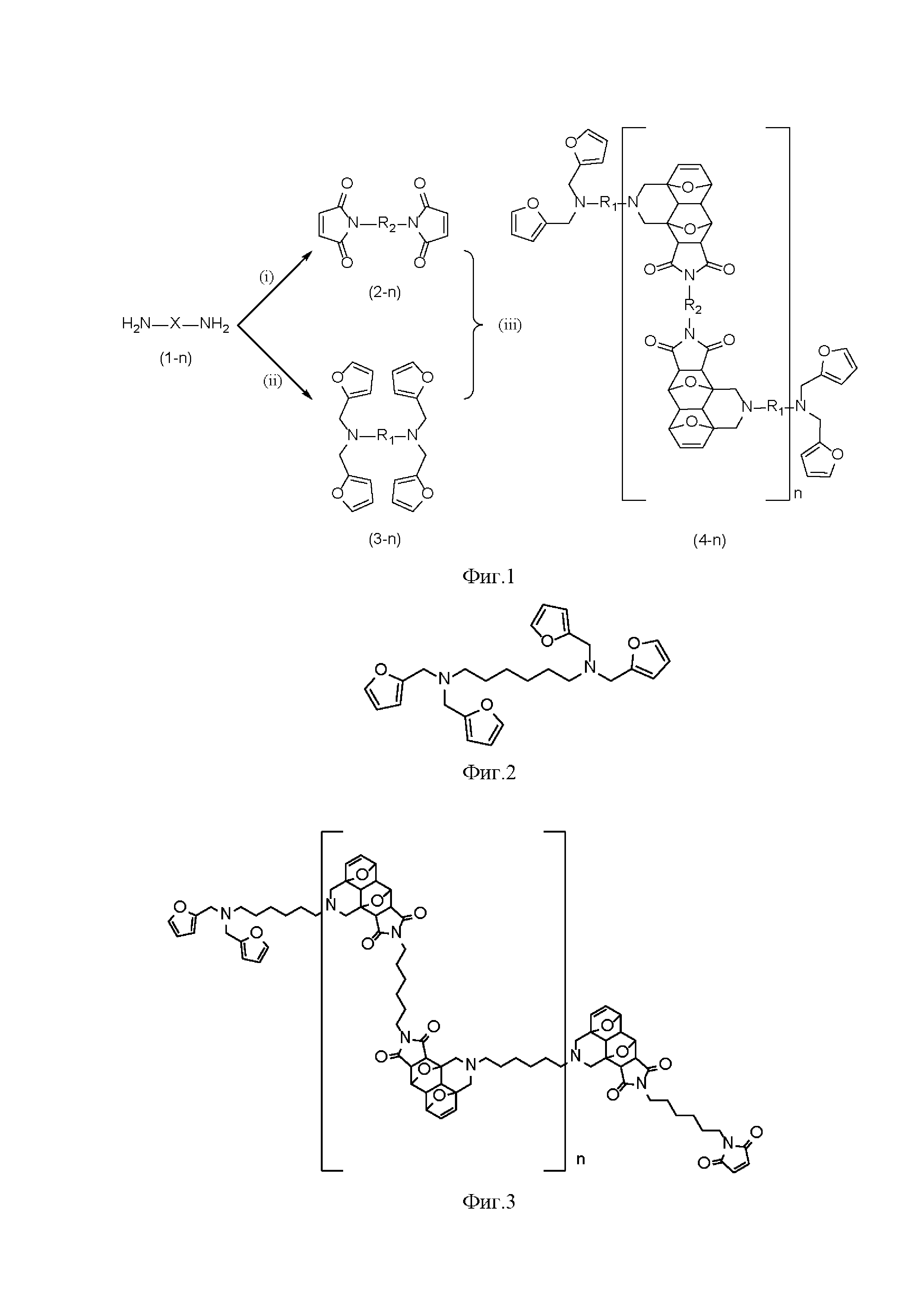
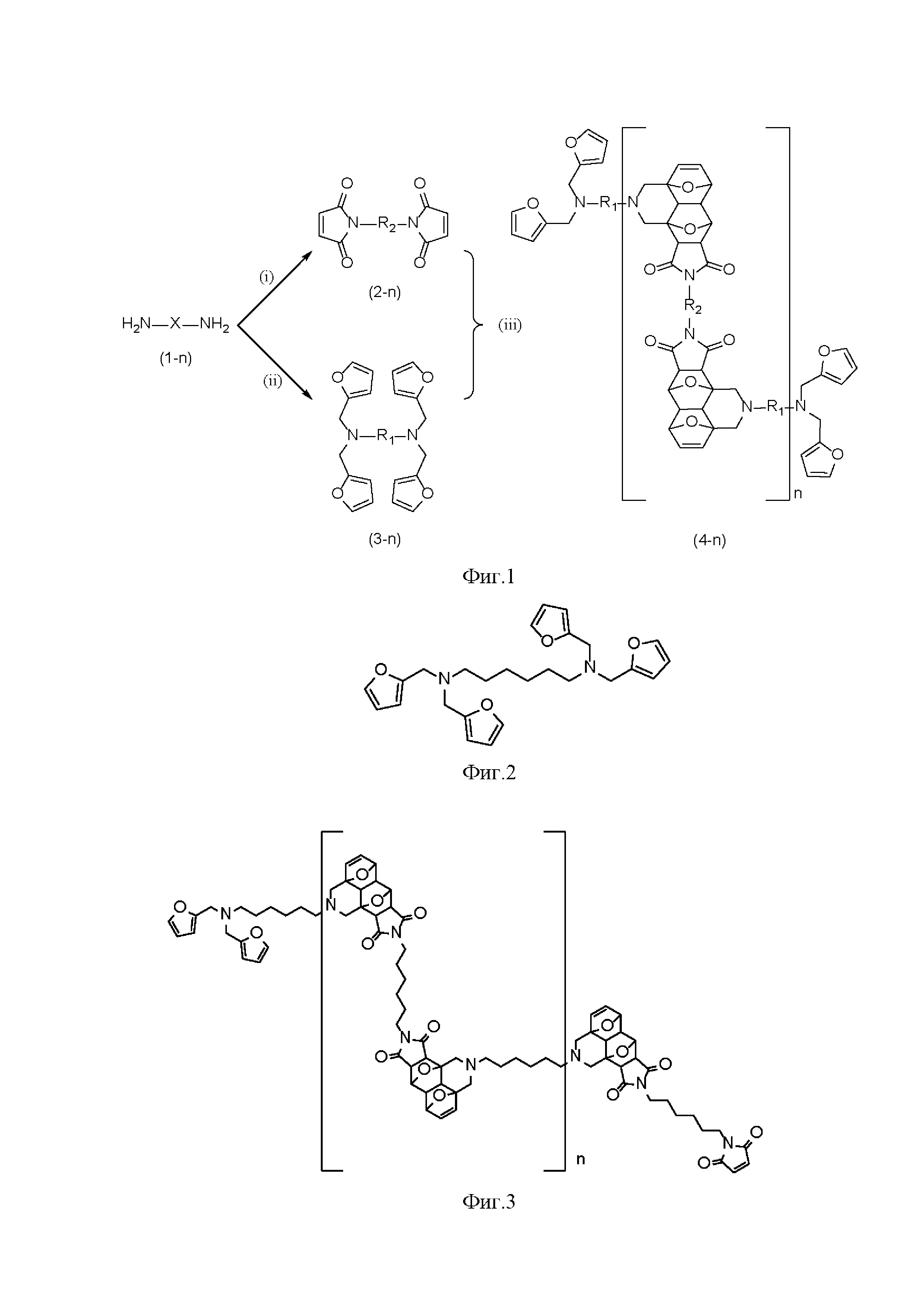
Область техники Изобретение относится к области химии высокомолекулярных соединений, а также к области органической химии и зеленой химии. Способ получения новых самовосстанавливающихся полимерных материалов повышенной теплостойкости, полученных на основе тандемной реакции Дильса-Альдера (Д-А) может найти применение для конструкционных полимерных композиционных материалов ПКМ для авиакосмической отрасли. Уровень техники Конструкционные ПКМ благодаря своей высокой прочности, разнообразию термомеханических свойств, широкому набору способов изготовления изделий в сочетании с малым весом являются превосходной заменой металлам во многих отраслях. Конструкционные ПКМ состоят из прочного наполнителя, например, угле- или стекловолокна и полимерной матрицы, прочность которой на порядки ниже, чем прочность волокна. В задачу матрицы входит фиксация взаиморасположения наполнителя, на который приходится основная нагрузка. Ключевой проблемой для конструкционных ПКМ является непредсказуемость разрушения, вызываемого механическими повреждениями, которое возникает и развивается из микродефектов матрицы. В связи с этим СВ полимерные материалы (способные «залечивать» микродефекты) являются объектом повышенного научного интереса уже на протяжении нескольких десятилетий. Самовосстановление – это процесс, в результате которого восстанавливается целостность полимерного материала и его физико-механические свойства, нарушенные в результате повреждения. Процесс самовосстановления основан на введении в структуру материала функциональных групп, способных к обратимым ковалентным взаимодействиям. Например, в роли таких структурных фрагментов могут выступать аддукты (продукты) реакции Дильса-Альдера (Д-А) (циклоприсоединения по Дильсу-Альдеру). В таком случае самовосстановление достигается благодаря последовательному проведению обратной и прямой реакции Д-А в области материала, подвергшейся повреждению. Такой метод теоретически способен обеспечить многократное восстановление. Самовосстановление должно быть инициировано внешним воздействием (подача тепла или света). Обратимая реакция Д-А между парой фуран-малеимид (в качестве терминов-аналогов «пары фуран-малеимид» также используются словосочетания: фрагменты малеимида и фурана, фурфурильный и малеимидный остатки, фурановое и малеимидное производные) - наиболее перспективная система для создания СВ полимеров, а обратимый характер реакции обеспечивает свойство самовосстановления [Guo Y. et al. Thermo-reversible MWCNTs/epoxy polymer for use in self-healing and recyclable epoxy adhesive //Chinese Journal of Polymer Science. – 2017. – Vol. 35. – N. 6. – P. 728-738]. Первые исследования в области СВ полимеров были проведены еще в конце 60-х годов прошлого века [James M. Craven, "Cross-linked thermally reversible polymers produced from condensation polymers with pendant furan groups cross-linked with maleimides", US3435003, 25 Mar. 1969]. С тех пор по настоящее время было опубликовано около ста российских и иностранных патентов, посвященных теме получения и применения самовосстанавливающихся полимерных материалов. Самыми близкими аналогами являются СВ сшитые или линейные полимерные материалы на основе классической реакции Д-А. Для сравнения СВ полимеров-аналогов с предлагаемыми материалами было предложено сопоставлять между собой температуру, при которой наиболее эффективно протекает процесс самовосстановления. Впервые аналоги предлагаемых полимерных материалов были описаны в патенте US3435003: сшитые полимерные материалы на основе полиэфиров, полиуретанов, поликарбамидов, полиимидов, полиамидов. Для получения описанных материалов предварительно были синтезированы линейные полимерные материалы с внедренными в основную цепь фурановыми остатками, а в качестве сшивающего реагента были использованы различные бисмалеимиды. Именно сшивки на основе термообратимой классической реакции Д-А придают материалу свойство самовосстановления. Автором изобретения в указанном патенте было отмечено, что обратная реакция Д-А эффективно протекает в температурном диапазоне 120-140°С. Подобный подход был также описан в ряде работ [Tian Q. et al. A thermally remendable epoxy resin //Journal of Materials Chemistry. - 2009. - Vol. 19. - N. 9. - P. 1289-1296; Bai N., Simon G. P., Saito K. Investigation of the thermal self-healing mechanism in a cross-linked epoxy system //RSC advances. - 2013. - V. 3. - №. 43. - P. 20699-20707; K. Yang, B. R. Lund, R. Smaldone, & W. Voit, "Melt-processable thermoset polymers, method of synthesis thereof and use in fused filament fabrication printing", US2018051113A1, 22 Feb., 2018]. В качестве вариации описанного подхода было представлено получение сшитого полимерного СВ материала, где предварительно получали два вида линейных полимерных материалов: модифицированные фурановыми группами и модифицированные малеимидными группами. Затем полученные линейные модифицированные полимерные материалы вводили в реакцию Д-А [Canary S. A., Stevens M. P. Thermally reversible crosslinking of polystyrene via the furan–maleimide Diels-Alder reaction //Journal of Polymer Science Part A: Polymer Chemistry. – 1992. - V. 30. - №. 8. - P. 1755-1760]. Однако, предложенный подход не привел значительному изменению термохимических свойств (T(Vmax)=140°С согласно данным дифференциальной сканирующей калориметрии (ДСК)), а кроме того, повысились время- и трудозатраты на синтез целевого материала. В патентной заявке US2004014933A1 от 2004 впервые был продемонстрирован новый подход к синтезу самовосстанавливающихся полимерных материалов и их характеристик. Была показана принципиальная возможность сшитого полимерного материала, созданного исключительно на основе классической реакции Д-А. Было показано, что материал способен выдерживать до четырех циклов самовосстановления включительно. Однако при температуре 150°С наблюдалась расшивка лишь 30% аддуктов реакции Д-А. Вероятно, именно с трудностью получения линейных полимерных СВ материалов связано малое количество публикаций на эту тему [ Gandini A. Synthesis of 2-furfurylmaleimide and preliminary study of its Diels-Alder polycondensation //Polymer Bulletin. - 1998. - V. 40. - №. 4. - P. 389-394; Iglesias N. et al. Experimental model design: exploration and optimization of customized polymerization conditions for the preparation of targeted smart materials by the Diels Alder click reaction //Polymer Chemistry. - 2019. - V. 10. - №. 40. - P. 5473-5486]. В качестве решения данной проблемы был предложен синтез СВ полимерных материалов на основе тандемной реакции Д-А (тД-А). В литературе представлены примеры тандемной реакции Дильса-Альдера для малых органических молекул, в которых второй фрагмент фурана присоединяется, как диен, к аддукту Д-А, выступающем в качестве диенофила [Borisova K. K. et al. Classical example of total kinetic and thermodynamic control: the Diels-Alder reaction between DMAD and bis-furyl dienes //The Journal of Organic Chemistry. - 2018. - V. 83. - №. 8. - P. 4840-4850; Borisova K. K. et al. Diels–Alder reactions between hexafluoro-2-butyne and bis-furyl dienes: kinetic versus thermodynamic control //Chemical Communications. - 2018. - V. 54. - №. 23. - P. 2850-2853]. Однако, самовосстанавливающиеся полимерные материалы повышенной теплостойкости до сих пор не были получены по тандемной реакции Д-А. Раскрытие изобретения Техническая задача и технический результат предлагаемого изобретения состоит в разработке способа синтеза полимерных соединений на основе тандемной реакции Д-А и, таким образом получению новых СВ полимерных материалов с расширенным температурным диапазоном эксплуатации и повышенной теплостойкости. Технический результат представлен способом получения самовосстанавливающихся полимерных материалов повышенной теплостойкости, имеющих общую структурную формулу: где фрагментами R1 и R2являются различные алифатические заместители C2-C18, полученных на основе тандемной реакции Дильса-Альдера из доступных диаминов в трехстадийном процессе. В первой стадии (i, Рис.1) получают различные бисмалеимиды с алифатическим заместителем С2-С18; синтез бисмалеимидов осуществляют посредством проведения реакции между алифатическими симметричными диаминами и избытком малеинового ангидрида в уксусной кислоте. Во второй стадии (ii, Рис.1) получают тетрафурфурильные производные с алифатическим заместителем С2-С18; получение тетрафурфурильных производных проводят с помощью реакции восстановительного аминирования, для чего алифатические диамины в количестве 1 экв. смешивают со свежеприготовленным раствором триацетоксиборгидрида натрия в количестве 8 экв. в хлористом метилене, затем к реакционной смеси прибавляют раствор фурфурола в количестве 8 экв. в хлористом метилене, реакцию проводят в присутствии молекулярных сит 4Å; степень прохождения реакции контролируют с помощью тонкослойной хроматографии (ТСХ); по окончании реакции в реакционную смесь добавляют раствор NaOH, водный раствор экстрагируют этилацетатом, органическую фазу промывают водой и высушивают над безводным MgSO4, удаляют растворитель и избыточные количества фурфурола в вакууме роторного испарителя; целевые тетрафурильные соединения выделяют в индивидуальном виде с помощью флэш-хроматографии. В третьей стадии (iii, Рис.1) проводят реакцию полимеризации между бисмалеимидными и тетрафурфурильными производными, полученными соответственно в первой и второй стадиях; для этого навеску тетрафурильного соединения в количестве 1 экв. растворяют в абсолютированном диметилацетамиде; полученный раствор помещают в колбу и продувают аргоном; в реакционную смесь добавляют 2,6-ди-трет-бутил-4-метилфенол в количестве 0.1 экв.; навеску бисмалеимида в количестве 1.2 экв. также растворяют в диметилацетамиле и по каплям в течение часа прибавляют к реакционной смеси для полимеризации смеси при 140°C в течение 24 часов; затем полимеризованную реакционную смесь охлаждают до комнатной температуры и выливают в избыток абсолютированного хлористого метилена; выпавший осадок центрифугируют, затем декантируют раствор, процедуру центрифугирования-декантации повторяют трижды; полученный осадок сушат в вакууме до 72 часов для удаления остатков растворителей. В результате получают самовосстанавливающиеся полимерные материалы повышенной теплостойкости, имеющих вышеуказанную общую структурную формулу, на основе тандемной реакции Д-А. Повышенная теплостойкость рассматриваемых полимерных материалов обусловлена тем, что максимум скорости обратной реакции Д-А для тандемных аддуктов наблюдают в диапазоне 200-250°C согласно данным дифференциальной сканирующей калориметрии (ДСК), а деградация рассматриваемых полимерных материалов при этих температурах не происходит согласно данным термогравиметрического анализа (ТГА). При этом использована тандемная реакция Д-А для получения самовосстанавливающихся полимерных материалов. То есть продукт присоединения одного эквивалента фуранового фрагмента к одному эквиваленту малеимида, далее вступает во внутримолекулярную реакцию Д-А со вторым фурфурильным остатком с образованием бис-аддукта. Введение в полимерную цепь фрагментов, созданных на основе тандемной реакции Д-А, а именно, участие внутримолекулярной реакции в данном процессе приводит к повышению температуры обратной реакции Д-А, а, соответственно, и к расширению эксплуатационного диапазона и повышению теплостойкости. Перечень рисунков Рис.1 - Общая схема получения целевых соединений с общей формулой. Рис.2 - Пример 1. Соединение 3-1. (R1 = C6). Рис.3 - Пример 2. Соединение 4-1. (R2 = C6). Рис.4 - ИК-спектры для исходного гексаметиленбисмалеимида (М), тетрафурфурильного соединения 3-1 (Ф), а также для пленки полученного полимерного образца 4-1 (Полимер). Осуществление изобретения На рис.1 представлена Общая схема получения целевых соединений с общей формулой. К созданию были предложены соединения общей формулы (Рис. 1), где R1 и R2 – это алифатические заместители C2-C18 заместители. на первой стадии (i, Рис.1) получают различные бисмалеимиды с алифатическим заместителем С2-С18; синтез бисмалеимидов осуществляют посредством проведения реакции между алифатическими симметричными диаминами в количестве 1 экв. и избытком малеинового ангидрида в уксусной кислоте; На второй стадии (ii) по реакции восстановительного аминирования были получены тетрафурфурильные производные. Для их получения алифатические диамины смешивали со свежеприготовленным раствором триацетоксиборгидрида натрия в хлористом метилене и раствором фурфурола в хлористом метилене. На один эквивалент диамина необходимо взять 8 экв. свежеприготовленного раствора триацетоксиборгидрида натрия и 8 экв. свежеперегнанного фурфурола. Использование фурфурола в менее чем 8-кратном избытке по отношению к исходному диамину приводит к низкой конверсии данной стадии химического синтеза. Для смещения равновесия реакцию проводят в присутствии молекулярных сит 4Å. Степень прохождения реакции контролируют с помощью тонкослойной хроматографии (ТСХ). По окончании реакции в реакционную смесь добавляют раствор NaOH, водный раствор экстрагируют этилацетатом, органическую фазу промывают водой, органическую фазу сушат над безводным MgSO4, удаляют растворитель и избыточные количества фурфурола в вакууме роторного испарителя. Тетрафурфурильные соединения выделяют в индивидуальном виде с помощью флэш-хроматографии в виде прозрачных или светло-желтых масел. В случае неполного прохождения реакции допускается запуск реакционной смеси в повторную процедуру восстановительного аминирования, описанную выше. На третьей стадии (iii, Рис.1) полученные тетрафурфурильные соединения и бисмалеимиды вводят в реакцию полимеризации. Полимеризация в данном случае протекает по реакции Дильса-Альдера. Однако, в данном случае реакция Дильса-Альдера называется тандемной по причине того, что продукт присоединения одного эквивалента фуранового фрагмента к одному эквиваленту малеимида, далее вступает во внутримолекулярную реакцию Дильса-Альдера со вторым фурфурильным остатком с образованием бис-аддукта. Полимеризацию проводят при 140°C в сухом диметилацетамиде в среде аргона. Для проведения полимеризации предварительно сушат растворитель путем кипячения растворителя над пятиокисью фосфора, а затем отгонкой растворителя в вакууме. Для предотвращения полимеризации бисмалеимида реакцию проводят в присутствии стабилизатора (2,6-ди-трет-бутил-4-метилфенол). Исходный тетафурфурильный мономер растворяют в диметилацетамиде, затем порционно добавляют бисмалемид – такая последовательно реагентов позволяет добиться наилучшей конверсии и массовых характеристик целевого полимерного продукта. Полимеризацию проводят 24 часа, затем реакционную смесь выливают в подходящий для высаживания целевого полимерного продукта растворитель, взятый в объеме в 10 или более раз превышающем объем реакционной смеси. С помощью длительного перемешивания и центрифугирования отделяют непрореагировавшие исходные мономеры. Далее сушат полученный образец полимерного вещества в течении до 72 часов в вакууме. В качестве растворителя для осаждения полимерного вещества были использованы хлористый метилен и метиловый спирт, также для этих целей могут быть использованы вода, диэтиловый эфир, хлороформ. Изобретение подтверждается следующими примерами: 1) Получение тетрафурфурильного соединения Пример 1. Тетрафурфурильное соединение R1 = C6 (Pис.2) Для получения триацетоксиборгидрида натрия к раствору 2.707 г боргидрида натрия в 40 мл хлористого метилена прибавили 12.222 мл уксусной кислоты. Реакционную смесь интенсивно перемешивали в течении 3 часов на ледяной бане. Затем добавили 1.033 г гексаметилендиамина и 5.896 мл фурфурола. Реакцию проводили в течении 72 часов в присутствии молекулярных сит 4Å) Степень прохождения реакции контролировали с помощью ТСХ. По окончании реакции добавили 30 мл 0.1 N раствора NaOH. Водный раствор экстрагировали три раза по 20 мл этилацетата, органическую фазу промыли 30 мл воды, высушили над безводным MgSO4, удалили растворитель в вакууме роторного испарителя. Тетрафурильное соединение с R1 = C6 было выделено с помощью флэш-хроматографии. В качестве элюента использовалась смесь этилацетат-петролейный эфир в соотношении 1:5. В результате реакции было получено тетрафурильное соединение с R1 = C6 в виде желтого масла. Выход составил 2.095 г, 54 %.1Н-ЯМР, ДМСО-д6, δ, м.д., J, Гц: 1.14 (м., 4H), 1.38 (м., 4H), 2.27-2.30 (т., J = 7.3, 4H), 3.56 (c., 4H), 6.28 (дд., J = 3.1, 4H), 6.39 (дд., J1 = 2.0, J2 = 3.2, 4H), 7.58 (дд., J1 = 0.9, J2 = 1.8, 4H);13С-ЯМР (ДМСО-д6, δ, м.д.): 26.43, 26.55, 49.25, 52.13, 108.58, 110.27, 142.30, 152.27. HRMS ESI: найдено С26H32N2O4 М+H 437.2456, рассчитано: 437.2435. 2) Получение целевого полимерного соединения Пример 2. Полимерное соединение R1= R2 = C6 (Рис.3). Навеску тетрафурфурильного соединения с R1= C6 массой 0.101 г растворили в сухом диметилацетамиде. Раствор поместили в колбу Шленка и продули аргоном. В реакционную смесь добавили 2,6-ди-трет-бутил-4-метилфенол в количестве 0.1 экв. Навеску гексаметиленбисмалеимида 0.077 г растворили в диметилацетамиле и по каплям в течении часа прибавляли к реакционной смеси. Полимеризацию проводили при 140°C в течении 24 часов. После реакционную смесь охладили до комнатной температуры и вылили в 20 мл сухого хлористого метилена. Выпавший осадок центрифугировали, затем декантировали раствор, процедуру повторили трижды. Полученный осадок сушили в вакууме 3 дня для удаления остатков растворителей. Полимерное соединение R1= R2 = C6было выделено в виде бежевого порошка. Выход составил 0.137 г, 83 %. С помощью ИК-спектроскопии показано, что в спектре целевого СВ полимерного материала R1= R2 = C6не наблюдается полос поглощения, соответствующих исходному гексаметиленбисмалеимиду (Рис.4, М), а интенсивность полос поглощения, соответствующих фурфурильным остаткам соединения (Рис.4, Ф) значительно снижается. Кроме того, о протекании реакции Дильса-Альдера свидетельствует полоса поглощения при 1771 см-1 в спектре полимерного соединения (Рис.4, Полимер). Полимерные продукты анализировали с помощью1H-ЯМР-спектроскопии. Характеристической областью в ЯМР спектрах для изомеров exo-exo-, exo-endo-, endo-endo-, endo-exo- тандемных аддуктов реакции Д-А является диапазон 4.55-4.95 м.д. Исходя из этого, спектроскопия1H-ЯМР является удобным методом мониторинга, исследования и сравнения классической и тандемной реакции Д-А. Анализ спектра1Н-ЯМР показал, во-первых, что концевые группы представляют собой остатки тетрафурфурильного фрагмента, во-вторых, продукт не содержит остатков исходных реагентов. Кроме того, анализ спектра1Н-ЯМР позволил оценить количество звеньев в полимерной цепи n≈30. С помощью ТГА показано, что разложение образца полученного полимерного материала начинается при T5%=277°С. Также были вычислены температура, при которой достигается максимальная скорость разложения Tmax=447°C, зольный остаток составил 32%. При этом, согласно ДСК-анализу, комплексный пик, соответствующий обратной реакции Д-А, находится в области 200-250°C. Таким образом, введение в структуру полимерного материала фрагментов тандемной реакции Д-А позволяет повысить температурный эксплуатационный диапазон (теплостойкость) материала. Заявленное изобретение, соответствующее общей формуле общей схемы на рис.1, отличается от известных аналогов тем, что представляет собой полимерные соединения, полученные исключительно на основе тандемной реакции Дильса-Альдера, при этом участие внутримолекулярной реакции в процессе получения таких соединений приводит к повышению температуры обратной реакции Дильса-Альдера, а, соответственно, и к расширению эксплуатационного диапазона полимерного материала. Настоящее изобретение относится к способу получения самовосстанавливающихся полимерных материалов повышенной теплостойкости, имеющих общую структурную формулу где фрагментами R1 и R2являются различные алифатические заместители C2-C18, полученных на основе тандемной реакции Дильса-Альдера из доступных диаминов в трехстадийном процессе. На первой стадии получают различные бисмалеимиды с алифатическим заместителем С2-С18. Синтез бисмалеимидов осуществляют посредством проведения реакции между алифатическими симметричными диаминами и избытком малеинового ангидрида в уксусной кислоте. На второй стадии получают тетрафурфурильные производные с алифатическим заместителем С2-С18. Получение тетрафурфурильных производных проводят с помощью реакции восстановительного аминирования. На третьей стадии проводят реакцию полимеризации между бисмалеимидными и тетрафурфурильными производными, полученными соответственно в первой и второй стадиях. Повышенная теплостойкость рассматриваемых полимерных материалов обусловлена тем, что максимум скорости обратной реакции Дильса-Альдера для тандемных аддуктов наблюдают в диапазоне 200-250°C согласно данным дифференциальной сканирующей калориметрии (ДСК), а деградация рассматриваемых полимерных материалов при этих температурах не происходит согласно данным термогравиметрического анализа (ТГА). Технический результат - получение самовосстанавливающихся полимерных материалов повышенной теплостойкости, имеющих вышеуказанную общую структурную формулу, на основе тандемной реакции Дильса-Альдера. 4 ил., 2 пр. Способ получения самовосстанавливающихся полимерных материалов повышенной теплостойкости, имеющих общую структурную формулу: где фрагментами R1 и R2являются различные алифатические заместители C2-C18, полученных на основе тандемной реакции Дильса-Альдера из доступных диаминов в трехстадийном процессе, в котором: в первой стадии получают различные бисмалеимиды с алифатическим заместителем С2-С18; синтез бисмалеимидов осуществляют посредством проведения реакции между алифатическими симметричными диаминами и избытком малеинового ангидрида в уксусной кислоте; во второй стадии получают тетрафурфурильные производные с алифатическим заместителем С2-С18; получение тетрафурфурильных производных проводят с помощью реакции восстановительного аминирования, для чего алифатические диамины смешивают со свежеприготовленным раствором триацетоксиборгидрида натрия в количестве 8 экв. в хлористом метилене, затем к реакционной смеси прибавляют раствор фурфурола в количестве 8 экв. в хлористом метилене, реакцию проводят в присутствии молекулярных сит 4Å; степень прохождения реакции контролируют с помощью тонкослойной хроматографии (ТСХ); по окончании реакции в реакционную смесь добавляют раствор NaOH, водный раствор экстрагируют этилацетатом, органическую фазу промывают водой и высушивают над безводным MgSO4, удаляют растворитель и избыточные количества фурфурола в вакууме роторного испарителя; тетрафурфурильные соединения выделяют в индивидуальном виде с помощью флэш-хроматографии; в третьей стадии проводят реакцию полимеризации между бисмалеимидными и тетрафурфурильными производными, полученными соответственно в первой и второй стадиях; для этого навеску тетрафурфурильного соединения в количестве 1 экв. растворяют в абсолютированном диметилацетамиде; полученный раствор помещают в колбу и продувают аргоном; в реакционную смесь добавляют 2,6-ди-трет-бутил-4-метилфенол в количестве 0.1 экв.; навеску бисмалеимида в количестве 1.2 экв. также растворяют в диметилацетамиле и по каплям в течение часа прибавляют к реакционной смеси для полимеризации смеси при 140°C в течение 24 часов; затем полимеризованную реакционную смесь охлаждают до комнатной температуры и выливают в избыток абсолютированного хлористого метилена; выпавший осадок центрифугируют, затем декантируют раствор, процедуру центрифугирования-декантации повторяют трижды; полученный осадок сушат в вакууме до 72 часов для удаления остатков растворителей; в результате получают самовосстанавливающиеся полимерные материалы повышенной теплостойкости, имеющих вышеуказанную общую структурную формулу, на основе тандемной реакции Дильса-Альдера, при этом повышенная теплостойкость рассматриваемых полимерных материалов обусловлена тем, что максимум скорости обратной реакции Дильса-Альдера для тандемных аддуктов наблюдают в диапазоне 200-250°C согласно данным дифференциальной сканирующей калориметрии (ДСК), а деградация рассматриваемых полимерных материалов при этих температурах не происходит, согласно данным термогравиметрического анализа (ТГА).