POLYMERIC METAL COATING
"Polymere Metallbeschichtung" Beschreibung Die Erfindung betrifft neue polymere Thiosulfate, ein Verfahren zu deren Herstellung sowie deren Anwendung zur Beschichtung von Oberflächen. Monomere Alkylthiosulfate (R-S-SO3") sind als Bunte-Salze bekannt [H. Distler, Angew. Chem. 1967, 79, 520-529] . Sie werden im allgemeinen durch Reaktion von Alkylbromiden mit Natriumthiosulfat erhalten. Die Einsatzgebiete solcher Bunte-Salze sind sehr vielfältig. So werden sie z.B. als Insektizide oder Fungizide, sowie als Strahlenschutzmittel und Farbenzusatzmittel eingesetzt. Bislang sind mit Ausnahme von Polystyrolderivaten [Tabushi et al J. Chem. Soc. Japan, Ind. Chem. Sect. 1964, 67, 478] keine polymeren Thiosulfate literaturbekannt. Ebenso sind keine Anwendungen von organischen Thiosulfaten zur Erzeugung ultradünner Schichten bekannt. Zur Erzeugung von ultradünnen Schichten auf festen hydrophoben Trägern wird die Langmuir-Blodgett-Technik [F. Embs, D. Funhoff, A. Laschewsky, U. Licht, H. Ohst, W. Prass, H. Ringsdorf, G. Wegner, R. Wehrmann Adv. Mater. 1991 , 3, 25-31 ] angewendet. Dieses Verfahren ist jedoch ausgesprochen teuer, und nur für kleine, planare Flächen geeignet. Außerdem ist dieses Vorgehen nicht für die Beschichtung von komplexeren Strukturen, wie z.B. Hohlkörpern, geeignet. Auch das Aufziehen von Polyelektrolytschichten auf geladenen Trägern [G. Decher, J. Schmitt, L. Heiliger, H.-U. Siegmund, G. Patent, Application Number P 4333107.6; G. Decher, J.-D. Hong Makromol. Chem., Macromol. Symp. 1991 , 46, 321 -327] ist bekannt, was jedoch ausschließlich auf die Beschichtung geladener Oberflächen beschränkt ist. Weiterhin ist die chemische Modifizierung reaktiver Träger und die Chemisorption von Alkylthiolen auf Metalloberflächen bekannt [L.H. Dubois, R.G. Nuzzo, Annu. Rev. Phys. Chem. 1992, 43, 437-463; R.G. Nuzzo, F.A. Fusco, D.L. Allara, J. Am. Chem. Soc. 1987, 109, 2358-
2368] . Die bekannte Chemisorption von monomeren Thiolen, z.B. Alkylthiolen, auf Edelmetall- oder Halbedelmetalloberflächen hat den Vorteil, daß dieser Vorgang sehr selektiv ist und damit eine Kontamination der Schichten durch Verunreinigungen weitgehend ausgeschlossen werden kann. Mit Alkylthiolen können zum Beispiel auf Gold 2-dimensionale kristalline Monoschichten auf einfache Weise aus Lösung aufgebracht werden. Dabei entstehen hydrophobierte Goldoberflächen. Mit Alkylthiolen mit hydrophilen Endgruppen z.B. σ-ω-Hydroxy- alkylthiolen, kann auch eine hydrophile Beschichtung erzielt werden [ R.G. Nuzzo, L.H. Dubois, D.L. Allara, J. Am. Chem. Soc. 1990, 7 72, 558-569] . Ein wesentlicher Nachteil der beschriebenen Alkylthiole ist deren geringe Löslichkeit in Wasser. Deshalb erfordern sie den Einsatz organischer Lösungsmittel, um für die Beschichtung von Metalloberflächen eingesetzt werden zu können. Weiterhin nachteilig ist, daß die mittels bekannter Alkylthiole erzeugten Schichten kristallin sind . Diese kristalline Form der Beschichtung hat mehrere Nachteile. Zum einen bilden kristalline Schichten eine sogenannte Domänenstruktur aus. Dies kann zu unvollständiger Bedeckung der Beschichtung an den Grenzflächen dieser Domänen führen. Ein weiterer Nachteil ist, daß es bei Mischungen verschiedener Alkylthiole zur Phasenseparation der Monoschichten auf Metalloberflächen kommen kann. Durch eine solche Entmischung der kristallinen Schicht werden sowohl die mechanischen, wie auch die optischen Eigenschaften einer solcher Beschichtung deutlich verschlechtert. Darüberhinaus besitzen die bekannten monomeren Alkylthiole einen ausgesprochen unangenehmen Geruch und sind zudem meistens toxisch, was einen weiteren Nachteil für den gewerblichen Einsatz dieser Verbindungen darstellt. Neben den niedermolekularen Thiolen wurden auch Thiolderivate von oligomeren Kohlenhydraten, z.B. Cyclodextrinthiole, an Gold chemisorbiert [G. Nelles, M. Weisser, R. Back, P. Wohlfart, G. Wenz, S. Mittler-Neher, J. Am. Chem. Soc. 1996, 7 75, 5039-5046] . Auch hier entstehen hydrophile Beschichtungen mit Schichtdicken von wenigen Nanometern. Nachteilig bei oligomeren und polyme- ren Thiolderivaten ist jedoch deren Tendenz unter Bildung von S - S Bindungen in Lösung zu vernetzen. Außerdem ist die Synthese der bisher beschriebenen
Cyclodextrinthiole sehr teuer und aufwendig. In der WO 88-05473 wird außerdem die Beschichtung von Metalloberflächen mittels Chemisorption von mono- oder polyfunktionellen Molekülen beschrieben. Jedoch ist keine der beschriebenen funktionellen Gruppen eine Thiol- oder Thiosulfatgruppe. Die dort beschriebenen Polymere enthalten vielmehr Halogen- alkylgrupppen oder ungesättigte Gruppen. Bei einer möglichen Nutzung dieses Verfahrens wird der Einsatz organischer Lösungsmittel empfohlen. Der vorliegenden Erfindung liegt somit die Aufgabe zugrunde, neue Verbindungen bereitzustellen, welche keinen unangenehmen Geruch, niedrige Toxizität und gegenüber den bislang bekannten Verbindungen eine erheblich verbesserte Löslichkeit in wässerigen Medien aufweisen sollen und welche amorphe, hydrophile und dichte Schichten mit hoher mechanischer Beanspruchbarkeit und chemischer Beständigkeit auf Metallen bilden sollen. Darüberhinaus sollen derartige Verbindungen die Beschichtung von Metalloberflächen erheblich umweltfreundlicher, billiger und einfacher gestalten. Diese Aufgabe wird durch die in den Ansprüchen gekennzeichneten Ausfüh- rungsformen gelöst. Insbesondere werden lösliche polymere Thiosulfate mit Struktureinheiten der allgemeinen Formeln I und/oder II bereitgestellt, worin AK eine Anhydro-Kohlenhydrateinheit bedeutet, der Rest R1 ein Wasserstoffatom, einen gerad- oder verzweigtkettigen (C C30)-Alkylrest, einen gerad-
oder verzweigtkettigen (CrC30)-AIkanoylrest, einen gerad- oder verzweigtketti- gen (C2-C30)-Alkylenoxyalkylrest, einen gerad- oder verzweigtkettigen (C2-C30)- Alkylenoxoalkylrest, einen (C2-C30)-Alkenylrest, einen (C2-C30)-Alkenoylrest, einen (C2-C30)-Alkinylrest, einen gerad- oder verzweigtkettigen (C5-C30)-Cycloalkylrest, einen substituierten oder unsubstituierten (C5-C30)-Arylrest, der ein oder mehrere Heteroatome aufweisen kann, oder einen substituierten oder unsubstituierten (C5-C30}-Aryloylrest, der ein oder mehrere Heteroatome aufweisen kann, bedeutet, wobei der Rest R1 jeweils an ein Sauerstoffatom der Anhydro-Kohlenhydrat- einheit gebunden ist und der Substitutionsgrad x 1 0, 1 ,2 oder 3 ist, der Rest R2 einen bivalenten Spacer, ausgewählt aus einem substituierten oder unsubstituierten (CT-Caol-Alkyleπrest, einem substituierten oder unsubstituierten (C^C^)- Hydroxyalkylenrest, einem substituierten oder unsubstituierten (CT -Caol-Oxoalky- lenrest, einem substituierten oder unsubstituierten (C2-C30)-Alkylenoxoalkylen- rest, einem substituierten oder unsubstituierten (C2-C30)-Alkylenoxyalkylenrest, einem substituierten oder unsubstituierten (C2-C30)-Hydroxyalkylenoxyalkylen- rest, einem substituierten oder unsubstituierten (C2-C30)-Alkylenoxyhydroxyalky- lenrest, einem (C2-C30)-Alkenylrest, einem (C2-C30)-Alkinylrest, einem substituierten oder unsubstituierten (C5-C30)-Cycloalkylenrest oder einem substituierten oder unsubstituierten (C5-C30)-Arylenrest, der einen oder mehrere Heteroatome aufweisen kann, bedeutet, wobei der Rest R2 jeweils an ein Sauerstoffatom der Anhydro-Kohlenhydrateinheit gebunden ist und der Substitutionsgrad x3 0, 1 ,2 oder 3 ist, Y eine funktioneile Gruppe, ausgewählt aus einer Nitrat-, einer Amino- desoxy-, einer substituierten oder unsubstituierten Amino-, einer Carboxyalkyl-, einer Hydroxyalkyl-, einer Sulfat-, einer Sulfonat-, einer Carbonat- oder einer Xanthogenatgruppe, bedeutet, wobei der Substitutionsgrad x2 0, 1 , 2 oder 3 ist, mit den Maßgaben, daß die Summe von x1 , x2 und x3 < 3 ist und x3 nicht über die gesamte Polymerkette gleich 0 ist, und n einen Polymerisationsgrad zwischen 1 und 10 000 bedeutet, wobei die Verknüpfung der Anhydro-Kohlenhydrat- einheiten linear, zyklisch, verzweigt oder vernetzt ist. Bei den vorgenannten Bereichsangaben für die Kohlenstoffzahl der jeweiligen Reste sind nur solche Kohlenstoffe gemeint, die nicht durch eine Doppelbindung mit Sauerstoff verbunden sind .
In einer bevorzugten Ausführungsform der vorliegenden Erfindung ist die An- hydro-Kohlenstoffeinheit AK eine Anhydroglukose-Einheit. Im Fall, daß die Reste R1 bzw. R2 einen substituierten Aryl- bzw. Aryloylrest bedeuten, können diese Reste ferner beispielsweise mit einem oder mehreren Halogenatomen, Alkylresten, Cycloalkylresten, Mono-, Di- oder Trialkylsilylre- sten, Mono-, Di- oder Triarylsilylresten oder Trifluormethylgruppen substituiert sein. Die erfindungsgemäßen polymeren Thiosulfate weisen gegenüber anderen polymeren Schwefelverbindungen eine sehr gute Löslichkeit in polaren Lösungsmitteln, insbesondere in Wasser auf. Darüberhinaus vernetzen die erfindungsgemäßen Verbindungen in Lösung nicht. Außerdem sind diese polymeren Thiosulfate praktisch geruchlos und als Polymere nicht hautdurchgängig. Ein weiterer Gegenstand der vorliegenden Erfindung ist die Bereitstellung eines Verfahrens zur Herstellung der erfindungsgemäßen polymeren Thiosulfate. Erfindungsgemäß werden dabei Tetrathionate durch eine polymeranaloge Umset- zung an ungesättigte Polymere gebunden. In einer polymeranalogen Umsetzung erfolgt dabei die Addition von Alkali- bzw. Erdalkalitetrathionaten an ungesättigte Polymere. Die ungesättigten Polymere können beispielsweise Alkenyl- oder Alkinyl-Ether oder -Ester von Polyolen sein. Mehr bevorzugt sind die ungesättigten Polymere Alkenyl- oder Alkinyl-Ether oder -Ester von Polysacchariden. Vorzugsweise ist das Polysaccharid ausgewählt aus Cellulose, Stärke, Amylose, Amylopektin, Xanthan, Guaran, Dextran, Cyclodextrinen, Pullulan, Carrageen und andere linearen, zyklischen oder verzweigten Polyglucanen, Polygalaktanen, Polymannanen sowie deren Copolymeren. In einer besonders bevorzugten Ausführungsform ist das Polysaccharid (3-Allyloxy-2-hydroxypropyl)-cellulose oder (3-Allyloxy-2-hydroxypropyl)-carboxymethylcellulose.
Die polymeranaloge Addition wird in wässeriger Lösung durchgeführt, wobei die Umsetzung bei 60-1 30°C, vorzugsweise 70-100° C, durchgeführt wird . Durch Addition von Tetrathionaten an ungesättigte Polymere können somit wasserlösliche polymere Thiosulfate hergestellt werden. Dabei entstehen Polymere, die zumindestens teilweise Struktureinheiten der vorgenannten Formeln I und/oder II enthalten (polymere Bunte-Salze) . Beispielsweise können durch Addition von Tetrathionat an Allyloxy-hydroxypropylcellulose, das aus Cellulose und Allylglycidylether (AGE) hergestellt wird, Bis-Thiosulfate-Einheiten gemäß der Formel II synthetisiert werden, wie nachstehend in Gl. 1 dargestellt ist. Cell- OH Die Addition von Tetrathionat an die Doppelbindungen läuft ohne Katalysator in wässeriger Lösung ab. Die Herstellung anderer polymerer Alkylthiosulfate erfolgt analog. So können gemäß dem gezeigten Herstellungsverfahren beispielsweise die Allylderivate des Cyclodextrins und der Cellulose in die Thiosulfatderivate überführt werden. Die Allylderivate sind auf einfache Weise durch Addition von Allylglycidylether an Cyclodextrin bzw. Cellulose zugänglich. Das erfindungsgemäße Verfahren zur Herstellung von polymeren Alkylthiosulfa- teπ zeichnet sich durch große Einfachheit und hohe Ausbeute aus. Die Produkte dieses Herstellungsverfahrens sind sehr gut wasserlöslich, desweiteren findet keine Vernetzung der Polymere durch S-S Brücken statt. Die sich aus diesen Eigenschaften ergebenden Vorteile für den möglichen Einsatz
und das mögliche Anwendungsgebiet solcher Verbindungen sind vielfältig. So können beispielsweise fest haftende Beschichtungen von nur einigen Nano- metern Dicke auf Metalle, insbesondere Edelmetalle wie Gold und Silber und auf Halbedelmetalle wie zum Beispiel Kupfer aufgebracht werden. Die Herstellung solcher Schichten kann mit den erfindungsgemäßeπ polymeren Thiosulfaten in wässeriger Lösung duchgeführt werden, also in einem Lösungsmittel, das nicht nur umweltfreundlich ist, sondern neben einem geringen Preis auch erhebliche produktionstechnische Vorteile bietet. Außerdem haben die erfindungsgemäßen polymeren Thiosulfate gegenüber monomeren Alkylthiolen den Vorteil, in einer sehr schnell ablaufenden Reaktion, sehr dichte hydrophile sowie amorphe Filme mit weitestgehend definierter Schichtdicke (wenige Nanometer) auf Metalloberflächen zu bilden. Gegenüber herkömmlichen Beschichtungsverfahren hat die erfindungsgemäße Beschichtung den Vorteil, technisch sehr einfach durchführbar zu sein und auch für beliebig geformte Körper (z.B. Innenwände von Röhren) geeignet zu sein. Die so erhaltenen Monolagen zeichnen sich durch hohe mechanische Festigkeit und große Hydrophilie aus. Dieser Umstand kann dazu genutzt werden, eine erheblich verbesserte Haftung von herkömmlichen und handelsüblichen Klebstoffen und Lacken auf Metalloberflächen zu erzielen. Weiterhin ist bekannt, daß körpereigene Proteine und verschiedene für die Thrombozyten- aggregation verantwortliche Moleküle sich an hydrophilen Oberflächen nicht oder nur in sehr geringem Maß ablagern. Deshalb kann davon ausgegangen werden, daß eine gute Bioverträglichkeit dieser Beschichtungen zu erwarten ist. Darüberhinaus können kolloidale Metallpartikel stabilisiert werden. Vorzugsweise ist das kolloidal gelöste Metall Gold, Silber, Palladium, Platin, Quecksilber oder Kupfer. Die Anwendung der erfindungsgemäßen polymeren Thiosulfate ist aber nicht nur auf Metalloberflächen beschränkt, sondern kann auch auf jede andere kationisierte- und/oder aminohaltige Oberfläche angewandt werden. Solche Oberflächen können beispielsweise Polymeroberflächen sein, wie z.B. jene von Kunststoff Implantaten. Die sich ergebenden möglichen Anwendungen dieser neuen Moleküle sind nachfolgend dargestellt:
(a) Verhinderung von Korrosion und Oxidation bei Edelmetallen, z. B. Silber (Schwarzwerden), Halbedelmetallen, z.B. Kupfer (Grünspan), Nickel. Anwendungen zur Konservierung von z. B. Sammlermünzen, Brillengestellen, Schmuck. (b) Verbesserung der Wasserbenetzbarkeit von Metalloberflächen. (c) Verbesserung der Haftung von Klebstoffen, Lacken und Verbundwerkstoffen an Metalloberflächen. (d) Stabilisierung von Metall-Kolloiden, z.B. können die polymeren Bunte- Salze als Schutzkolloid wirken. (e) Abgabe von pharmazeutischen Wirkstoffen (z.B. Enzündungshemmern), inkludiert in nach dem erfindungsgemäßen Verfahren mit Cyclodextrinen oder Amylose beschichteten Metalloberflächen. (f) Erhöhung der Biokompatibilität (z. B. Herabsetzung von Blutgerinnung und Allergien), Behandlung von Metalloberflächen für medizinische Anwendun- gen (chirurgische Instrumente, z.B. Mikrowerkzeuge, Stents, Endo-Prothe- sen, z.B. Herzklappen, Gelenkpfannen, Schrauben, Sensoren, minimalinva- sive Galvanoplastiken etc.) . (g) Verbesserung der Anknüpfung von Proteinmolekülen (z.B. Enzymen, Antikörpern, Antigenen) an Metalloberflächen und Metallkolloiden. (h) Erzeugung nanostrukturierter Polymeroberflächen durch selektive Adsorption der polymeren Bunte-Salze auf Metall-Mustern (z.B. lithographisch erzeugte nanostrukturierte Goldmuster auf Siliziumoberflächen) . (i) Immobilisierung von Metallkolloidteilchen auf festen Oberflächen. (j) Versiegelung von Metalloberflächen zur Verhinderung von Kontaktal- lergien, z.B. Nickelallergie. (k) Basisbeschichtung für das Aufbringen von anderen Polymeren, z.B. Proteinen, insbesondere Antikörper. Der Einsatz von Multischichten auf der
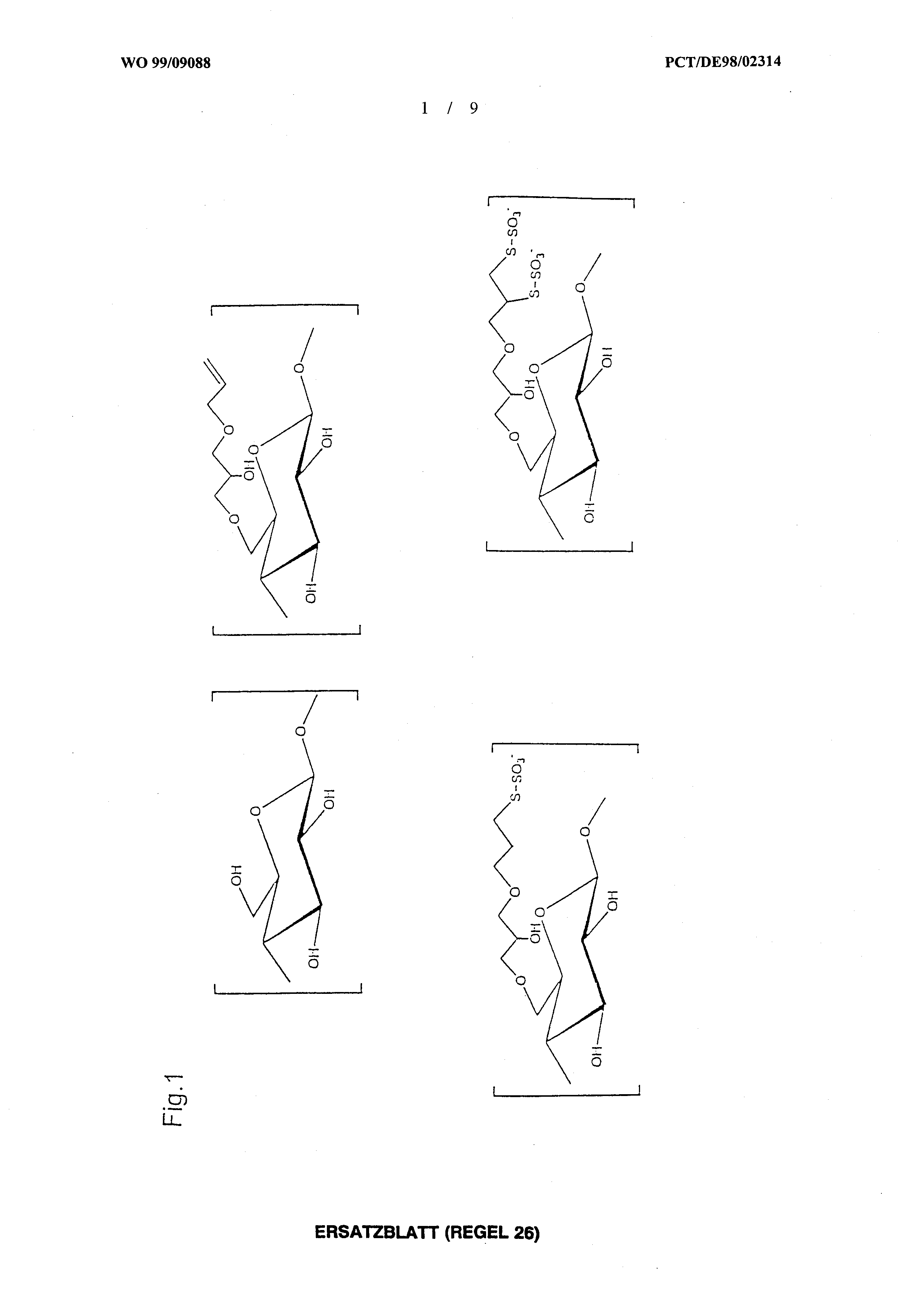
Basis der erfindungsgemäßen Beschichtung kann in der medizinischen Diagnostik eingesetzt werden. Die Bildung von Schichten, die sich aus den erfindungsgemäßen Verbindungen aufbauen, erfolgt innerhalb weniger Minuten. Darüberhinaus sind die sich bilden- den Schichten amorph und ausgesprochen dicht, und selbst bei extrem niedriger Schichtdicke mechanisch sehr beständig. Desweiteren bietet sich die Möglichkeit, diese Beschichtung weiter zu funktionalisieren und chemisch zu verändern. Die erfindungsgemäßen Schichten können als beständige und fest anhaftende Plattform für Mehrschichtbeschichtungen (z.B. für Oberflächenveredeluπg oder Anbindung von Proteinen) genutzt werden. Die Figuren zeigen: Fig. 1 : schematische Darstellung von Struktureinheiten, die in einem erfindungs- gemäßen polymeren Thiosulfat gemäß Beispiel 1 vorhanden sein können. Fig. 2: Spektren von (3-Allyloxy-2-hydroxypropyl)-cellulose (a) ^-NMR und (b)13C-DEPT-NMR. Fig. 3: Spektren von (3-Thiosulfatopropyl-oxy-2-hydroxypropyl)-cellulose (a)1 H- NMR und (b)13C-DEPT-NMR. Fig.4: FT-IR-Spektren von (a) (3-Thiosulfatopropyl-oxy-2-hydroxypropyl)-cellulo- se-Pulver und (b) ultradünner Schicht von (3-Thiosulfatopropyl-oxy-2-hydroxy- propyO-celluiose auf Gold. Fig. 5: XPS-Messungen von (3-Thiosulfatopropyl-oxy-2-hydroxypropyl)-cellulose auf (a) Siliziumwafer und (b) Goldoberfläche. Fig. 6: Adsorptionsisotherme von TSHP-cellulose bei Raumtemperatur auf (a) Gold und (b) Silber. Die vorliegende Erfindung wird durch die nachstehenden Beispiele näher erläutert.
Beispiel 1: Synthese von (3-Thiosulfatopropyl-oxy-2-hydroxypropγl)-cellulose im folgenden TSHP-cellulose genannt Zuerst wird Cellulose zu (3-Allyloxy-2-hydroxypropyl)-cellulose umgesetzt. In einem zweiten Schritt wird durch Additionsreaktion von Tetrathionat an die Allyl- Gruppe TSHP-cellulose hergestellt, s. Fig. 1. a) Darstellung der (3-Allyloxy-2-hydroxypropyl)-cellulose 5,0 g (30,7 mmol) mikrokristalline Cellulose werden in 90 ml 25%iger NaOH Lösung 48 Stunden gerührt und anschließend mit weiteren 90 ml Wasser verdünnt. Man gibt 35,4 g (310 mmol) Allylglycidylether (Aldrich) zu und läßt zuerst 2 Stunden bei Raumtemperatur und danach noch weitere 6 Tage bei 60°C rühren. Nach Abkühlung wird diese Lösung mit konz. Salzsäure neutralisiert. Die wäßrige Lösung wird durch kontinuierliche Ultrafiltration gegen eine UF-PA-5 Membran (Hoechst-Kalle) gereinigt, bis 1000 ml Permeat entstehen. Das Retenat wird gefriergetrocknet. Die Ausbeute beträgt 3,15g (79.5%) eines weißen Feststoffes. Strukturnachweise: 1H-NMR (D2O) : ό = 5,76 (m, 1H, H-e), 5,08-5,20 (m, 2H, H-f), 4,34 (s, 1H, C-1), 3,89 (s, H-d), 3,82 (m, 2H, H-5,H-4), 3,45-3,17 (m, 9H, H-a H-b H-c H-3,2 H-6); s. Fig.2a. 13C-DEPT-NMR (DMSO-d6) : δ = 135,3 (C-e), 116,3 (C-f), 102,8 (C-1), 80,3 (C- 4), 74,7 (C-3, C-5, C-2), 73,0-71,7 (C-a, C-d, C-c), 68,5 (C-b), 60,2 (C-6); s. Fig.2b. IR : 3399s, 2871s, 1644m, 1419w, 1369w, 1316w, 1250w, 1066s, 932w cm'1 Elementaranalyse : berechnet für {[C6H10O5]03[C12H20O7]07}n (n = 200) C: 43,48 H: 7,66, gefunden C: 43,39 H: 6,46
b) Synthese von (3-Thiosulfatopropyl-oxy-2-hydroxypropyl)-cellulose - im folgenden TSHP-cellulose genannt. 1g (7.75 mmol) (3-Allyloxy-2-hydroxypropyl)-cellulose, wie vorstehend her- gestellt, und 3,18g Kaliumtetrathionat (Aldrich) werden in 100 ml H2O gerührt und unter Rückfluß auf 100° C erwärmt. Nach 2 Tagen wird die gelbliche Lösung abgekühlt und durch einen Nylonfilter mit einer Porenweite von 0,45 μm filtriert. Das Filtrat wird durch kontinuierliche Ultrafiltration gegen eine UF-PA-5 Membran (Hoechst-Kalle) gereinigt, bis 1000 ml Permeat entstanden sind. Das Retentat wird gefriergetrocknet. Die Ausbeute beträgt 0,44g (34,1%) eines weißen Feststoffes. Strukturnachweise: 1H-NMR (D2O) : δ = 5,76 (m, 1H, H-e), 5,08-5,20 (m, 2H, H-f), 4,34 (s, 1 H, C-1 ), 3,89 (s, H-d), 3,82 (m, 2H, H-5,H-4), 3,45-3,17 (m, 9H, H-a, H-b, H-c, H-3, H-2, H-6), 1,91 (m,1H, H-f), 1,28 (m, 1H, H-e'); s. Fig.3a. 13C-DEPT-IMMR (DMSO-d6) : δ = 135,3 (C-e'), 116,3 (C-f).102,8 (C-1), 80,3 (C-4), 74,7 (C-3, C-5, C-2), 73,0-71,7 (C-a, C-d, C-c), 68,5 (C-b), 60,2 (C-6); s. Fig.3b. IR : 3399s, 2871s, 1644m, 1419w, 1369w, 1316w, 1250w, 1198m, 1017m, 932w, 601s, 408m cm"1; s. Fig.4a. Elementaranalyse : berechnet für {[C6H10O5]03[C12H19O13S4]01[C12H20O7]06}n (n = 200) ; C: 41.65 H: 6.72 S: 4.35 gefunden C: 41.1 H: 6.35 S: 4.57 Die polymergebundenen Thiosulfat-Gruppen wurden durch die charakteristischen IR-Banden (1250, 1017 and 601 cm"1), durch Elementaranalyse und durch XPS Messungen (Fig. 5) nachgewiesen.
Beispiel 2: Synthese von (3-Thiosulfatopropyl-oxy-2-hydroxypropyl-carboxy- methylcellulose - im folgenden TSHP-CMC genannt. a) Darstellung von (3-Allyloxy-2-hydroxypropyl)-carboxymethylcellulose 1 ,0 g (4, 1 3 mmol) Carboxymethylcellulose ( Mw 250.000, DS = 0,9) werden in 10 ml 25 %iger NaOH Lösung gelöst und mit 30 ml H2O verdünnt. Nach 4 Stunden gibt man 9,62 g (84,3 mmol) Allylglycidylether (Aldrich) zu und rührt 2 Stunden bei Raumtemperatur und weitere 3 Tage bei 60°C. Nach Abkühlung wird die wässerigen Lösung durch kontinuierliche Ultrafiltration gegen eine UF- PA-5 (Hoechst-Kalle) Membran gereinigt, bis 1 000 ml Permeat entstanden. Das Reteπat wird gefriergetrocknet. Die Ausbeute beträgt 1 ,4 g (50 %) eines weißen Feststoffes. Strukturnachweise: 'H-NMR (D2O) : δ = 5,76 (m, 1 H, H-e), 5,08-5,20 (m, 2H, H-f), 4,34 (s, 1 H, C-1 ), 3,90 (s 2H, -CH2-) 3,89 (s, H-d), 3,82 (m, 2H, H-5,H-4), 3,45-3, 1 7 (m, 9H, H-a, H-b, H-c, H-3, H-2, H-6) . 13C-DEPT-NMR (D2O) : δ = 1 77,4 (C = O) , 1 36,7 (C-e), 1 21 , 1 (C-f), 1 04,4 (C- 1 ), 84,4 (C-2), 80,6 (C-4), 75,8 (C-a, C-d, C-c), 74,7 (C-5), 73,9 (-CH2-), 71 ,7 (C-3, C-b), 65,9 (C-6) . IR : 3271 s, 2884s, 1 729s, 1 596m, 1 426w, 1 325w, 1 250-950w, 932w cm'1 b) Synthese von TSHP-CMC 0,2 g (0,6 mmol) (3-Allyloxy-2-hydroxypropyl)-carboxymethylcellulose werden in 90 ml H2O gerührt. Nach 2 Stunden werden 1 , 190 g (3,94 mmol) Kaliumtetrathionat gelöst in 20 ml H2O zugegeben und dann unter Rückfluß auf 90°C
erwärmt. Nach 2 Tagen wird die gelbliche Lösung abgekühlt und filtriert. Die Filtrat wird durch kontinuierliche Ultrafiltration gegen eine UF-PA-5 Membran (Hoechst-Kalle) gereinigt, bis 1000 ml Permeat entstanden. Das Retenat wird gefriergetrocknet. Die Ausbeute beträgt 0, 67g (45 %) eines weißen Feststoffes. Strukturnachweise:1H-NMR (D2O) : δ = 5,76 (m, 1 H, H-e), 5,08-5,20 (m, 2H, H-f), 4, 34 (s, 1 H, C-1 ), 3,90 (s 2H, -CH2-) 3,89 (s, H-d), 3,82 (m, 2H, H-5,H-4), 3.45-3.1 7 (m, 9H, H-a, H-b, H-c, H-3, H-2, H-6) . 13C-DEPT-NMR (D20) : δ = 1 77,4 (C = O), 1 36,7 (C-e), 1 21 , 1 (C-f), 1 04,4 (C- 1 ), 85, 6 (C-2), 81 ,7 (C-4), 75,8 (C-a, C-d, C-c), 78,6 (C-5), 73,9 (-CH2-) , 77,3 (C-3, C-b), 72,3 (C-g), 65,9 (C-f ), 63.6 (C-6) . IR : 3271 s, 2884s, 1 729s, 1 596m, 1 426w, 1 325w, 1 1 92w, 1062w, 932w, 61 5m cm'1. Nachfolgend wird der grundsätzliche Wirkungsmechanismus der Verbindung als Beschichtungsmaterial erklärt, sowie durch mehrere Beispiele weiter ausgeführt. Die Ausführung von Beschichtungen mittels der polymeren Thiosulfate ist sehr einfach, da sie aus wässeriger Lösung erfolgt. Die Metalloberflächen werden in eine wässerige Lösung, z.B von TSHP-cellulose, für einige Minuten eingetaucht oder mit dieser besprüht (s. Beisp. 3) . Die Methode ist auch für gekrümmte schwerzugängliche Oberflächen (z. B. Schläuche, Röhren) geeignet. Die so erhaltenen Schichtdicken (Bereich 4,0 - 5,0 nm) sind gut reproduzierbar und können genau kontrolliert werden. Schon bei sehr niedrigen Konzentrationen werden dichte Schichten mit reproduzierbarer Dicke erhalten. Die Haftung des polymeren Alkylthiosulfates an den Metalloberflächen ist sehr gut. Die Stabilität der Schicht kann durch nachfolgendes Beschichten mit einem Polykation weiter erhöht werden, da die Polyelektrolyt-Wechselwirkung zu einer physikalischen Vernetzung führt.
Dieses Beschichtungsverfahren kann durch die folgenden Annahmen plausibel gemacht werden. Zuerst wird die;S-S Bindung der Thiosulfonat-Gruppen unter Bildung von Thiol- S» und Sulfit- -SO3- Radikalen homolytisch gespalten. Das Metall, vorzugsweise Gold, wird vom Thiolradikal oxidiert, wobei die S-[Me] Bindung entsteht (Gl. 2) . Das Sulfitradikal »SO3- dimerisiert wahrscheinlich zu Dithionit (Gl. 3). R-S-SO3 - + Au° → R-S Au+ +»SO3- (2) 2»S03- → S2O62- (3) Dieser Mechanismus wurde durch XPS-Messungen (Fig. 5) bestätigt. Während (3-Thiosulfatopropyl-oxy-2-hydroxypropyl)-celiulose auf Silizium (Fig. 5a) XPS Signale bei 1 63, 5 eV für Sulfid und 1 68,5 eV für Sulfonat zeigt, erhält man für (3-Thiosulfatopropyl-oxy-2-hydroxypropyl)-cellulose auf Gold (Fig. 5b) nur ein Signal bei 1 62, 5 eV für Sulfid . Die Chemisorption ist irreversibel. Nach der Beschichtung kann man die beschichteten Proben in reinem Wasser einlagern, ohne Desorption von 3-Thiosulfatopropyl-oxy-2-hydroxypropyl)-cellulose. Beispiel 3: Beschichtung von Gold mittels TSHP Als Substrate wurden planare Glas- oder Siliziumträger verwendet, auf welche Gold aufgedampft wurde (thermisches Aufdampfen bei ~ 4 x 10'5 mbar) . Die Goldschichten waren im Durchschnitt 500 Ä dick. Die Substrate werden in eine 0, 1 Gew%-ige wässerige Lösung von TSHP-cellulose (gemäß Beispiel 1 hergestellt) bei Raumtemperatur eingetaucht und eine Stunde stehengelassen. Anschließend werden sie mehrmals in Wasser gespült und im N2-Strom getrocknet.
Nach der Beschichtung der Goldsubstrate mit TSHP wird der fortschreitende (advancing) Kontaktwinkel, bzw. ein rückziehender (receeding) Kontaktwinkel [Adamson, A. Physical Chemistry of Surfaces 4th. ed .; John Wiley & Sons: New York, 1 982], von 50° ± 3° , bzw, von 1 6° ± 2° für Wassertropfen gemessen. Das unbeschichtete Goldsubstrat hat für Wassertropfen einen fortschreitenden Kontaktwinkel, bzw. einen rückziehenden (receeding) Kontaktwinkel, von 90 ° ± 2 ° , bzw. 55° ± 2° . Das Adsorptionsverhalten von TSHP-cellulose aus wässeriger Lösung auf Goldoberflächen wurde für verschiedene Adsorptionszeiten und Ausgangskonzentrationen (0,2 - 3,0 mg/ml) untersucht (s. Fig. 6a) . Die Schichtdicke von Substraten, die sowohl nur fünf Minuten, als auch 24 Stunden in der wässerigen Lösung von TSHP-cellulose eingetaucht wurden, weisen ähnliche Werte auf. Die Schichtdicke der chemisorbierten TSHP-cellulose auf Gold wurde an Luft mittels Null-Ellipsometrie [R.M. Azzam, N.M. Bashara, Ellipsometry and Polarized Light; North Holland Publication: Amsterdam, 1 979] bestimmt. Sie beträgt im Mittel 4,5 ± 0, 5 nm. Die adsorbierte Menge wurde nach dem Produkt Schichtdik- ke-Dichte berechnet. Für TSHP-cellulose wurde die Dichte als 1 ,5 g/cm3 genom- men [Brandrup, J . ; Immergut, E.H . Polymer Handbook, 3rd . ed . ; John Wiley & Sons: New York, 1 989] . Die Chemisorption von TSHP-cellulose auf Goldoberflächen wurde mittels FT-IR Messungen nachgewiesen. Dünne TSHP-cellulose-Schichten auf Gold und TSHP- cellulose-Pulver zeigen die gleichen charakteristischen Absorptionsbanden: im Frequenzbereich von 3400-3200 cm-1 (OH-Gruppe), 2930-2850 cm'1 (CH-, CH2 Gruppen), 1 374 cm"1 (C-OH- Gruppe), 1 250-1 500 cm"1 (CH-, C-O-C Gruppen) und 1 1 99 cm'1 (C-C -Gruppe) (s. Fig. 4b) .
Beispiel 4: Beschichtung von TSHP-cellulose Schichten auf Gold mit Proteinen TSHP-cellulose-Schichten auf Gold gemäß Beispiel 2 wurden für 24 Stunden in eine wässerige Lösung von bovine serum albumin (BSA) bzw. Fibrinogen (Kon- zentration = 1 ,0 mg/ml) bei 25° C eingetaucht. Danach werden die Proben mit Wasser gespült und getrocknet. Mittels Null-Ellipsometrie wurde eine Zunahme der Schichtdicke für BSA von 0,4 nm und für Fibrinogen von 1 ,4 nm gemessen. Im Vergleich zu anderen Materialien, wie z.B. Glas oder hydrophobisiertem Glas [M. Malmstrem, J. Colloid Interface Sei. 1994, 166, 333-342], sind diese erreichten Schichtdicken sehr klein. Beispiel 5: Beschichtung von Silberoberflächen mit TSHP-cellulose Die verwendeten Substrate wurden durch Aufdampfung von Silber (thermische Aufdampfung bei ~ 4 x 10"5 mbar) auf planaren Siliziumträgern hergestellt. Die Ag-Schichten waren im Durchschnitt 500 Ä dick. Die Substrate werden in eine wässerige Lösung von TSHP-cellulose (gemäß Beispiel 1 hergestellt) bei Raumtemperatur eingetaucht und eine Stunde stehengelassen. Anschließend werden sie mehrmals mit Wasser gespült und im N2-Strom getrocknet. Um die Dichtig- keit der Oberfläche zu überprüfen, wurden die beschichteten Siliziumträger über einen Zeitraum von 1 1 Stunden bei Raumtemperatur mit einer Vergleichsprobe einer Schwefelwasserstoffatmosphäre ausgesetzt. Hierbei zeigte sich, daß die mit den erfindungsgemäßen polymeren Thiosulfaten beschichteten Substrate keinerlei Verfärbung aufwiesen. Das Adsorptionsverhalten von TSHP-cellulose aus wässerigen Lösungen auf Silberoberflächen wurde für verschiedene Adsorptionszeiten und Ausgangskonzentrationen (0,2 - 3,0 mg/ml) untersucht (s. Fig. 6b). Die Schichtdicke der chemisorbierten TSHP-cellulose auf Silber wurde an Luft mittels Null-Ellipsome- trie [R.M. Azzam, N.M. Bashara, Ellipsometry and Polarized Light; North Holland Publication: Amsterdam, 1 979] bestimmt. Sie beträgt im Mittel 4,0 ± 0,5 nm.
Die adsorbierte Menge wurde nach dem Produkt Schichtdicke-Dichte berechnet. Für TSHP-cellulose wurde die Dichte als 1 .5 g/cm3 genommen [Brandrup, J.; Immergut, E.H. Polymer Handbook, 3rd . ed .; John Wiley & Sons: New York, 1989]. Beispiel 6: Beschichtung von Goldoberflächen mit TSHP-CMC Eine 500 Ä Goldschicht wurde auf einen Si-wafer thermisch aufgedampft (4,0 1 0"5 mbar) und in eine wässerige Lösung von TSHP-CMC (gemäß Beispiel 5 hergestellt) eingetaucht. Unabhängig von den Ausgangskonzentrationen (0, 2 - 2,0 mg/ml) der TSHP-CMC beträgt die Schichtdicke der chemisorbierten TSHP- CMC auf Gold, bestimmt mittels Null-Ellipsometrie [R.M. Azzam, N .M. Bashara, Ellipsometry and Polarized Light; North Holland Publication: Amsterdam, 1 979], im Durchschnitt 3,0 nm ± 0, 5 nm. Der fortschreitende (advancing) Kontaktwinkel, bzw. ein rückziehender (receeding) Kontaktwinkel [Adamson, A. Physical Chemistry of Surfaces 4th. ed .; John Wiley & Sons: New York, 1 982], war von 40° ± 3° bzw. von 1 5° ± 2° , gemessen für Wassertropfen. Das unbeschichtete Goldsubstrat hat für Wasser- tropfen einen fortschreitenden Kontaktwinkel bzw. einen rückziehenden (receeding) Kontaktwinkel von 90° ± 2° bzw. 55° ± 2° .
The invention relates to water-soluble polymeric thiosulfates, a method for the production thereof by polymer-analog addition of tetrathionate to the unsaturated polymers and to their use
in surface coating. Ansprüche Lösliche polymere Thiosulfate mit Struktureinheiten der allgemeinen For¬ meln I und/oder II , worin AK eine Anhydro-Kohlenhydrateinheit bedeutet, der Rest R1 ein Wasserstoffatom, einen gerad- oder verzweigtkettigen (C1-C30)-Alkylrest, einen gerad- oder verzweigtkettigen (CT-C^-Alkanoylrest, einen gerad- oder verzweigtkettigen (C2-C30)-Alkylenoxyalkylrest, einen gerad- oder verzweigtkettigen (C2-C30)-Alkylenoxoalkylrest, einen (C2-C30)-Alkenylrest, einen (C2-C30)-Alkenoylrest, einen (C2-C30)-Alkinylrest, einen gerad- oder verzweigtkettigen (C5-C30)-Cycloalkylrest, einen substituierten oder unsub¬ stituierten (C5-C30)-Arylrest, der ein oder mehrere Heteroatome aufweisen kann, oder einen substituierten oder unsubstituierten (C5-C30)-Aryloylrest, der ein oder mehrere Heteroatome aufweisen kann, bedeutet, wobei der Rest R1 jeweils an ein Sauerstoffatom der Anhydro-Kohlenhydrateinheit gebunden ist und der Substitutioπsgrad x1 0, 1 ,2 oder 3 ist, der Rest R2 einen bivalenten Spacer, ausgewählt aus einem substituierten oder unsub¬ stituierten (CrC30)-Alkylenrest, einem substituierten oder unsubstituierten (d-C30)-Hydroxyalkylenrest, einem substituierten oder unsubstituierten (CT-Caol-Oxoalkylenrest, einem substituierten oder unsubstituierten (C2- C30)-Alkylenoxoalkylenrest, einem substituierten oder unsubstituierten (C2- C30) -Alkyleπoxyalkylenrest, einem substituierten oder unsubstituierten (C2-
C30)-Hydroxyalkylenoxyalkylenrest, einem substituierten oder unsubstituierten (C2-C30)-Alkylenoxyhydroxyalkylenrest, einem (C2-C30)-Alkenylrest, einem (C2-C30)-Alkinylrest, einem substituierten oder unsubstituierten (C5- C30)-Cycloalkylenrest oder einem substituierten oder unsubstituierten (C5- C30)-Arylenrest, der einen oder mehrere Heteroatome aufweisen kann, bedeutet, wobei der Rest R2 jeweils an ein Sauerstoffatom der Anhydro- Kohlenhydrateinheit gebunden ist und der Substitutionsgrad x3 0, 1 ,2 oder 3 ist, Y eine funktionelle Gruppe, ausgewählt aus einer Nitrat-, einer Aminodesoxy-, einer substituierten oder unsubstituierten Amino-, einer Carboxyalkyl-, einer Hydroxyalkyl-, einer Sulfat-, einer Sulfonat-, einer Carbonat- oder einer Xanthogenatgruppe, bedeutet, wobei der Substitutionsgrad x2 0, 1 ,2 oder 3 ist, mit den Maßgaben, daß die Summe von x1 , x2 und x3 ≤ 3 ist und x3 nicht über die gesamte Polymerkette gleich 0 ist, und n einen Polymerisationsgrad zwischen 1 und 10 000 bedeutet, wobei die Verknüpfung der Anhydro-Kohlenhydrateinheiten linear, zyklisch, verzweigt oder vernetzt ist. 2. Polymere Thiosulfate nach Anspruch 1 , wobei die Anhydro-Kohlenstoffein- heit AK eine Anhydroglucose-Einheit bedeutet. 3. Verfahren zur Herstellung von polymeren Thiosulfaten nach Anspruch 1 oder 2, worin Tetrathionate durch eine polymeranaloge Reaktion an ungesättigte Polymere gebunden werden. 4. Verfahren zur Herstellung von polymeren Thiosulfaten nach Anspruch 3, worin in einer polymeranalogen Reaktion die Addition von Alkali- bzw. Erdalkalitetrathionaten an ungesättigte Polymere durchgeführt wird . 5. Verfahren zur Herstellung von polymeren Thiosulfaten nach Anspruch 3 oder 4, wobei die ungesättigten Polymere Alkenyl- oder Alkinyl-Ether oder -Ester von Polyolen sind.
6. Verfahren zur Herstellung von polymeren Thiosulfaten nach einem der vorhergehenden Ansprüche 3 bis 5, wobei die ungesättigten Polymere Alkenyl- oder Alkinyl-Ether oder -Ester von Polysacchariden sind. 7. Verfahren zur Herstellung von polymeren Thiosulfaten nach Anspruch 6, wobei das Polysaccharid ausgewählt ist aus Cellulose, Stärke, Amylose, Amylopektin, Xanthan, Guaran, Dextran, Cyclodextrinen, Pullulan, Carrageen und andere linearen, zyklischen oder verzweigten Polyglucanen, Polygalaktanen, Polymannanen sowie deren Copolymeren. 8. Verfahren zur Herstellung von polymeren Thiosulfaten nach einem der vorhergehenden Ansprüche 3 bis 7, wobei das ungesättigte Polymer (3- Allyloxy-2-hydroxypropyl)-celluiose oder (3-Allyloxy-2-hydroxypropyD- carboxymethylcellulose ist. 9. Verfahren zur Herstellung von polymeren Thiosulfaten nach einem der vorhergehenden Ansprüche 3 bis 8, worin die polymeranaloge Addition in wässeriger Lösung durchgeführt wird. 10. Verfahren zur Herstellung von polymeren Thiosulfaten nach einem der vorhergehenden Ansprüche 3 bis 9, worin die polymeranaloge Addition von Tetrathionaten an ungesättigte Polymere bei 60-1 30°C durchgeführt wird. 1 1 . Verfahren zur Herstellung von polymeren Thiosulfaten nach Anspruch 10, worin die polymeranaloge Addition von Tetrathionaten an ungesättigte Polymere bei 70-100°C durchgeführt wird . 1 2. Verfahren zur ultradünnen Beschichtung von Metalloberflächen, worin Legierungen, Edel- und Halbedelmetalle durch Eintauchen derselben in wässerige und/oder alkoholische Lösungen von polymeren Thiosulfaten
nach Anspruch 1 oder 2 beschichtet werden. 1 3. Metallkolloide, welche mindestens ein kolloidal gelöstes Metall und mindestens ein polymeres Thiosulfat nach Anspruch 1 oder 2 enthalten. 1 4. Metallkolloid nach Anspruch 1 3, wobei das kolloidal gelöste Metall Gold, Silber, Palladium, Platin, Quecksilber oder Kupfer ist. 1 5. Oberflächen, welche kationisch und/oder aminohaltig sind und mit polyme- ren Thiosulfaten nach Anspruch 1 oder 2 beschichtet sind. 1 6. Oberflächen nach Anspruch 1 5, wobei an den Oberflächen Proteine, Enzyme, Antikörper, Antigene, pharmazeutische Wirkstoffe oder radioaktive Isotope mittels Adsorption oder kovalenter Anknüpfung gebunden sind. 1 7. Oberflächen nach Anspruch 1 5 oder 1 6, wobei die Oberflächen Polymeroberflächen sind . 1 8. Metalloberflächen, beschichtet mit polymeren Thiosulfaten nach Anspruch 1 oder 2. 1 9. Metalloberflächen nach Anspruch 1 8, wobei an den Oberflächen Proteine, Enzyme, Antikörper, Antigene, pharmazeutische Wirkstoffe oder radio- aktive Isotope mittels Adsorption oder kovalenter Anknüpfung gebunden sind. 20. Multischichtsysteme, welche aus einer beschichteten Oberfläche, wie in einem der Ansprüche 1 5 bis 1 9 definiert, bestehen und eine Abfolge entgegengesetzt geladener Polyelektrolytschichten aufweisen.
21 . Verfahren zur ultradünnen Beschichtung von Polymeroberflächen mit polymeren Thiosulfaten nach Anspruch 1 oder 2 durch Eintauchen der Oberflächen in wässerige und/oder alkoholische Lösungen von mindestens einem der polymeren Thiosulfate. 22. Verfahren zur ultradünnen Beschichtung von nanostrukturierten Metalloberflächen mit polymeren Thiosulfaten nach Anspruch 1 oder 2, wobei Legierungen, Edel- und Halbedelmetalle durch Eintauchen derselben in wässerige und/oder alkoholische Lösungen von mindestens einem der polymeren Thiosulfate beschichtet werden.