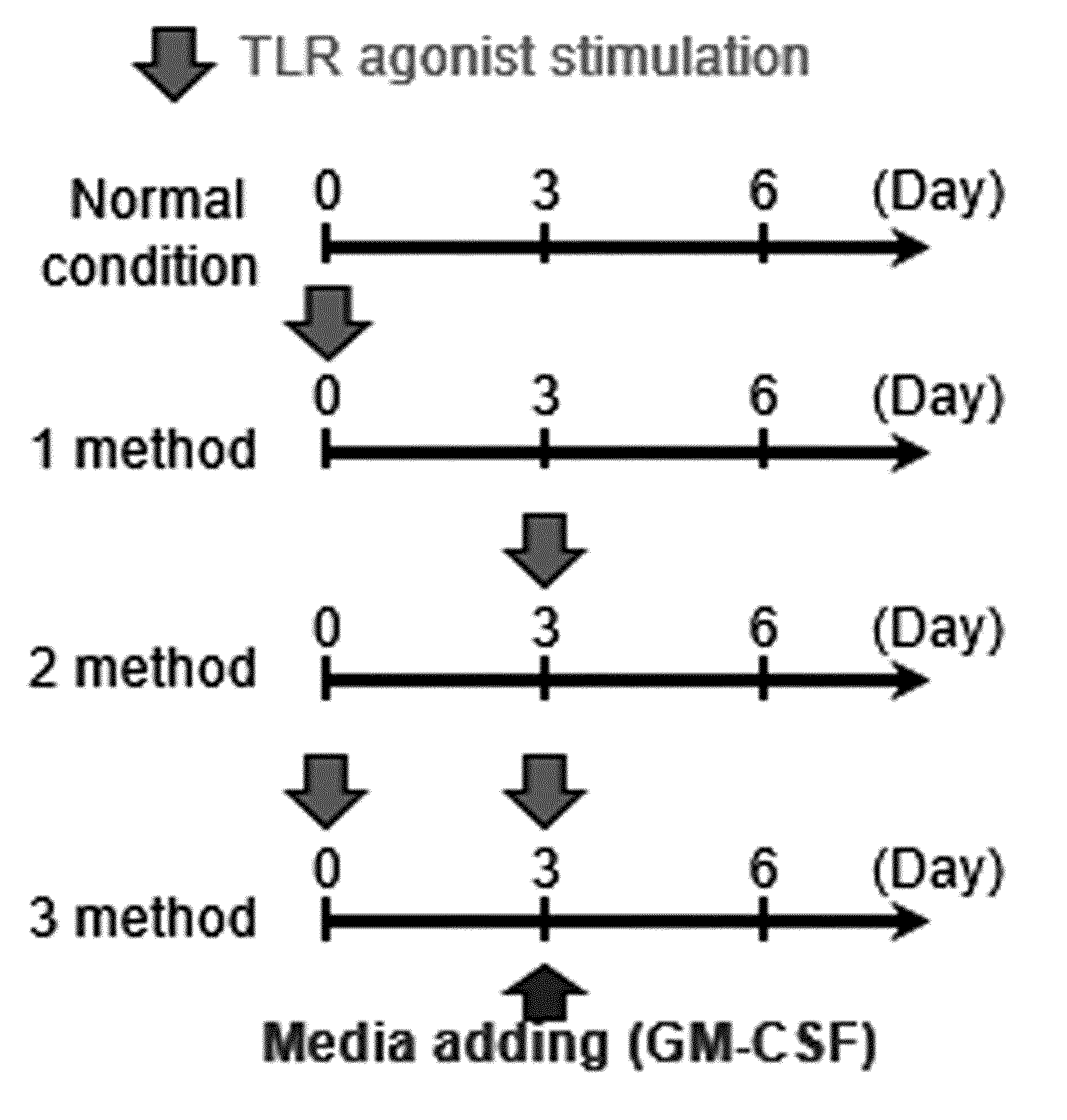
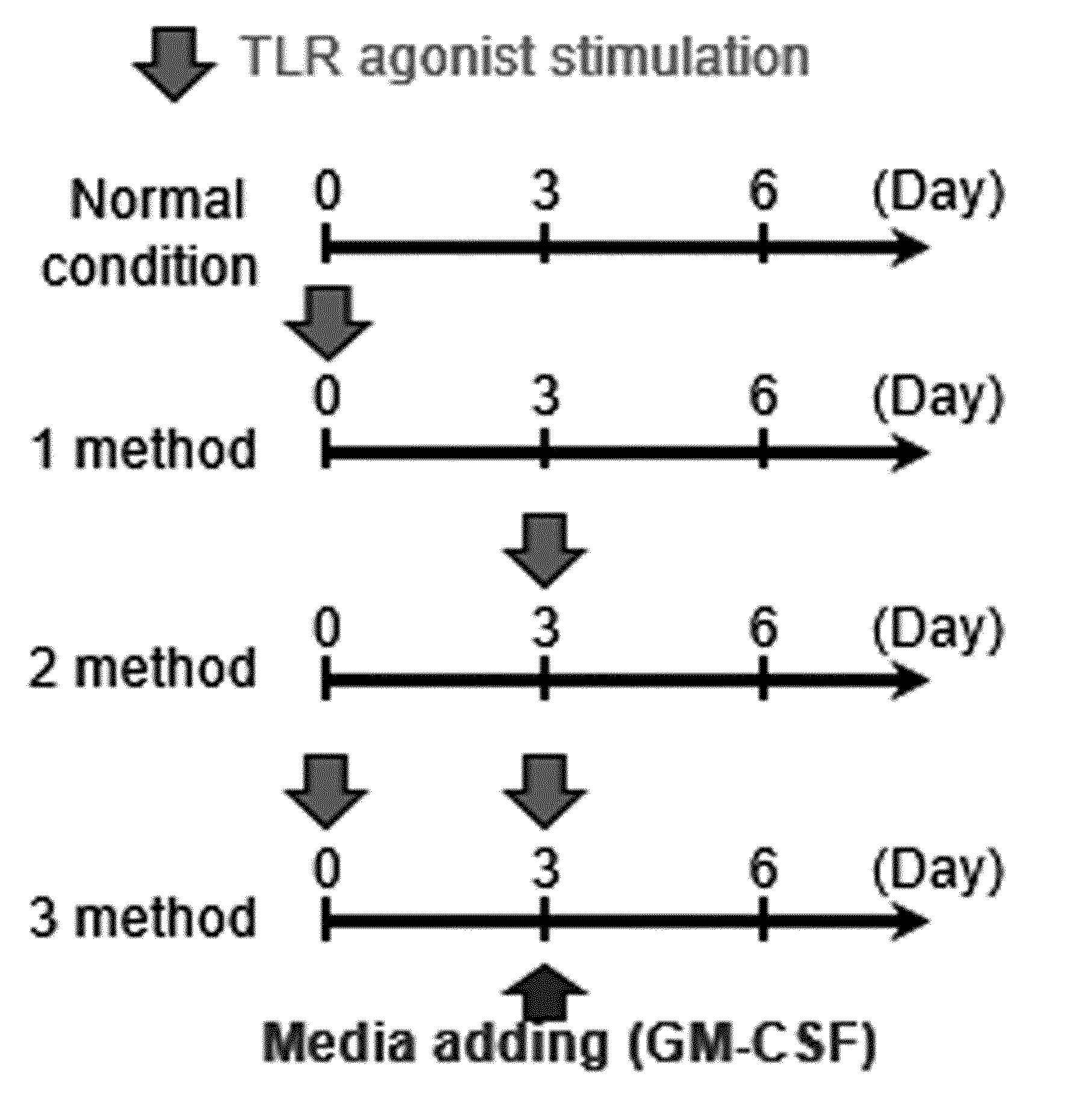
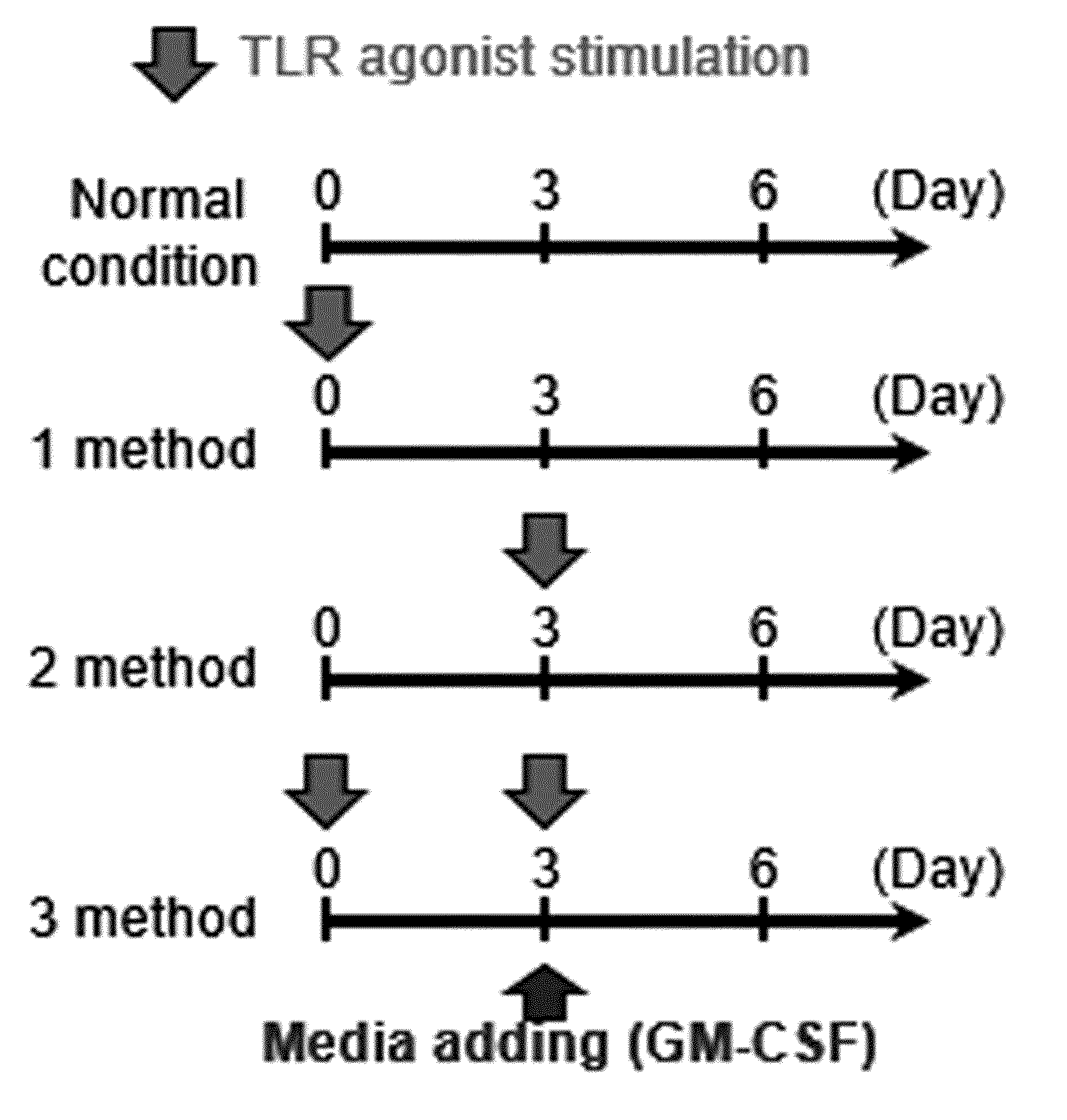
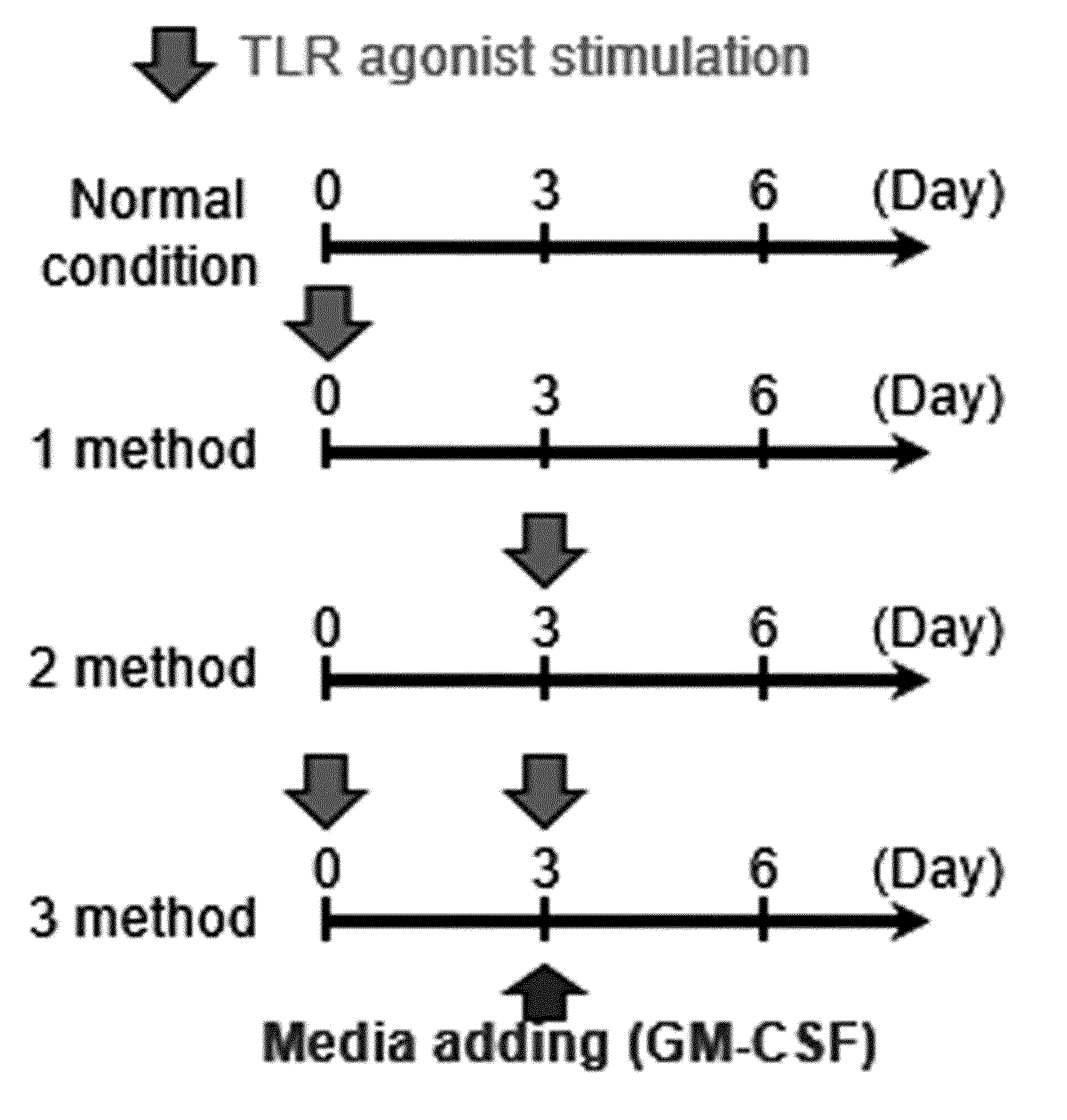
METHOD FOR PRODUCING MYELOID-DERIVED SUPPRESSOR CELLS, MYELOID-DERIVED SUPPRESSOR CELLS PRODUCED THEREBY, AND USES THEREOF
본 발명은 골수유래 면역반응 억제세포의 제조방법, 이에 의해 제조된 골수유래 면역반응 억제세포 및 그 용도에 관한 것이다. 또한, 본 발명은 수지상 세포의 제조방법, 이에 의해 제조된 수지상 세포 및 그 용도에 관한 것이다. 골수유래 면역반응 억제세포(myeloid-derived suppressor cells; MDSCs)는 20년 전에 암을 유발시킨 동물 모델에서 증가된다고 보고되었으며, 암의 진행 및 전이에 영향을 준다고 알려졌다. 최근 이들 세포들은 면역 반응에서 기능적으로 중요한 역할을 한다고 평가되어 왔다. 암세포에 의해 유도되는 면역 억제 기전 중 하나는 암에 의한 골수(myeloid) 계열의 CD11b+Gr-1+ 표현형을 갖는 세포인 골수유래 면역반응 억제세포의 증가이다. MDSCs는 미성숙한 골수계 세포로 종양이나, 자가면역질환, 감염에서 과립구 등이 완전히 분화가 이루어지지 않아 미성숙한 상태로 존재한다. 이들 MDSCs는 암 환자뿐만 아니라 급성 염증 질환, 외상, 패혈증, 기생충 및 진균 감염에서도 증가한다고 알려져 있다. 상기한 MDSCs의 기능은 활성화된 T 세포를 효과적으로 억제하는 역할을 한다. MDSCs가 T 세포를 조절하는 기전은 산화질소 합성효소(nitric oxide synthase)와 활성 산소종(reactive oxygen species; ROS), 그리고 아르기나제(arginase)라는 효소가 필수아미노산인 L-아르기닌(L-arginine)의 대사를 극대화함으로써 T 세포 활성을 억제한다고 알려져 있다. 즉, 필수아미노산인 아르기닌(arginine)을 소비하는 효소인 아르기나제-1(arginase-1)을 높은 수준으로 발현하여 주변의 아르기닌의 농도를 효과적으로 낮춘다. 아르기닌이 낮은 수준으로 존재하면 면역 세포인 T 세포가 제 기능을 하지 못하게 되며, 아르기닌에 의존하는 효소인 iNOS가 면역기능에 중요한 매개물인 산화질소(Nitric oxide, NO)를 더이상 만들지 못하게 될 뿐만 아니라 면역을 억제하는 강력한 독성 산화성물질인 과산화질소(NO2)가 만들어져 대식세포와 다른 세포계에서 세포막인지질에 산화성 손상을 야기한다. 따라서, 아르기나제와 NOS 활성화를 통해 T 림프구의 증식을 억제하고 ROS의 형성을 통해 T 림프구의 기능을 억제한다고 알려져 있다. MDSCs는 공통적으로 세포 표면 항원인 CD11b와 Gr-1을 발현하지만, 그 발현 정도가 차이가 있는 이형 개체군(heterogeneous population)의 집합이다. Gr-1은 Ly-6G와 Ly-6C라는 2개의 항원 결정기를 가지며, 이로 인해 CD11b+Ly-6G+Ly-6Clow를 가지는 과립형인 MDSCs와 CD11b+Ly-6G-Ly-6Chi를 가지는 단구 형태인 MDSCs로 나뉜다. 암 환자의 경우 과립형인 MDSCs가 70~80%, 단구 형태인 MDSCs가 20~30%를 차지한다고 알려져 있다. 두 개의 MDSCs는 다른 억제 기전으로 T 세포를 억제시킨다. 과립형인 MDSCs는 ROS의 발현이 높게 나타나고 단구 형태의 MDSCs는 NO의 생성이 높게 나타난다. 최근 연구에서는 MDSCs가 암세포나 바이러스에 감염된 세포를 죽이는 면역기능에 중요한 CD8 T 세포의 기능을 억제한다고 보고되었으며, 염증 반응 및 패혈증 질환에서도 MDSCs가 증가하여 면역억제기능을 나타낸다고 보고되었다. 하지만 이들 세포의 세포학적 특성 및 세포분화유도 기전에 관한 연구는 미비한 실정이다. 한편, 수지상 세포(dendritic cell)는 강력한 항원제시세포(professional antigen presenting cells; APC)로 체내 면역 유도 및 면역 조절에 중요한 역할을 담당한다. 인체 내의 수지상 세포는 전체 백혈구의 0.3%에 불과하지만 항원과 접한 적이 없는 원시 T 세포(naive T cell)를 활성화시켜 일차면역반응(primary immune response)을 유도할 수 있으며, 항원특이적인 후천성 기억 면역을 유도할 수 있는 면역 세포이다. 수지상 세포가 강력한 항원제시세포로서 역할을 할 수 있는 것은 세포 표면에 조직적합항원(MHC; major histocompatibility complex I/II) 뿐만 아니라, CD80 및 CD86와 같은 보조자극인자(co-stimulatory molecules)와 ICAM-1와 같은 세포 부착 분자(adhesion molecule)가 높이 발현되어 있고 T 세포 활성화 관련 다양한 사이토카인(cytokine; 인터페론, IL-12, IL-18 등)을 다량 분비하기 때문이다. 이와 같이, 수지상 세포가 항원 특이적인 T 세포 활성을 효과적으로 유도 혹은 조절할 수 있기 때문에 오랫동안 암 또는 난치성 면역 질환의 치료제로 사용 가능성이 연구되어 왔다. 조직 또는 혈액에서 직접 분리한 수지상 세포나, 단핵구에서 분화시킨 수지상 세포를 항원으로 감작시킨 후 성숙화된 수지상 세포를 체내에 다시 주입하면, 강력한 항원 특이적 세포독성임파구(CTL; cytotoxic T lymphocyte)를 유도한다는 사실이 밝혀짐으로써, 암 또는 감염성 질환의 치료용 백신으로서 개발 가능성이 오래 전부터 검토되어왔다(Inaba, K. et al., 3. Exp. Med., 178:479, 1993; Inaba, K. et al., Int. Rev.Immunol., 6:197, 1990; Hsu, F. et al., Nature Med., 2:52, 1996). 이러한 초기 연구 결과를 바탕으로 암 치료용 수지상 세포 치료제의 임상 연구가 전 세계적으로 활발하게 진행되고 있으며 다양한 암종에서 결과가 보고되고는 있으나, 아직은 단독 치료요법으로는 임상적 효과가 기대에 못 미치는 실정이다. 수지상 세포 치료제가 아직까지 성공하지 못하고 있는 가장 중요한 이유는 종양세포의 낮은 면역 원성과 암세포가 분비하는 면역억제물질에 기인한 것으로 알려져 있다. 이 경우 수지상 세포가 보다 강력한 항암 면역을 유도하여 종양세포의 낮은 면역 원성을 극복하고 종양세포의 면역 억제능을 뛰어넘을 수 있는 항암 면역을 유도할 수 있다면 치료 효과를 크게 향상시킬 수 있다. 본 발명의 일 목적은 골수 세포로부터 면역 관용성(tolerogenic) 골수유래 면역반응 억제세포(myeloid-derived suppressor cells; MDSCs)를 제조하는 방법을 제공하고자 한다. 본 발명의 다른 목적은 본 발명에서 제조된 면역 관용성 골수유래 면역반응 억제세포를 포함하는 면역 질환의 예방 또는 치료용 조성물을 제공하고자 한다. 본 발명의 또 다른 목적은 면역원성 수지상 세포(dendritic cells, DC)를 유도할 수 있는 골수유래 면역반응 억제세포(myeloid-derived suppressor cells, MDSCs)를 제조하는 방법을 제공하고자 한다. 본 발명의 또 다른 목적은 미접촉 T 세포(naive T cell)를 Th1 세포로 분화를 유도할 수 있는 면역원성 수지상 세포를 제조하는 방법을 제공하고자 한다. 본 발명의 또 다른 목적은 본 발명에서 제조된 수지상 세포를 포함하는 면역 치료제, 항종양 백신 또는 종양 치료용 약학적 조성물을 제공하고자 한다. 본 발명의 다른 목적 및 이점은 하기의 발명의 상세한 설명, 청구범위 및 도면에 의해 보다 명확하게 된다. 톨 유사 수용체 작용제(toll-like receptor agonist, TLR agonist)를 이용한 면역 관용성(tolerogenic) 단핵구 골수유래 면역반응 억제세포(monocytic myeloid-derived suppressor cells, M-MDSCs)의 유도 본 발명의 발명자들은 골수 세포(bone marrow cells)에 톨 유사 수용체 작용제(toll-like receptor agonist, TLR agonist)를 처리하는 경우, 성장인자를 처리하여도 추가적인 분화가 이루어지지 않는 안정적인 면역 관용성(tolerogenic) 단핵구 골수유래 면역반응 억제세포(monocytic myeloid-derived suppressor cells, M-MDSCs)가 유도되는 것을 발견하여 본 발명에 이르게 되었다. 본 발명의 일 구현 예에 따르면, 골수 세포에 톨 유사 수용체 작용제(toll-like receptor agonist, TLR agonist)를 처리하여 골수유래 면역반응 억제세포(myeloid-derived suppressor cells, MDSCs)로 분화를 유도하는 단계를 포함하는, 골수유래 면역반응 억제세포의 제조 방법에 관한 것이다. 본 명세서에서 용어, "톨 유사 수용체 작용제(toll-like receptor agonist)"는 병원체(pathogen) 유래 보존된 분자적 물질로, PAMPs(Pathogen associated molecular patterns)일 수 있다. 여기서, 상기 병원체로는 그람-양성 박테리움, 그람-음성 박테리움, 균류 또는 바이러스가 될 수 있다. 또한, 상기 톨 유사 수용체 작용제는 손상되거나 또는 죽은 세포로부터 방출되는 내인성(endogenous) 분자들로, DAMPs(Damage associated molecular patterns)일 수 있다. PAMPs 또는 DAMPs는 TLR 신호를 통해 면역 응답을 개시하고 신호를 전달하기 위해 세포의 세포질 내에서 어댑터 분자들을 모으게 된다. 상기 톨 유사 수용체 작용제는 프래그먼트, 변종, 아나로그, 호모로지(homology) 또는 톨 유사 수용체와 결합하고 NF-κB 활동의 활성화와 같은, TLR-중재에 의한 활성화를 유도하는 PAMPs 또는 DAMPs의 유도체가 될 수 있다. 상기 톨 유사 수용체 작용제인 프래그먼트, 변종, 아나로그, 호모로그 또는 유도체는 TLR 효능제의 아미노산의 최소한 30~99% 동일하며 톨 유사 수용체-중재에 의한 활성화를 유도하게 된다. 본 발명에서 상기 골수 세포에 처리되는 톨 유사 수용체 작용제로는 세포 막(plasma membrane)에 존재하는 톨 유사 수용체(exogenous Toll like receptor)의 작용제로, 톨 유사 수용체 2의 작용제 및 톨 유사 수용체 4의 작용제 중 1종 이상인 것이 본 발명에서 목적하는 특성을 갖는 안정적인 면역 관용성 골수유래 면역반응 억제세포의 분화 유도를 위하여 바람직하다. 단, 본 발명에서 상기 골수 세포에 세포 내부, 특히 엔도리소좀 기관(endolysosomal compartment)에 존재하는 톨 유사 수용체(intracellular Toll like receptor)로, 예를 들어 톨 유사 수용체 7의 작용제 및 톨 유사 수용체 9의 작용제 중 1종 이상을 처리하는 경우, 인터루킨 6(interleukin 6)를 함께 처리함으로써 본 발명에서 목적하는 안정적인 면역 관용성 골수유래 면역반응 억제세포의 분화를 유도할 수 있다. 본 명세서에서 용어, "톨 유사 수용체 2(TLR2)"는 단구, 대식세포, 호중구 등의 세포 표면에 위치하며 세균의 균체 성분(지방다당, 펩티도글리칸, 지방 세포 단백질, 항산균 당지질 등) 및 열충격 단백질(hsp)의 수용체의 기능을 하는 물질을 의미한다. TLR2가 자극되면 세포는 활성화되어 염증성 사이토카인 및 염증 매개체(TNF, IL-1, IL-6, IL-8, NO 등)의 생성이 촉진된다. 본 발명에서 상기 톨 유사 수용체 2의 작용제는 그람 양성균(Gram-positive bacteria)의 펩티도글리칸 또는 리포테이코산(lipoteichoic acid); 마이코박테리아(Mycobacteria)의 리포아라비노마난(lipoarabinomannan; LAM); 마이코플라즈마(Mycoplasma)의 리포펩타이드; 곰팡이 유래 지모산(Zymosan), 글루쿠로녹실로만난(Glucuronoxylomannan), 또는 포스포리포만난(Phospholipomannan); 나이세리아(Neisseria)의 포린; 렙토스피라(Leptospira)의 지질다당류; 바이글리칸(biglycan); 카복시알킬피롤(carboxyalkylpyrrole); 엔도플라즈민(endoplasmin); HMGB1(high mobility group box-1 protein); HSP60; HSP70; 인간 심장 마이오신(human cardiac myosin); 히알루로난(hyaluronan); 모노소디움 우레이트 결정(monosodium urate crystals); PAUF (pancreatic adenocarcinoma upregulated factor); 베르시칸(versican); 및 Pam3CSK4;로 이루어진 군에서 선택된 1종 이상일 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 사용되는 톨 유사 수용체 2 작용제로는 상기 열거한 종류로 특별히 제한되지 않으며, 톨 유사 수용체 2에 결합하여 톨 유사 수용체 2의 면역 반응을 자극하는 것이라면 제한없이 사용될 수 있다. 본 명세서에서 용어, "톨 유사 수용체 4(TLR4)"는 TLR 패밀리에서 처음으로 규명된 수용체로서, MyD88(myeloid differentiation 88)-의존 신호전달 과정 및 MyD88-비의존 신호전달 과정을 통해 증폭되는 선천적 면역 시그널링을 활성화시킨다. 톨 유사 수용체 4의 작용제에 의해 활성화된 톨 유사 수용체 4는 MyD88-의존 신호전달 과정을 통해 NFκB(nuclear factor kappa-light-chain-enhancer of activated B cells)의 초기 활성화 및 핵으로의 이동을 유도하고, MAPKs(mitogen-activated protein kinases)의 활성화를 유도한다. 상기 NFκB와 MAPKs의 활성화는 TNF-α(tumor necrosis factor α), IL-1β(interleukin 1β) 및 IL-6(interleukin 6)와 같은 염증성 사이토카인을 분비시킨다. MyD88-비의존 신호전달 과정은 트램/트리프(TRAM/TRIF), 인터페론-조절자(IRFs; interferon-regulatory factors) 및 NFκB의 활성화에 의해 유도되어 타입 1 인터페론을 분비시킨다. 본 발명에서 상기 톨 유사 수용체 4의 작용제는 그람 음성균(Gram-negative bacteria)의 지질다당류(lipopolysaccharide); 칸디다 알비칸스(Candida albicans)의 만난(mannan); RSV(Rous sarcoma virus) 또는 MMTV(Mouse mammary tumor virus)의 외피 단백질; 트리파노소마(Trypanosoma)의 글리코이노시톨포스포리피드(Glycoinositolphospholipids); 바이글리칸(biglycan); CD138; α-크리스탈린 A 체인(α-crystallin A chain); β-디펜신 2(β-defensin 2); 엔도플라즈민(endoplasmin); 피브리노겐(fibrinogen); 피브로넥틴(fibronectin); 헤파란 설페이트(heparan sulphate); HMGB1; HSP22; HSP60; HSP70; HSP72; 히알루로난(hyaluronan); 모노소디움 우레이트 결정(monosodium urate crystals); 산화된 포스포리피드(oxidized phospholipids, OxPAPC); PAUF(pancreatic adenocarcinoma upregulated factor); 페록시레독신 1(peroxiredoxin 1, Prx1); 레시스틴(resistin); S100 단백질(S100 proteins); 혈청 아밀로이드 A3(serum amyloid A3); 탁솔/파클리탁셀(Taxol/paclitaxel); 지질 A(lipid A); 및 MPL(Monophosphoryl lipid A);로 이루어진 군에서 선택된 1종 이상일 수 있으나, 이에 제한되는 것은 아니다. 본 명세서에서 용어, "톨 유사 수용체 7(TLR7)"은 선천 면역(innate immune)의 감지 체계를 구성하는 인자 가운데 하나로, TLR7 단백질은 세포막(cellular membrane)에 묻혀 있으면서 특정 자극에만 반응한다. 일단 특정 자극을 통해 TLR7이 활성을 획득하고 나면 면역계의 방어 기작을 가동시키는 경로가 본격적으로 작동하기 시작한다. 상기 TLR7의 주요 작용제는 이미퀴모드(imiquimod)로, 이는 TLR7의 활성 자극을 유도하는 생화학 제제이다. 1997년 2월 27일 미국 FDA 의 승인을 받은 면역 항진 제제로 항바이러스제로 사용되며 주로 피부 외용으로 사용되고 있다. 본 발명에서 상기 톨 유사 수용체 7의 작용제는 이미퀴모드, 이미다조퀴놀린(imidazoquinolines), GS-9620, GSK-2245035, 레시퀴모드(resiquimod), DSR-6434, DSP-3025, IMO-4200, MCT-465, 3M-051, SB-9922, 3M-052, 림톱(rimtop), TMX-30X, TMX-202 RG-7863, RG-7795, R848, 7-티아-8-옥소구아노신(7-thia-8-oxoguanosine), 7-데아자구아노신(7-deazaguanosine), 7-알릴-8-옥소구아노신(7-allyl-8-oxoguanosine) 및 7-데자구아노신(7-dezaguanosine)으로 이루어진 군에서 선택된 1종 이상일 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 톨 유사 수용체 7 작용제로는 미국 특허출원공개 제2012-0294885호, 국제 특허출원공개 제2012-066335호, 국제 특허출원공개 제2012-066336호, 국제 특허출원공개 제2015-168279호 및 국제 특허출원공개 제2015-168269호 등에 기술된 다양한 톨 유사 수용체 7 작용제를 제한없이 사용할 수 있다. 하지만, 본 발명에서 사용되는 톨 유사 수용체 7 작용제로는 상기 열거한 종류로 특별히 제한되지 않으며, 톨 유사 수용체 7에 결합하고 TLR7 면역 반응을 자극하는 것이라면 제한없이 사용될 수 있다. 본 명세서에서 용어, "톨 유사 수용체 9(TLR9)"은 병원균 인식 및 선천적인 면역성의 활성화에서 근본적인 역할을 하는 톨-유사 수용체(TLR) 계열의 단백질을 지칭하며, B 세포, 단핵구, 큰포식 세포 및 형질세포성 수지상 세포의 엔도솜 구획에서 주로 발견된다(문헌[Galluzzi et al., OncoImmunology, 1:5, (2012) 699-716)). 상기 TLR9의 주요 작용제는 비메틸화된 CpG 올리고데옥시뉴클레오티드의 상승된 빈도에 대한 포유동물 대응물이 상이한 세균/바이러스 DNA이다. CpG 올리고데옥시뉴클레오티드(또는 CpG ODN)는 시티딘 트라이포스페이트 데옥시뉴클레오티드("C") 및 이어서 구아니딘 트라이포스페이트 데옥시뉴클레오티드("G")를 함유하는 짧은 단일-가닥 합성 DNA 분자이다. "p"는, 일부 ODN이 변형된 포스포로티오에이트(PS) 골격을 갖더라도, 연속적인 뉴클레오티드 사이의 포스포다이에스터 연결기를 지칭한다. 이들 CpG 모티프가 비메틸화된 경우, 톨 유사 수용체 9에 결합하고 TLR9 면역 반응을 자극한다 (문헌[Weiner, GJ; et al, PNAS 94 (1997) 10833-7]). 본 발명에서 상기 톨 유사 수용체 9의 작용제는 비메틸화된 시토신-포스페이트-구아노신(CpG) 모티프를 포함하는 올리고데옥시뉴클레오티드(CpG ODN)일 수 있지만, 이의 다양한 변형체 또한 포함할 수 있다. 본 발명에서 상기 톨 유사 수용체 9 작용제로는 CpG, C*pG, CpG*, 및 C*pG*로 구성된 군으로부터 선택된 모티프를 포함하는 올리고데옥시뉴클레오티드일 수 있고, 바람직하게는 CpG 모티프를 포함하는 올리고데옥시뉴클레오티드일 수 있다. 여기서 상기 C는 2'-데옥시시티딘이고, C*은 이의 유사체이며, G는 2'-데옥시구아노신이고, G*은 이의 유사체이며, p는 포스포디에스테르, 포스포로티오에이트, 및 포스포로디티오에이트로 구성된 군에서 선택된 뉴클레오사이드간 연결기일 수 있다. 본 발명에서 상기 C*은 2'-데옥시티미딘, 아라비노시티딘, 2'-데옥시티미딘, 2'-데옥시-2'-치환된아라비노시티딘, 2'-O-치환된아라비노시티딘, 2'-데옥시-5-하이드록시시티딘, 2'-데옥시-N4-알킬-시티딘, 2'-데옥시-4-티오우리딘으로 구성된 군으로부터 선택될 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 G*은 2' 데옥시-7-데아자구아노신, 2'-데옥시-6-티오구아노신, 아라비노구아노신, 2'-데옥시-2'치환된-아라비노구아노신, 2'-O-치환된-아라비노구아노신, 2'-데옥시이노신일 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 CpG ODN은 면역-자극성 활성이 상이한 클래스 A(또는 "D"), B(또는 "K") 및 C로 분류될 수 있다(문헌[Krug A. et al., 2001, Eur J Immunol, 31(7): 2154-63]). 클래스 A CpG ODN은 자연살해세포의 강한 자극제이고 pDCs으로부터 알파-인터페론의 분비를 유도하며, 클래스 B CpG ODN은 B 세포와 수지상 세포의 강한 자극제이고, 클래스 C CpG ODN은 상기 클래서 A와 클래스 B의 특성을 모두 가지고 있다(Klinman, Nat Rev Immunol 2004; 4: 249-59; Krieg Curr Oncol Rep 2004; 6: 88-95). 본 발명에서 상기 클래스 A CpG ODN(문헌[Xueqing Liang,et al, Blood. 2010 June 17; 115(24): 5041-5052])은 CpG ODN 2216, CpG ODN 1585, CpG ODN 2336, CpG ODN PB4 및 CpG ODN 1002로 이루어진 군으로부터 선택될 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 클래스 B CpG ODN은 CpG ODN 1668, CpG ODN 1826, CpG ODN 2006, CpG ODN 2007, CpG ODN BW006, CpG ODN D-SL01, CpG-28, CpG-685(GNKG168; CpG ODN; 에스비아이 바이오텍), CpG-684 및 CpG-7909(CPG-ODN 2006, PF-3512676, 아가톨리모드)로 이루어진 군으로부터 선택될 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 클래스 C CpG ODN은 CpG ODN 2395, CpG ODN M362 및 CpG ODN D-SL03으로 이루어진 군으로부터 선택될 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 톨 유사 수용체 9 작용제는 IMO-2055(이데라)(3'-3'-연결된 구조 및 합성 CpR(R = 2'-데옥시-7-데아자구아노신) 모티프로 이루어진 ODN)일 수 있으나, 이에 제한되는 것은 아니다. 또한, 본 발명에서 상기 톨 유사 수용체 9 작용제는 dSLIM(등록상표) 기술(이러한 기술은 국제 특허출원공개 제2001/07055호에 기술됨)을 기초로 하는 CpG 모티프-함유 원형 ODN을 기제로 하는 올리고데옥시뉴클레오티드일 수 있으나(예컨대, 국제 특허출원공개 제2012/085291호에 기술된 몰로겐으로부터의 MGN-1703), 이에 제한되는 것은 아니다. 또한, 본 발명에서 상기 톨 유사 수용체 9 작용제는 문헌[Smith & Wickstrom (1998) J. Natl. Cancer Inst. 90:1146-1154]에 기술되어 있는 천연 발생 작용제일 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 톨 유사 수용체 9 작용제로는 미국 특허출원공개 제2009/0053206호, 미국 특허출원공개 제2008/0292648호, 미국 특허출원공개 제2007/0105800호, 미국 특허출원공개 제2010/0016250호, 미국 특허출원공개 제2009/0041809호, 국제 특허출원공개 제2007/7047396호, 국제 특허출원공개 제2007/7047396호, 국제 특허출원공개 제2010/088395호, 국제 특허출원공개 제03/035695호, 국제 특허출원공개 제2012/085291호, 국제 특허출원공개 제1998/018810호, 국제 특허출원공개 제2005/042018호, 국제 특허출원공개 제2008/073959호, 국제 특허출원공개 제2009/018431호, 국제 특허출원공개 제2007/084237호 등에 기술된 다양한 톨 유사 수용체 9 작용제를 제한없이 사용할 수 있으며, 그 외에도 1 상/2 상 임상 시험을 거치고 있는 선택적인 톨 유사 수용체 9 작용제인 IMO-2055, IMO-2125 및 IMO-2134(이데라 파마슈티칼스) 또한 사용할 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 사용되는 톨 유사 수용체 9 작용제로는 상기 열거한 종류로 특별히 제한되지 않으며, 톨 유사 수용체 9에 결합하여 톨 유사 수용체 9의 면역 반응을 자극하는 것이라면 제한없이 사용될 수 있다. 본 발명에서 상기 톨 유사 수용체 작용제는 10 ng/ml 내지 1000 ng/ml, 10 ng/ml 내지 5000 ng/ml 또는 10 ng/ml 내지 100 ng/ml의 양으로 처리될 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 인터루킨 6는 1 ng/ml 내지 100 ng/ml, 1 ng/ml 내지 50 ng/ml 또는 1 ng/ml 내지 10 ng/ml의 양으로 처리될 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 톨 유사 수용체 작용제와, 선택적으로 처리되는 인터루킨 6는 골수 세포의 분화 개시 이전, 분화 개시 시점 또는 분화 중에 1회 이상 처리할 수 있으나, 바람직하게는 골수 세포의 분화 개시 시점에 처리한 후, 분화 중에 1회 이상 처리할 수 있으며, 이에 제한되는 것은 아니다. 본 발명에서 상기 골수 세포의 분화는 성장인자를 포함하는 배지에 상기 골수 세포를 접종하여 5일 내지 10일, 5일 내지 7일, 또는 6일 동안 배양하며 수행될 수 있다. 또한, 본 발명에서 상기 톨 유사 수용체 작용제와, 선택적으로 처리되는 인터루킨 6를 골수 세포의 분화 개시 이전에 처리하는 경우, 상기 작용제를 처리한 시점으로부터 36시간, 바람직하게는 24시간 내에 상기 골수 세포에 성장인자를 처리하여 분화를 개시할 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 톨 유사 수용체 작용제 및 인터루킨 6를 골수 세포의 분화 개시 시점에 처리하는 경우, 골수 세포를 톨 유사 수용체 작용제, 인터루킨 6 및 성장인자가 첨가된 배지에 접종 및 배양할 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 톨 유사 수용체 작용제 및 인터루킨 6를 골수 세포의 분화 중에 처리하는 경우, 상기 톨 유사 수용체 작용제 및 인터루킨 6를 골수 세포의 분화 개시 시점으로부터 3일(72시간) 또는 5일(120시간) 이내에 처리할 수 있으나, 이에 제한되는 것은 아니다. 본 명세서에서 용어, "분화 개시"라 함은 골수 세포의 배양 배지에 성장인자를 첨가하거나, 또는 성장인자를 포함하는 배지에 골수 세포를 접종하여 배양하는 공정을 의미할 수 있으나, 성장인자를 사용하여 골수 세포의 분화를 유도할 수 있는 것이라면 특별히 제한하지 않는다. 본 발명에서 상기 성장인자로는 골수 세포(myeloid cells)의 자극제로서, 바람직하게는 과립구-큰포식 세포 콜로니 자극 인자(granulocyte-macrophage colony stimulating factor, GM-CSF), 과립구 콜로니 자극 인자(granulocyte colony stimulating factor, G-CSF), 큰포식 세포 콜로니 자극 인자(macrophage colony stimulating factor, M-CSF), 줄기세포 인자(stem cell factor, SCF), FMS-유사 티로신 키네이즈 3(FMS-like tyrosine kinase 3, Flt3) 및 인터루킨 3(interlukin 3, IL-3)로 이루어진 군에서 선택된 1종 이상일 수 있고, 보다 바람직하게는 과립구-큰포식 세포 콜로니 자극 인자(granulocyte-macrophage colony stimulating factor, GM-CSF)일 수 있다. 본 발명에서 상기 성장인자는 10 ng/ml 내지 500 ng/ml, 10 ng/ml 내지 100 ng/ml 또는 10 ng/ml 내지 50 ng/ml의 양으로 처리될 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서는 상기 성장인자를 사용하여 골수 세포의 분화를 개시하는 시점과 분화 중에, 톨 유사 수용체 2 작용제 및 톨 유사 수용체 4 작용제 중 1종 이상을 처리하는 경우, 상기한 골수 세포로부터 CD11c-CD11b+Ly6G-Ly6CintPDCA-1- 세포 표현형을 가지는 단핵구 골수유래 면역반응 억제세포(monocytic myeloid-derived suppressor cells, M-MDSCs)가 유도될 수 있다. 또한, 본 발명에서는 상기 성장인자를 사용하여 골수 세포의 분화를 개시하는 시점과 분화 중에, 톨 유사 수용체 7 작용제 및 톨 유사 수용체 9 작용제 중 1종 이상과 함께 인터루킨 6를 처리하는 경우, 상기한 골수 세포로부터 CD11c-CD11b+Ly6G-Ly6C+PDCA-1+ 표현형을 갖는 단핵구 골수유래 면역반응 억제세포가 유도될 수 있다. 본 발명에서 상기와 같이 얻어진 단핵구 골수유래 면역반응 억제세포는 염증성 사이토카인, IFN-γ의 발현은 억제하고, T 세포의 활성을 억제하여 면역 원성의 특성을 가진다. 또한, 본 발명에서 상기와 같이 골수 세포에 톨 유사 수용체 2 작용제 또는 톨 유사 수용체 4 작용제를 처리하여 유도된 단핵구 골수유래 면역반응 억제세포와, 골수 세포에 톨 유사 수용체 7 작용제 또는 톨 유사 수용체 9 작용제와 함께 인터루킨 6을 처리하여 유도된 단핵구 골수유래 면역반응 억제세포는 모두 그에 성장인자를 추가적으로 처리하여도 수지상 세포로 분화가 유도되지 않고 안정적으로 단핵구 골수유래 면역반응 억제세포의 특성을 유지할 수 있다. 본 발명의 다른 구현 예에 따르면, 톨 유사 수용체 작용제를 포함하는, 골수유래 면역반응 억제세포의 분화 유도용 조성물에 관한 것이다. 본 발명에서 골수 세포에 상기 조성물을 처리하는 경우, 골수 세포는 면역 관용성 골수유래 면역반응 억제세포가 유도될 수 있다. 본 발명에서 상기 톨 유사 수용체 작용제는 세포 막(plasma membrane)에 존재하는 톨 유사 수용체(exogenous Toll like receptor)의 작용제로, 톨 유사 수용체 2의 작용제 및 톨 유사 수용체 4의 작용제 중 1종 이상인 것이 본 발명에서 목적하는 안정적인 면역 관용성 골수유래 면역반응 억제세포로 분화를 유도할 수 있어 바람직하다. 단, 본 발명에서 상기 톨 유사 수용체 작용제로, 세포 내부, 특히 엔도리소좀 기관(endolysosomal compartment)에 존재하는 톨 유사 수용체(intracellular Toll like receptor)인 예를 들어, 톨 유사 수용체 7의 작용제 및 톨 유사 수용체 9의 작용제 중 1종 이상을 사용할 수 있다. 단, 그 경우 상기 조성물은 인터루킨 6(interleukin 6) 또한 필수 성분으로 포함하여야만 골수세포로부터 본 발명에서 목적하는 안정적인 면역 관용성 골수유래 면역반응 억제세포의 분화를 유도할 수 있다. 본 발명에서 상기 톨 유사 수용체 작용제의 구체적인 종류는 상기 골수유래 면역반응 억제세포의 제조 방법에 기재한 바와 중복되어, 명세서의 과도한 복잡성을 피하기 위하여 이하 그 기재를 생략한다. 본 발명에서 상기 톨 유사 수용체 작용제는 10 ng/ml 내지 1000 ng/ml, 10 ng/ml 내지 5000 ng/ml 또는 10 ng/ml 내지 100 ng/ml의 양으로 포함될 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 인터루킨 6는 1 ng/ml 내지 100 ng/ml, 1 ng/ml 내지 50 ng/ml 또는 1 ng/ml 내지 10 ng/ml의 양으로 포함될 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 톨 유사 수용체 작용제와, 선택적으로 인터루킨 6을 포함하는 조성물은 골수 세포의 분화 개시 이전, 분화 개시 시점 또는 분화 중에 1회 이상 처리할 수 있으나, 바람직하게는 골수 세포의 분화 개시 시점에 처리한 후, 분화 중에 1회 이상 처리할 수 있으며, 이에 제한되는 것은 아니다. 본 발명의 조성물을 골수 세포의 분화 개시 시점에 처리하는 경우, 본 발명의 조성물은 골수 세포의 분화를 유도하기 위하여 골수 세포의 자극제로서 성장인자를 더 포함할 수 있다. 본 발명에서 상기 성장인자는 과립구-큰포식 세포 콜로니 자극 인자(granulocyte-macrophage colony stimulating factor, GM-CSF), 과립구 콜로니 자극 인자(granulocyte colony stimulating factor, G-CSF), 큰포식 세포 콜로니 자극 인자(macrophage colony stimulating factor, M-CSF), 줄기세포 인자(stem cell factor, SCF), FMS-유사 티로신 키네이즈 3(FMS-like tyrosine kinase 3, Flt3) 및 인터루킨 3(interlukin 3, IL-3)로 이루어진 군에서 선택된 1종 이상일 수 있고, 보다 바람직하게는 과립구-큰포식 세포 콜로니 자극 인자(granulocyte-macrophage colony stimulating factor, GM-CSF)일 수 있다. 본 발명에서 상기 성장인자는 10 ng/ml 내지 500 ng/ml, 10 ng/ml 내지 100 ng/ml 또는 10 ng/ml 내지 50 ng/ml의 양으로 포함될 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 골수 세포에, 본 발명의 조성물로 톨 유사 수용체 2 작용제 또는 톨 유사 수용체 4 작용제를 처리하는 경우, 상기한 골수 세포로부터 CD11c-CD11b+Ly6G-Ly6CintPDCA-1- 세포 표현형을 가지는 단핵구 골수유래 면역반응 억제세포(monocytic myeloid-derived suppressor cells, M-MDSCs)가 유도될 수 있다. 또한, 본 발명에서 골수 세포에, 본 발명의 조성물로 톨 유사 수용체 7 작용제 및 톨 유사 수용체 9 작용제 중 1종 이상과 함께 인터루킨 6를 처리하는 경우, 상기한 골수 세포로부터 CD11c-CD11b+Ly6G-Ly6C+PDCA-1+ 단핵구 골수유래 면역반응 억제세포가 유도될 수 있다. 본 발명에서 상기와 같이 얻어진 단핵구 골수유래 면역반응 억제세포는 염증성 사이토카인, IFN-γ의 발현은 억제하고, T 세포의 활성을 억제하여 면역 원성의 특성을 가진다. 또한, 본 발명에서 유도된 단핵구 골수유래 면역반응 억제세포는, 이에 성장인자를 추가적으로 처리하여도 수지상 세포로 분화가 유도되지 않고 안정적으로 단핵구 골수유래 면역반응 억제세포의 특성을 유지할 수 있다. 본 발명의 또 다른 구현 예에 따르면, 본 발명의 방법으로 제조된 골수유래 면역반응 억제세포를 유효성분으로 포함하는 면역 질환의 예방 또는 치료용 약학적 조성물에 관한 것이다. 본 발명에서 면역 질환은 면역과민반응에 의해 야기되는 장기이식 거부반응; 조혈모세포 이식; 자가면역질환; 또는 알러지성 질환일 수 있다. 본 발명에서 상기 "자가면역질환"이란 개체 자신의 조직에 대해 일어나고 지정된 비-악성 질환 또는 장애이다. 모든 정상 개체에 있어서 가장 중요한 특성 중의 하나는 자기(self)를 구성하고 있는 항원물질에 대해서는 해롭게 반응하지 않는 반면, 비자기(non-self) 항원들에 대해서는 이를 인식하고 반응하여 제거할 수 있다. 자기 항원에 대한 생체의 무반응을 면역학적 무반응성(immunologic unresponsiveness) 또는 관용(tolerance)이라고 한다. 그러나 자기 관용을 유도 또는 유지함에 있어서 이상이 생기면 자기 항원에 대하여 면역 반응이 일어나게 되고, 그 결과 자신의 조직을 공격하는 현상이 발생하는데 상기 과정에 의해 발생되는 질환을 자가면역질환이라고 한다. 상기 자기 면역 질환은 자신의 장기조직이나 그 성분에 대해 항체가 생산되는 염증성 질환으로서, 다수의 조직과 장기에 만성적인 전신적 염증을 일으키는 질병을 총칭할 수 있다. 구체적으로, 본 발명에서 상기 자가면역질환은 류마티스 관절염, 전신성 홍반성 루푸스, 패혈증성 쇼크, 알러지성 천식, 알러지성 비염, 아토피성 피부염, 궤양성 대장염, 누선염, 알츠하이머 질환, 뇌졸중, 동맥경화증, 혈관 재협착, I형 당뇨병, II형 당뇨병, 담마진, 결막염, 건선, 전신성염증반증후군, 다발성근염, 피부근염, 결절성 다발관절염, 혼합결합 조직증, 쉐그렌증후군, 통풍, 파킨슨병, 근위축성측색경화증, 당뇨성망막증, 다발성경화증, 크론병, 만성 갑상선염, 세리아크병, 중증근무력증, 심상성천포창, 바이러스질환, 세균성질환, 방사선에 의한 장해, 동맥경화, 혈관종, 혈관섬유종, 재관류장해 및 심장비대증으로 이루어진 군에서 선택된 1종 이상일 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 "예방"은 본 발명의 조성물의 투여로 면역 질환을 억제하거나 진행을 지연시키는 모든 행위를 의미한다. 본 발명에서 "치료" 및 "개선"은 본 발명의 조성물의 투여로 면역 질환의 증상이 호전 또는 이롭게 변경되는 모든 행위를 의미한다. 본 발명의 약학적 조성물은 면역 질환의 치료를 위하여 치료학적으로 유효한 양의 골수유래 면역반응 억제세포를 포함할 수 있다. 치료학적으로 유효한 양(therapeutically effective amount)은 연구자, 수의사, 의사 또는 기타 임상에 의해 생각되는 조직계, 동물 또는 인간에서 생물학적 또는 의학적 반응을 유도하는 유효 성분 또는 약학적 조성물의 양을 의미하는 것으로, 이는 치료되는 질환 또는 장애의 증상의 완화를 유도하는 양을 포함한다. 본 발명의 면역 질환의 예방 또는 치료용 약학적 조성물에 포함되는 골수유래 면역반응 억제 세포의 함량(수)은 원하는 효과에 따라 변화될 것임은 당업자에게 자명하다. 그러므로 최적의 세포 치료제 함량은 당업자에 의해 쉽게 결정될 수 있으며, 질환의 종류, 질환의 중증도, 조성물에 함유된 다른 성분의 함량, 제형의 종류, 및 환자의 연령, 체중, 일반 건강 상태, 성별 및 식이, 투여 시간, 투여 경로 및 조성물의 분비율, 치료 기간, 동시 사용되는 약물을 비롯한 다양한 인자에 따라 조절될 수 있으나, 예를 들면, 2x104 cells/ml ~ 8x107cell/ml의 골수유래 면역반응 억제세포가 포함될 수 있으나, 이에 제한되는 것은 아니다. 본 발명에 있어서, 상기 약학적 조성물은 캡슐, 정제, 과립, 주사제, 연고제, 분말 또는 음료 형태임을 특징으로 할 수 있으며, 상기 약학적 조성물은 인간을 대상으로 하는 것을 특징으로 할 수 있다. 본 발명의 약학적 조성물은 이들로 한정되는 것은 아니지만, 각각 통상의 방법에 따라 산제, 과립제, 캡슐, 정제, 수성 현탁액 등의 경구형 제형, 외용제, 좌제 및 멸균 주사용액의 형태로 제형화하여 사용될 수 있다. 본 발명의 약학적 조성물은 약제적으로 허용 가능한 담체를 포함할 수 있다. 약학적으로 허용되는 담체는 경구 투여 시에는 결합제, 활탁제, 붕해제, 부형제, 가용화제, 분산제, 안정화제, 현탁화제, 색소, 향료 등을 사용할 수 있으며, 주사제의 경우에는 완충제, 보존제, 무통화제, 가용화제, 등장제, 안정화제 등을 혼합하여 사용할 수 있으며, 국소투여용의 경우에는 기제, 부형제, 윤활제, 보존제 등을 사용할 수 있다. 본 발명의 약학적 조성물의 제형은 상술한 바와 같은 약학적으로 허용되는 담체와 혼합하여 다양하게 제조될 수 있다. 예를 들어, 경구 투여시에는 정제, 트로키, 캡슐, 엘릭서(elixir), 서스펜션, 시럽, 웨이퍼 등의 형태로 제조할 수 있으며, 주사제의 경우에는 단위 투약 앰플 또는 다수회 투약 형태로 제조할 수 있다. 기타, 용액, 현탁액, 정제, 캡슐, 서방형 제제 등으로 제형할 수 있다. 한편, 제제화에 적합한 담체, 부형제 및 희석제의 예로는, 락토즈, 덱스트로즈, 수크로즈, 솔비톨, 만니톨, 자일리톨, 에리스리톨, 말디톨, 전분, 아카시아 고무, 알지네이트, 젤라틴, 칼슘 포스페이트, 칼슘 실리케이트, 셀룰로즈, 메틸 셀룰로즈, 미정질 셀룰로즈, 폴리비닐피롤리돈, 물, 메틸하이드록시벤조에이트, 프로필하이드록시벤조에이트, 탈크, 마그네슘 스테아레이트 또는 광물유 등이 사용될 수 있다. 또한, 충진제, 항응집제, 윤활제, 습윤제, 향료, 유화제, 방부제 등을 추가로 포함할 수 있다. 본 발명에 따른 약학적 조성물의 투여 경로는 이들로 한정되는 것은 아니지만 구강, 정맥 내, 근육 내, 동맥 내, 골수 내, 경막 내, 심장 내, 경피, 피하, 복강 내, 비강 내, 장관, 국소, 설하 또는 직장이 포함된다. 경구 또는 비경구 투하가 바람직하다. 본 발명에서, "비경구"는 피하, 피내, 정맥내, 근육내, 관절내, 활액낭내, 흉골내, 경막내, 병소내 및 두개골내 주사 또는 주입기술을 포함한다. 본 발명의 약학적 조성물은 또한 직장 투여를 위한 좌제의 형태로 투여될 수 있다. 본 발명의 약학적 조성물은 사용된 특정 화합물의 활성, 연령, 체중, 일반적인 건강, 성별, 정식, 투여 시간, 투여 경로, 배출율, 약물 배합 및 예방 또는 치료될 특정 질환의 중증을 포함한 여러 요인에 따라 다양하게 변할 수 있고, 상기 약학적 조성물의 투여량은 환자의 상태, 체중, 질병의 정도, 약물 형태, 투여 경로 및 기간에 따라 다르지만 당업자에 의해 적절하게 선택될 수 있고, 1일 0.0001 내지 50mg/kg 또는 0.001 내지 50mg/kg으로 투여할 수 있다. 투여는 하루에 한번 투여할 수도 있고, 수회 나누어 투여할 수도 있다. 상기 투여량은 어떠한 면으로든 본 발명의 범위를 한정하는 것은 아니다. 본 발명에 따른 의약 조성물은 환제, 당의정, 캡슐, 액제, 겔, 시럽, 슬러리, 현탁제로 제형될 수 있다. 본 발명의 조성물은 단독으로, 혹은 종전의 자가면역질환 치료제로 예를 들어 류마티즘 관절염 치료제인 메토트렉세이트(methotrexate, MTX) 등과 혼합하여 사용할 수 있고, 혹은 수술, 방사선 치료, 호르몬 치료, 화학 치료 및 생물학적 반응 조절제를 사용하는 방법들과 병용하여 사용할 수 있다. 본 발명의 또 다른 구현 예에 따르면, 본 발명에 따른 골수유래 면역반응 억제세포를 유효성분으로 자가면역질환의 예방 또는 개선용 화장료 조성물의 제조방법에 관한 것이다. 본 발명에서 골수유래 면역반응 억제세포를 제조하는 방법에 관한 자세한 설명은 상기 약학적 조성물에 기재된 바와 중복되어, 명세서 기재의 과도한 복잡성을 피하기 위해 이하의 기재를 생략한다. 본 발명의 골수유래 면역반응 억제세포가 화장료 조성물에 포함될 때 2x104 cells/ml ~ 8x107cell/ml의 세포 수로 첨가될 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 화장료 조성물은 화장수, 영양로션, 영양에센스, 마사지 크림, 미용목욕물첨가제, 바디로션, 바디밀크, 배스오일, 베이비오일, 베이비파우더, 샤워겔, 샤워크림, 선스크린로션, 선스크린크림, 선탠크림, 스킨로션, 스킨크림, 자외선차단용 화장품, 크렌징밀크, 탈모제{화장용}, 페이스 및 바디로션, 페이스 및 바디크림, 피부미백크림, 핸드로션, 헤어로션, 화장용크림, 쟈스민오일, 목욕비누, 물비누, 미용비누, 샴푸, 손세정제(핸드클리너), 약용비누{비의료용}, 크림비누, 페이셜 워시, 전신 세정제, 두피 세정제, 헤어린스, 화장비누, 치아미백용 겔, 치약 등의 형태로 제조될 수 있다. 이를 위해 본 발명의 조성물은 화장료 조성물의 제조에 통상적으로 사용하는 용매나, 적절한 담체, 부형제 또는 희석제를 더 포함할 수 있다. 본 발명의 화장료 조성물 내에 더 추가될 수 있는 용매의 종류는 특별히 한정하지 않으나, 예를 들어, 물, 식염수, DMSO 또는 이들의 조합을 사용할 수 있고, 담체, 부형제 또는 희석제로는 정제수, 오일, 왁스, 지방산, 지방산 알콜, 지방산 에스테르, 계면활성제, 흡습제(humectant), 증점제, 항산화제, 점도 안정화제, 킬레이팅제, 완충제, 저급 알콜 등이 포함되지만, 이에 제한되는 것은 아니다. 또한, 필요에 따라 미백제, 보습제, 비타민, 자외선 차단제, 향수, 염료, 항생제, 항박테리아제, 항진균제를 포함할 수 있다. 상기 오일로서는 수소화 식물성유, 피마자유, 면실유, 올리브유, 야자인유, 호호바유, 아보카도유가 이용될 수 있으며, 왁스로는 밀랍, 경랍, 카르나우바, 칸델릴라, 몬탄, 세레신, 액체 파라핀, 라놀린이 이용될 수 있다. 지방산으로는 스테아르산, 리놀레산, 리놀렌산, 올레산이 이용될 수 있고, 지방산 알콜로는 세틸 알콜, 옥틸 도데칸올, 올레일 알콜, 판텐올, 라놀린 알콜, 스테아릴 알콜, 헥사데칸올이 이용될 수 있으며 지방산 에스테르로는 이소프로필 미리스테이트, 이소프로필 팔미테이트, 부틸 스테아레이트가 이용될 수 있다. 계면 활성제로는 당업계에 알려진 양이온 계면활성제, 음이온 계면활성제 및 비이온성 계면활성제가 사용가능하며 가능한 한 천연물 유래의 계면활성제가 바람직하다. 그 외에도 화장품 분야에서 널리 알려진 흡습제, 증점제, 항산화제 등을 포함할 수 있으며, 이들의 종류와 양은 당업계에 공지된 바에 따른다. 본 발명의 또 다른 구현 예에 따르면, 본 발명에 따른 골수유래 면역반응 억제세포를 유효성분으로 자가면역질환의 예방 또는 개선용 식품 조성물의 제조방법에 관한 것이다. 본 발명에서 골수유래 면역반응 억제세포를 제조하는 방법에 관한 자세한 설명은 상기 약학적 조성물에 기재된 바와 중복되어, 명세서 기재의 과도한 복잡성을 피하기 위해 이하의 기재를 생략한다. 본 발명의 식품 조성물은 각종 식품류, 예를 들어, 음료, 껌, 차, 비타민 복합제, 분말, 과립, 정제, 캡슐, 과자, 떡, 빵 등의 형태로 제조될 수 있다. 본 발명의 식품 조성물은 독성 및 부작용이 거의 없는 식물추출물로 구성된 것이므로 예방 목적으로 장기간 복용 시에도 안심하고 사용할 수 있다. 본 발명의 골수유래 면역반응 억제세포가 식품 조성물에 포함될 때 2x104 cells/ml ~ 8x107cell/ml의 세포 수로 첨가될 수 있으나, 이에 제한되는 것은 아니다. 여기서, 상기 식품 조성물이 음료 형태로 제조되는 경우 지시된 비율로 상기 식품 조성물을 함유하는 것 외에 특별한 제한점은 없으며 통상의 음료와 같이 여러가지 향미제 또는 천연 탄수화물 등을 추가 성분으로서 함유할 수 있다. 즉, 천연 탄수화물로서 포도당 등의 모노사카라이드, 과당 등의 디사카라이드, 슈크로스 등의 및 폴리사카라이드, 덱스트린, 시클로덱스트린 등과 같은 통상적인 당 및 자일리톨, 소르비톨, 에리트리톨 등의 당알콜 등을 포함할 수 있다. 상기 향미제로서는 천연 향미제(타우마틴, 스테비아 추출물(예를 들어 레바우디오시드 A, 글리시르히진등) 및 합성 향미제(사카린, 아스파르탐 등) 등을 들 수 있다. 그 외 본 발명의 식품 조성물은 여러 가지 영양제, 비타민, 광물(전해질), 합성 풍미제 및 천연 풍미제 등의 풍미제, 착색제, 펙트산 및 그의 염, 알긴산 및 그의 염, 유기산, 보호성 콜로이드 증점제, pH 조절제, 안정화제, 방부제, 글리세린, 알콜, 탄산 음료에 사용되는 탄산화제 등을 함유할 수 있다. 이러한 성분은 독립적으로 또는 조합하여 사용할 수 있다. 이러한 첨가제의 비율은 그렇게 중요하진 않지만 본 발명의 조성물 100 중량부 당 0.1 내지 약 50 중량부의 범위에서 선택되는 것이 일반적이다. 본 발명의 또 다른 구현 예에 따르면, 면역 질환을 예방 또는 치료하기 위하여, 목적하는 개체에 본 발명에서 제공하는 골수유래 면역반응 억제세포 또는 본 발명에서 제공하는 약학적 조성물을 투여하는 단계를 포함하는, 면역 질환의 예방 또는 치료 방법에 관한 것이다. 본 발명에서 상기 "목적하는 개체"란, 면역 질환이 발병하였거나, 발병 가능성이 높은 개체를 의미한다. 본 발명에서 면역 질환은 면역과민반응에 의해 야기되는 장기이식 거부반응; 조혈모세포 이식; 자가면역질환; 또는 알러지성 질환일 수 있다. 본 발명에서 제공하는 골수유래 면역반응 억제세포의 투여량, 스케줄 및 투여 경로는 개체의 크기 및 조건에 따라, 그리고 표준 약학적 관행에 따라 결정될 수 있다. 예시적인 투여 경로는 정맥내, 동맥내, 복강내, 폐내, 혈관내, 근육내, 기관내, 피하, 안내, 척수강내 또는 경피를 포함한다. 개체에 투여되는 골수유래 면역반응 억제세포의 용량은, 예를 들어, 투여되는 골수유래 면역반응 억제세포의 특정 유형, 투여 경로 및 치료되는 면역 질환의 특정 유형과 병기에 따라 달라질 수 있다. 상기 양은 심한 독성 또는 유해 사례없이, 면역 질환에 대한 치료 반응과 같은 원하는 반응을 가져오기 충분해야 한다. 정제된 효소를 사용한 시험관내 검정, 세포 기반 검정, 동물 모델 또는 인체 실험과 같은 표준 방법을 사용하여 효과의 규모를 측정할 수 있다. 예를 들면, 상기 골수유래 면역반응 억제세포는 2x104 cells/ml ~ 8x107cell/ml의 세포수로 투여될 수 있으나, 이에 제한되는 것은 아니다. 또한, 본 발명에서는 상기 골수유래 면역반응 억제세포를 각각 통상의 방법에 따라 산제, 과립제, 캡슐, 정제, 수성 현탁액 등의 경구형 제형, 외용제, 좌제 및 멸균 주사용액의 형태로 제형화하여 투여할 수 있다. 또한, 본 발명에서는 상기 골수유래 면역반응 억제세포 외에 약제적으로 허용 가능한 담체를 함께 투여할 수 있다. 약학적으로 허용되는 담체는 경구 투여 시에는 결합제, 활탁제, 붕해제, 부형제, 가용화제, 분산제, 안정화제, 현탁화제, 색소, 향료 등을 사용할 수 있으며, 주사제의 경우에는 완충제, 보존제, 무통화제, 가용화제, 등장제, 안정화제 등을 혼합하여 사용할 수 있으며, 국소투여용의 경우에는 기제, 부형제, 윤활제, 보존제 등을 사용할 수 있다. 또한, 본 발명에서 상기 분비 단백체를 약학적으로 허용되는 담체와 혼합하여 다양하게 제조될 수 있다. 예를 들어, 경구 투여시에는 정제, 트로키, 캡슐, 엘릭서(elixir), 서스펜션, 시럽, 웨이퍼 등의 형태로 제조할 수 있으며, 주사제의 경우에는 단위 투약 앰플 또는 다수회 투약 형태로 제조할 수 있다. 기타, 용액, 현탁액, 정제, 캡슐, 서방형 제제 등으로 제형할 수 있다. 한편, 제제화에 적합한 담체, 부형제 및 희석제의 예로는, 락토즈, 덱스트로즈, 수크로즈, 솔비톨, 만니톨, 자일리톨, 에리스리톨, 말디톨, 전분, 아카시아 고무, 알지네이트, 젤라틴, 칼슘 포스페이트, 칼슘 실리케이트, 셀룰로즈, 메틸 셀룰로즈, 미정질 셀룰로즈, 폴리비닐피롤리돈, 물, 메틸하이드록시벤조에이트, 프로필하이드록시벤조에이트, 탈크, 마그네슘 스테아레이트 또는 광물유 등이 사용될 수 있다. 또한, 충진제, 항응집제, 윤활제, 습윤제, 향료, 유화제, 방부제 등을 추가로 포함할 수 있다. Ⅰ형 인터페론(type Ⅰ interferon)을 이용한 PDCA-1 발현 수준이 높은 단핵구 골수유래 면역반응 억제세포(monocytic myeloid-derived suppressor cells, M-MDSCs)의 유도 본 발명의 발명자들은 골수 세포(bone marrow cells)에 Ⅰ형 인터페론(type Ⅰ interferon)을 처리하는 경우 PDCA-1 발현 수준이 높은 단핵구 골수유래 면역반응 억제세포(monocytic myeloid-derived suppressor cells, M-MDSCs)가 유도되고, 이에 성장인자를 처리하는 경우 미접촉 T 세포(naive T cell)를 Th1 세포로 분화를 유도할 수 있는 면역원성 수지상 세포가 유도되는 것을 발견하여 본 발명에 이르게 되었다. 본 발명의 일 구현 예에 따르면, 골수 세포에 Ⅰ형 인터페론(type Ⅰ interferon)을 처리하여 골수유래 면역반응 억제세포(myeloid-derived suppressor cells, MDSCs)로 분화를 유도하는 단계를 포함하는, 골수유래 면역반응 억제세포의 제조 방법에 관한 것이다. 구체적으로, 본 발명에서는 골수 세포에 Ⅰ형 인터페론을 처리하는 경우 단핵구 골수유래 면역반응 억제세포(monocytic myeloid-derived suppressor cells, M-MDSCs)로의 분화를 유도할 수 있다. 본 발명에서 상기 "인터페론"은 일반적으로 이중-가닥 RNA의 존재 또는 다른 Ⅰ형 인터페론-유도 자극에 대한 면역계 세포 및 다양한 종류의 다른 세포에 의해서 전형적으로 생산되는 사이토카인에 관한 것이다. 본 발명에서 상기 "Ⅰ형 인터페론"은 당업계에 공지되어 있고 예를 들어, 인터페론-α 수용체(IFNAR)로 알려진 특이적인 세포 표면 수용체 복합체에 결합하는 능력에 의해 확인될 수 있는 인터페론 단백질 하위군의 어떠한 하나의 구성원을 포함할 수 있으며, 상기 복합체는 IFNAR1 및 IFNAR2로 이루어진다(De Weerd et al., 2007, J BiolChem 282 (28): 20053-20057). IFNAR은 키나아제 TYK2 및 JAK1과 연관되어 있다. 일단 활성화되면, IFNAR 복합체는 전사 과정의 신호 전달인자 및 활성인자(STAT) 패밀리 구성원인 STAT1 및 STAT2를 인산화시키고, 이는 인터페론 조절 인자 9(IRF9)와 이종삼량체화되어 인터페론-자극 유전자 인자 3(ISGF3) 복합체(야누스 키나아제(JAK)/STAT 경로)를 형성한다. ISGF3은 핵으로 이동하여 다양한 인터페론-자극 유전자(ISGs)의 조절 영역에서 확인할 수 있는 DNA 모티프인 인터페론-자극 반응 구성요소(ISRE)에 결합한다(상기 Hundeshagen, 2012에 검토됨). 또한 Ⅰ형 인터페론-관련 경로 내에는 다양한 양성 및 음성 피드백 루프가 있다. 포유동물 시스템에서 확인되는 Ⅰ형 인터페론은 IFN-α, IFN-β, IFN-κ, IFN-δ, IFN-ε, IFN-τ, IFN-ω 및 IFN-ζ(리미틴으로도 알려진)를 포함하지만, 이에 제한되지는 않는다. 인체 내 확인되는 Ⅰ형 인터페론은 IFN-α, IFN-β, IFN-κ(IFNK으로도 알려진), 및 IFN-ω이다. IFN-α 단백질의 다양한 아형(IFN-α-2a 및 IFN-α-2b를 포함) 및 IFN-β 단백질의 다양한 아형(IFN-β-1a 및 IFN-β-1b를 포함)은 림프구, 큰포식 세포, 플라즈마사이토이드 수지상 세포, 섬유아세포, 내피 세포 및 다른 세포를 포함하는 다양한 형태의 세포에 의해 생산되고, 전형적으로 선천성 면역반응에 관련되어 있다. IFN-α는 또한 HCV, 특정의 다른 바이러스 감염 및 일부 암을 포함하는 다양한 질환을 치료하기 위한 인간 투여를 목적으로 상업적으로 생산되고, 대부분은 주로 페길화 형태(예컨대, pegIFN-α)로서 상업적으로 제공되었다. IFN-β는 또한 MS를 포함하는 다양한 질환을 치료하기 위해 상업적으로 생산되었다. 본 발명에서 상기 골수 세포에 처리하는 Ⅰ형 인터페론으로는 IFN-α, IFN-β, IFN-κ 및 IFN-ω으로 이루어진 군에서 선택된 1종 이상일 수 있고, 바람직하게는 IFN-α 및 IFN-β 중 1종 이상일 수 있으며, 보다 바람직하게는 IFN-β일 수 있다. 본 발명에서 상기 Ⅰ형 인터페론은 10 ng/ml 내지 1000 ng/ml, 10 ng/ml 내지 5000 ng/ml 또는 10 ng/ml 내지 100 ng/ml의 양으로 처리될 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 Ⅰ형 인터페론은 골수 세포의 분화 개시 이전, 분화 개시 시점 또는 분화 중에 1회 이상 처리할 수 있으나, 바람직하게는 골수 세포의 분화 개시 시점에 처리한 후, 분화 중에 1회 이상 처리할 수 있으며, 이에 제한되는 것은 아니다. 본 발명에서 상기 골수 세포의 분화는 성장인자를 포함하는 배지에 상기 골수 세포를 접종하여 5일 내지 10일, 5일 내지 7일, 또는 6일 동안 배양하며 수행될 수 있다. 또한, 본 발명에서 상기 Ⅰ형 인터페론을 골수 세포의 분화 개시 이전에 1회 이상 처리하는 경우, 상기 Ⅰ형 인터페론을 처리한 어느 일 시점으로부터 36시간, 바람직하게는 24시간 내에 상기 골수 세포에 성장인자를 처리하여 분화를 개시할 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 Ⅰ형 인터페론을 골수 세포의 분화 개시 시점에 처리하는 경우, 골수 세포를 Ⅰ형 인터페론 및 성장인자가 첨가된 배지에 접종 및 배양할 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 Ⅰ형 인터페론을 골수 세포의 분화 중에 1회 이상 처리하는 경우, 분화 개시 시점으로부터 3일(72시간) 또는 5일(120시간) 이내에 1회 이상 처리할 수 있으나, 이에 제한되는 것은 아니다. 본 명세서에서 용어, "분화 개시"라 함은 골수 세포의 배양 배지에 성장인자를 첨가하거나, 또는 성장인자를 포함하는 배지에 골수 세포를 접종하여 배양하는 공정을 의미할 수 있으나, 성장인자를 사용하여 골수 세포의 분화를 유도할 수 있는 것이라면 특별히 제한하지 않는다. 본 발명에서 상기 성장인자로는 골수 세포(myeloid cells)의 자극제로서, 바람직하게는 과립구-큰포식 세포 콜로니 자극 인자(granulocyte-macrophage colony stimulating factor, GM-CSF), 과립구 콜로니 자극 인자(granulocyte colony stimulating factor, G-CSF), 큰포식 세포 콜로니 자극 인자(macrophage colony stimulating factor, M-CSF), 줄기세포 인자(stem cell factor, SCF), FMS-유사 티로신 키네이즈 3(FMS-like tyrosine kinase 3, Flt3) 및 인터루킨 3(interlukin 3, IL-3)로 이루어진 군에서 선택된 1종 이상일 수 있고, 보다 바람직하게는 과립구-큰포식 세포 콜로니 자극 인자(granulocyte-macrophage colony stimulating factor, GM-CSF)일 수 있다. 본 발명에서 상기 성장인자는 10 ng/ml 내지 500 ng/ml, 10 ng/ml 내지 100 ng/ml 또는 10 ng/ml 내지 50 ng/ml의 양으로 처리될 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 성장인자를 사용하여 골수 세포의 분화를 개시하는 시점과 분화 중에, Ⅰ형 인터페론을 처리하는 경우, 상기한 골수 세포로부터 CD11c-CD11b+Ly6G-Ly6C+PDCA-1+ 세포 표현형을 가지는 단핵구 골수유래 면역반응 억제세포(monocytic myeloid-derived suppressor cells, M-MDSCs)가 유도될 수 있다. 본 발명에서 상기와 같이 Ⅰ형 인터페론을 처리하여 유도된 단핵구 골수유래 면역반응 억제세포는 PDCA-1의 발현 수준이 높고, CD124의 발현 수준은 낮으며, 지질다당류(lipopolysaccharide, LPS)와 인터페론-γ(IFN-gamma)로 자극 시 NOS2, 알기나제-1(arginase-1, Arg-1) 및 IL-10를 두드러지게 높은 수준으로 발현하는 특성을 가진다. 본 발명의 다른 구현 예에 따르면, 본 발명에 따라 상기의 CD11c-CD11b+Ly6G-Ly6C+PDCA-1+ 세포 표현형을 가지는 단핵구 골수유래 면역반응 억제세포에 성장인자를 처리하여 수지상 세포로의 분화를 유도하는 단계를 포함하는, 수지상 세포의 제조 방법에 관한 것이다. 본 발명에서 상기 수지상 세포의 분화 유도 시 사용되는 성장인자는 과립구-큰포식 세포 콜로니 자극 인자(granulocyte-macrophage colony stimulating factor, GM-CSF), 과립구 콜로니 자극 인자(granulocyte colony stimulating factor, G-CSF), 큰포식 세포 콜로니 자극 인자(macrophage colony stimulating factor, M-CSF), 줄기세포 인자(stem cell factor, SCF), FMS-유사 티로신 키네이즈 3(FMS-like tyrosine kinase 3, Flt3) 및 인터루킨 3(interlukin 3, IL-3)로 이루어진 군에서 선택된 1종 이상일 수 있으나, 바람직하게는 과립구-큰포식 세포 콜로니 자극 인자(granulocyte-macrophage colony stimulating factor, GM-CSF)일 수 있다. 또한, 본 발명에서 상기 성장인자는 10 ng/ml 내지 500 ng/ml, 10 ng/ml 내지 100 ng/ml 또는 10 ng/ml 내지 50 ng/ml의 양으로 처리될 수 있다. 또한, 본 발명에서 상기 성장인자는 12시간 내지 7일 동안 처리될 수 있고, 바람직하게는 24시간 내지 5일, 보다 바람직하게는 3일 내지 5일 동안 처리될 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 CD11c-CD11b+Ly6G-Ly6C+PDCA-1+ 세포 표현형을 가지는 단핵구 골수유래 면역반응 억제세포에 성장인자를 처리함에 따라 면역원성(immunogenic) 수지상 세포의 분화를 유도할 수 있다. 본 발명에서 상기와 같이 얻어진 수지상 세포는 세포 표현형으로 CD64 및 CD115의 발현 수준이 높고, 지질다당류와 인터페론-γ로 자극 시 IL-12p70, TNF-α, IL-6, IL-10 및 NO2의 발현 수준이 유의적으로 증가한다. 또한, 본 발명의 수지상 세포로 T 세포를 자극하는 경우 T 세포의 INF-γ의 분비능이 증가되고, 미접촉 T 세포를 Th1 세포로 분화를 유도하여 면역원성을 높일 수 있다. 이러한 특성을 바탕으로, 본 발명의 또 다른 구현 예에 따르면, 상기 수지상 세포를 포함하는 면역 치료제에 관한 것이다. 본 발명에 따른 면역 치료제는 면역 반응을 증가시키거나, 특정 질병, 감염 또는 질환의 치료 또는 예방에 바람직한 면역 반응의 일부를 선택적으로 상승시킬 수 있다. 본 발명의 또 다른 구현 예에 따르면, 상기 수지상 세포를 포함하는 항종양 백신 또는 종양치료용 약학적 조성물에 관한 것이다. 종양에 잠재성 항원이 풍부하고 이러한 종양이 수지상 세포에 의해 제시되면 면역원성을 갖는다는 사실에 기초하여, 본 발명에 따른 수지상 세포는 종양 예방을 위한 항종양 백신 또는 종양 치료제로 사용될 수 있다. 본 발명에 따른 수지상 세포를 통해 객체의 면역원성을 증가시킬 수 있으므로, 이를 통해 객체 내 종양의 증식 및/또는 전이를 예방 또는 억제할 수 있다. 본 발명에서 상기 종양은 간암, 담도암, 담낭암, 식도암, 위암, 난소암, 유방암, 자궁암, 결장암, 직장암, 자궁경부암, 전립선암, 피부암, 췌장암, 백혈병, 림프종, 호지킨병, 폐암, 기관지암, 다발성 골수종, 백혈병, 림프종, 편평세포암, 신장암, 요도암, 방광암, 두경부암, 뇌암 및 중추신경계 암으로 이루어진 군에서 선택된 1종 이상일 수 있으나, 이에 제한되는 것은 아니다. 본 발명에 사용 가능한 수지상 세포 백신의 항원으로는 막투과 펩타이드와 결합할 수 있는 모든 항원으로, 불활성화 종양세포, 유전자 재조합 방법에 의해 제조된 종양세포 관련 유전자, 펩타이드 또는 단백질을 포함할 수 있다. 유전자 재조합 방법에 의해 상기 항원을 수득하고자 하는 경우, 상기 항원을 인코딩하는 뉴클레오타이드 서열은 공지일 수 있으며, 공지된 서열의 전장을 이용할 수 있으나, 전장의 일부를 이용할 수도 있다. 상기 항원을 인코딩하는 뉴클레오타이드 서열을 벡터에 클로닝하여 목적하는 항원이 발현되도록 할 수 있다. 본 발명에 따른 항종양 백신은 일회 투여함으로써 수행되는 면역화 방법과 연속 투여함으로써 수행되는 면역화 방법을 모두 포함할 수 있다. 본 발명에서 상기 면역 치료제, 항종양 백신 또는 종양치료용 약학적 조성물의 투여 경로는 목적 조직에 도달할 수 있는 한 어떠한 일반적인 경로를 통하여 투여될 수 있다. 비경구 투여, 예를 들어, 복강 내 투여, 정맥 내 투여, 근육 내 투여, 피하 투여, 피 내 투여될 수 있으나, 이에 제한되지는 않는다. 상기 조성물은 세포 치료에 일반적으로 사용되는 약학적 담체와 함께 적합한 형태로 제형화될 수 있다. '약학적으로 허용되는' 이란 생리학적으로 허용되고 인간에게 투여될 때, 통상적으로 위장 장애, 현기증 등과 같은 알레르기 반응 또는 이와 유사한 반응을 일으키지 않는 조성물을 말한다. 약학적으로 허용되는 담체로는 예를 들면, 물, 적합한 오일, 식염수, 수성 글루코스 및 글리콜 등과 같은 비경구 투여용 담체 등이 있으며 안정화제 및 보존제를 추가로 포함할 수 있다. 적합한 안정화제로는 아황산수소나트륨, 아황산나트륨 또는 아스코르브산과 같은 항산화제가 있다. 적합한 보존제로는 벤즈알코늄 클로라이드, 메틸- 또는 프로필-파라벤 및 클로로부탄올이 있다. 그 밖의 약학적으로 허용되는 담체로는 다음의 문헌에 기재되어 있는 것을 참고로 할 수 있다(Remington's Pharmaceutical Sciences, 19th ed., Mack Publishing Company, Easton, PA, 1995). 또한, 본 발명에서 상기 면역 치료제는 표적 세포로 이동할 수 있는 임의의 장치에 의해 투여될 수도 있다. 본 발명의 면역 치료제, 항종양 백신 또는 종양치료용 약학적 조성물은 질환의 치료를 위하여 치료학적으로 유효한 양의 수지상 세포를 포함할 수 있다. 치료학적으로 유효한 양(therapeutically effective amount)은 연구자, 수의사, 의사 또는 기타 임상에 의해 생각되는 조직계, 동물 또는 인간에서 생물학적 또는 의학적 반응을 유도하는 유효 성분 또는 약학적 조성물의 양을 의미하는 것으로, 이는 치료되는 질환 또는 장애의 증상의 완화를 유도하는 양을 포함한다. 본 발명의 면역 치료제, 항종양 백신 또는 종양치료용 약학적 조성물에 포함되는 수지상 세포의 함량(수)은 원하는 효과에 따라 변화될 것임은 당업자에게 자명하다. 그러므로 최적의 세포 치료제 함량은 당업자에 의해 쉽게 결정될 수 있으며, 질환의 종류, 질환의 중증도, 조성물에 함유된 다른 성분의 함량, 제형의 종류, 및 환자의 연령, 체중, 일반 건강 상태, 성별 및 식이, 투여 시간, 투여 경로 및 조성물의 분비율, 치료 기간, 동시 사용되는 약물을 비롯한 다양한 인자에 따라 조절될 수 있으나, 예를 들면, 2x104 cells/ml ~ 8x107cell/ml의 수지상 세포가 포함될 수 있으나, 이에 제한되는 것은 아니다. 본 발명의 면역 치료제, 항종양 백신 또는 종양치료용 약학적 조성물은 직장, 정맥 내, 동맥 내, 복강 내, 근육 내, 흉골 내, 경피, 국소, 안구 내 피하 또는 피 내 경로를 통해 통상적인 방식으로 투여할 수 있다. 본 발명의 또 다른 구현 예에 따르면, 종양을 예방 또는 치료하기 위하여, 목적하는 개체에 본 발명에서 제공하는 수지상 세포 또는 본 발명에서 제공하는 약학적 조성물을 투여하는 단계를 포함하는, 종양의 예방 또는 치료 방법에 관한 것이다. 본 발명에서 상기 "목적하는 개체"란, 종양이 발병하였거나, 발병 가능성이 높은 개체를 의미한다. 본 발명에서 상기 종양은 간암, 담도암, 담낭암, 식도암, 위암, 난소암, 유방암, 자궁암, 결장암, 직장암, 자궁경부암, 전립선암, 피부암, 췌장암, 백혈병, 림프종, 호지킨병, 폐암, 기관지암, 다발성 골수종, 백혈병, 림프종, 편평세포암, 신장암, 요도암, 방광암, 두경부암, 뇌암 및 중추신경계 암으로 이루어진 군에서 선택된 1종 이상일 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 제공하는 수지상 세포의 투여량, 스케줄 및 투여 경로는 개체의 크기 및 조건에 따라, 그리고 표준 약학적 관행에 따라 결정될 수 있다. 예시적인 투여 경로는 정맥내, 동맥내, 복강내, 폐내, 혈관내, 근육내, 기관내, 피하, 안내, 척수강내 또는 경피를 포함한다. 개체에 투여되는 수지상 세포의 용량은, 예를 들어, 투여되는 수지상 세포의 특정 유형, 투여 경로 및 치료되는 종양의 특정 유형과 병기에 따라 달라질 수 있다. 상기 양은 심한 독성 또는 유해 사례없이, 종양에 대한 치료 반응과 같은 원하는 반응을 가져오기 충분해야 한다. 정제된 효소를 사용한 시험관내 검정, 세포 기반 검정, 동물 모델 또는 인체 실험과 같은 표준 방법을 사용하여 효과의 규모를 측정할 수 있다. 예를 들면, 상기 수지상 세포는 2x104 cells/ml ~ 8x107cell/ml의 세포수로 투여될 수 있으나, 이에 제한되는 것은 아니다. 또한, 본 발명에서는 상기 수지상 세포를 각각 통상의 방법에 따라 산제, 과립제, 캡슐, 정제, 수성 현탁액 등의 경구형 제형, 외용제, 좌제 및 멸균 주사용액의 형태로 제형화하여 투여할 수 있다. 또한, 본 발명에서는 상기 수지상 세포 외에 약제적으로 허용 가능한 담체를 함께 투여할 수 있다. 약학적으로 허용되는 담체는 경구 투여 시에는 결합제, 활탁제, 붕해제, 부형제, 가용화제, 분산제, 안정화제, 현탁화제, 색소, 향료 등을 사용할 수 있으며, 주사제의 경우에는 완충제, 보존제, 무통화제, 가용화제, 등장제, 안정화제 등을 혼합하여 사용할 수 있으며, 국소투여용의 경우에는 기제, 부형제, 윤활제, 보존제 등을 사용할 수 있다. 또한, 본 발명에서 상기 분비 단백체를 약학적으로 허용되는 담체와 혼합하여 다양하게 제조될 수 있다. 예를 들어, 경구 투여시에는 정제, 트로키, 캡슐, 엘릭서(elixir), 서스펜션, 시럽, 웨이퍼 등의 형태로 제조할 수 있으며, 주사제의 경우에는 단위 투약 앰플 또는 다수회 투약 형태로 제조할 수 있다. 기타, 용액, 현탁액, 정제, 캡슐, 서방형 제제 등으로 제형할 수 있다. 한편, 제제화에 적합한 담체, 부형제 및 희석제의 예로는, 락토즈, 덱스트로즈, 수크로즈, 솔비톨, 만니톨, 자일리톨, 에리스리톨, 말디톨, 전분, 아카시아 고무, 알지네이트, 젤라틴, 칼슘 포스페이트, 칼슘 실리케이트, 셀룰로즈, 메틸 셀룰로즈, 미정질 셀룰로즈, 폴리비닐피롤리돈, 물, 메틸하이드록시벤조에이트, 프로필하이드록시벤조에이트, 탈크, 마그네슘 스테아레이트 또는 광물유 등이 사용될 수 있다. 또한, 충진제, 항응집제, 윤활제, 습윤제, 향료, 유화제, 방부제 등을 추가로 포함할 수 있다. 톨 유사 수용체 작용제(toll-like receptor agonist, TLR agonist)를 이용한 면역원성 수지상 세포의 유도 본 발명의 발명자들은 골수 세포(bone marrow cells)에 톨 유사 수용체 작용제(toll-like receptor agonist, TLR agonist)를 처리하여 유도된 단핵구 골수유래 면역반응 억제세포(monocytic myeloid-derived suppressor cells, M-MDSCs)에 성장인자를 처리하는 경우 미접촉 T 세포(naive T cell)를 Th1 세포로 분화를 유도할 수 있는 면역원성 수지상 세포가 유도되는 것을 발견하여 본 발명에 이르게 되었다. 본 발명의 일 구현 예에 따르면, (1) 골수 세포에 톨 유사 수용체 작용제(toll-like receptor agonist, TLR agonist)를 처리하여 골수유래 면역반응 억제세포(myeloid-derived suppressor cells, MDSCs)로 분화를 유도하는 단계; 및 (2) 분화 유도된 골수유래 면역반응 억제세포에 성장인자를 처리하여 수지상 세포로 분화를 유도하는 단계를 포함하는, 수지상 세포의 제조 방법에 관한 것이다. 구체적으로, 본 발명에서는 상기 (1) 단계로, 골수 세포에 톨 유사 수용체 작용제를 처리하는 경우 단핵구 골수유래 면역반응 억제세포(monocytic myeloid-derived suppressor cells, M-MDSCs)로의 분화를 유도할 수 있다. 본 발명에서 상기 골수 세포에 처리되는 톨 유사 수용체 작용제로는 세포 내부에 존재하는 톨 유사 수용체(intracellular Toll like receptor)의 작용제인 것이 바람직하나, 세포 내부에 존재하는 톨 유사 수용체의 작용제 중에서도 특히 톨 유사 수용체 7의 작용제 및 톨 유사 수용체 9의 작용제 중 1종 이상인 것이 본 발명에서 목적하는 특성을 갖는 수지상 세포의 분화 유도를 위하여 더욱 바람직하다. 본 명세서에서 용어, "세포 내부에 존재하는 톨 유사 수용체(intracellular Toll like receptor)"는 톨 유사 수용체를 세포 내 분포를 기준으로 분류할 때 세포 내부에 존재하는 것으로, 그 종류로는 톨 유사 수용체 3(TLR3), 톨 유사 수용체 7(TLR7), 톨 유사 수용체 8(TLR8) 및 톨 유사 수용체 9(TLR9)가 속한다. 상기한 세포 내부에 존재하는 톨 유사 수용체의 활성은 엔도솜/리소좀 구간으로의 전위에 의존하며, 그 활성을 위하여 엔도리소좀(endolysosomes) 내 산성 환경이 필수적으로 요구된다(Nishiya et al., J Biol Chem 280, 37107-17 (2005); Gibbard et al., J Biol Chem 281, 27503-11 (2006); and Ranjith-Kumar et al., J Biol Chem 282, 7668-78 (2007)). 상기 전위는 톨 유사 수용체 작용제의 노출 후 소포체 단백질 UNC93b와의 결합 후에만 발생한다(Tabeta et al., Nat Immunol 7, 156-64 (2006); Kim et al., Nature 452, 234-8 (2008); Brinkmann et al., J Cell Biol 177, 265-75 (2007); Latz et al., Nat Immunol 5, 190-8 (2004); and Park et al., Nat Immunol 9, 1407-14 (2008)). 본 명세서에서 용어, "톨 유사 수용체 7(TLR7)" 및 "톨 유사 수용체 9(TLR9)"의 정의 및 그 종류는 상기 골수유래 면역반응 억제세포의 제조 방법에서 기재된 바와 중복되어 이하 그 자세한 기재를 생략한다. 본 발명에서 상기 톨 유사 수용체 작용제는 10 ng/ml 내지 1000 ng/ml, 10 ng/ml 내지 5000 ng/ml 또는 10 ng/ml 내지 100 ng/ml의 양으로 처리될 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 톨 유사 수용체 작용제는 골수 세포의 분화 개시 이전, 분화 개시 시점 또는 분화 중에 1회 이상 처리할 수 있으나, 바람직하게는 골수 세포의 분화 개시 시점에 처리한 후, 분화 중에 1회 이상 처리할 수 있으며, 이에 제한되는 것은 아니다. 본 발명에서 상기 골수 세포의 분화는 성장인자를 포함하는 배지에 상기 골수 세포를 접종하여 5일 내지 10일, 5일 내지 7일, 또는 6일 동안 배양하며 수행될 수 있다. 또한, 본 발명에서 상기 톨 유사 수용체 작용제를 골수 세포의 분화 개시 이전에 1회 이상 처리하는 경우, 상기 작용제를 처리한 어느 일 시점으로부터 36시간, 바람직하게는 24시간 내에 상기 골수 세포에 성장인자를 처리하여 분화를 개시할 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 톨 유사 수용체 작용제를 골수 세포의 분화 개시 시점에 처리하는 경우, 톨 유사 수용체 작용제 및 성장인자가 첨가된 배지에 골수 세포를 배양하며 수행할 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 톨 유사 수용체 작용제를 골수 세포의 분화 중에 처리하는 경우, 분화 개시 시점으로부터 3일(72시간) 또는 5일(120시간) 이내에 1회 이상 처리할 수 있으나, 이에 제한되는 것은 아니다. 본 명세서에서 용어, "분화 개시"라 함은 골수 세포의 배양 배지에 성장인자를 첨가하거나, 또는 성장인자를 포함하는 배지에 골수 세포를 접종하여 배양하는 공정을 의미할 수 있으나, 성장인자를 사용하여 골수 세포의 분화를 유도할 수 있는 것이라면 특별히 제한하지 않는다. 본 발명에서 상기 성장인자로는 골수 세포(myeloid cells)의 자극제로서, 바람직하게는 과립구-큰포식 세포 콜로니 자극 인자(granulocyte-macrophage colony stimulating factor, GM-CSF), 과립구 콜로니 자극 인자(granulocyte colony stimulating factor, G-CSF), 큰포식 세포 콜로니 자극 인자(macrophage colony stimulating factor, M-CSF), 줄기세포 인자(stem cell factor, SCF), FMS-유사 티로신 키네이즈 3(FMS-like tyrosine kinase 3, Flt3) 및 인터루킨 3(interlukin 3, IL-3)로 이루어진 군에서 선택된 1종 이상일 수 있고, 보다 바람직하게는 과립구-큰포식 세포 콜로니 자극 인자(granulocyte-macrophage colony stimulating factor, GM-CSF)일 수 있다. 본 발명에서 상기 성장인자는 10 ng/ml 내지 500 ng/ml, 10 ng/ml 내지 100 ng/ml 또는 10 ng/ml 내지 50 ng/ml의 양으로 처리될 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 (1) 단계로, 성장인자를 사용하여 골수 세포의 분화를 개시하는 시점과 분화 중에, 톨 유사 수용체 7 작용제 및 톨 유사 수용체 9 작용제 중 1종 이상을 처리하는 경우, 상기한 골수 세포로부터 CD11c-CD11b+Ly6G-Ly6C+PDCA-1+ 세포 표현형을 가지는 단핵구 골수유래 면역반응 억제세포(monocytic myeloid-derived suppressor cells, M-MDSCs)가 유도될 수 있다. 본 발명에서 상기와 같이 톨 유사 수용체 7 작용제 또는 톨 유사 수용체 9 작용제를 처리하여 유도된 단핵구 골수유래 면역반응 억제세포는, 그 외의 다른 종류의 톨 유사 수용체 작용제(예를 들면, 톨 유사 수용체 2 작용제, 톨 유사 수용체 8 작용제 등)를 처리하여 유도된 단핵구 골수유래 면역반응 억제세포와는 달리 PDCA-1의 발현 수준이 높고, CD124의 발현 수준은 낮으며, 지질다당류(lipopolysaccharide, LPS)와 인터페론-γ(IFN-gamma)로 자극 시 NOS2, 알기나제-1(arginase-1, Arg-1) 및 IL-10를 두드러지게 높은 수준으로 발현하는 특성을 가진다. 본 발명에서는 상기와 같이 단핵구 골수유래 면역반응 억제세포가 얻어지면, 상기 (2) 단계로, 상기 단핵구 골수유래 면역반응 억제세포에 성장인자를 처리하여 수지상 세포로의 분화를 유도할 수 있다. 본 발명에서 상기 성장인자는 과립구-큰포식 세포 콜로니 자극 인자(granulocyte-macrophage colony stimulating factor, GM-CSF), 과립구 콜로니 자극 인자(granulocyte colony stimulating factor, G-CSF), 큰포식 세포 콜로니 자극 인자(macrophage colony stimulating factor, M-CSF), 줄기세포 인자(stem cell factor, SCF), FMS-유사 티로신 키네이즈 3(FMS-like tyrosine kinase 3, Flt3) 및 인터루킨 3(interlukin 3, IL-3)로 이루어진 군에서 선택된 1종 이상일 수 있으나, 바람직하게는 과립구-큰포식 세포 콜로니 자극 인자(granulocyte-macrophage colony stimulating factor, GM-CSF)일 수 있다. 또한, 본 발명에서 상기 성장인자는 10 ng/ml 내지 500 ng/ml, 10 ng/ml 내지 100 ng/ml 또는 10 ng/ml 내지 50 ng/ml의 양으로 처리될 수 있다. 또한, 본 발명에서 상기 성장인자는 12시간 내지 7일 동안 처리될 수 있고, 바람직하게는 24시간 내지 5일, 보다 바람직하게는 3일 내지 5일 동안 처리될 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 상기 (2)의 단계로, CD11c-CD11b+Ly6G-Ly6C+PDCA-1+ 세포 표현형을 가지는 단핵구 골수유래 면역반응 억제세포에 성장인자를 처리함에 따라 면역원성(immunogenic) 수지상 세포의 분화를 유도할 수 있다. 본 발명에서 상기와 같이 얻어진 수지상 세포는 세포 표현형으로 CD64 및 CD115의 발현 수준이 높고, 지질다당류와 인터페론-γ로 자극 시 IL-12p70, TNF-α, IL-6, IL-10 및 NO2의 발현 수준이 유의적으로 증가한다. 또한, 본 발명의 수지상 세포로 T 세포를 자극하는 경우 T 세포의 INF-γ의 분비능이 증가되고, 미접촉 T 세포를 Th1 세포로 분화를 유도하여 면역원성을 높일 수 있다. 이러한 특성을 바탕으로, 본 발명의 다른 구현 예에 따르면, 상기 수지상 세포를 포함하는 면역 치료제에 관한 것이다. 본 발명에 따른 면역 치료제는 면역 반응을 증가시키거나, 특정 질병, 감염 또는 질환의 치료 또는 예방에 바람직한 면역 반응의 일부를 선택적으로 상승시킬 수 있다. 본 발명의 또 다른 구현 예에 따르면, 상기 수지상 세포를 포함하는 항종양 백신 또는 종양치료용 약학적 조성물에 관한 것이다. 종양에 잠재성 항원이 풍부하고 이러한 종양이 수지상 세포에 의해 제시되면 면역원성을 갖는다는 사실에 기초하여, 본 발명에 따른 수지상 세포는 종양 예방을 위한 항종양 백신 또는 종양 치료제로 사용될 수 있다. 본 발명에 따른 수지상 세포를 통해 객체의 면역원성을 증가시킬 수 있으므로, 이를 통해 객체 내 종양의 증식 및/또는 전이를 예방 또는 억제할 수 있다. 본 발명에서 상기 종양은 간암, 담도암, 담낭암, 식도암, 위암, 난소암, 유방암, 자궁암, 결장암, 직장암, 자궁경부암, 전립선암, 피부암, 췌장암, 백혈병, 림프종, 호지킨병, 폐암, 기관지암, 다발성 골수종, 백혈병, 림프종, 편평세포암, 신장암, 요도암, 방광암, 두경부암, 뇌암 및 중추신경계 암으로 이루어진 군에서 선택된 1종 이상일 수 있으나, 이에 제한되는 것은 아니다. 본 발명에 사용 가능한 수지상 세포 백신의 항원으로는 막투과 펩타이드와 결합할 수 있는 모든 항원으로, 불활성화 종양세포, 유전자 재조합 방법에 의해 제조된 종양세포 관련 유전자, 펩타이드 또는 단백질을 포함할 수 있다. 유전자 재조합 방법에 의해 상기 항원을 수득하고자 하는 경우, 상기 항원을 인코딩하는 뉴클레오타이드 서열은 공지일 수 있으며, 공지된 서열의 전장을 이용할 수 있으나, 전장의 일부를 이용할 수도 있다. 상기 항원을 인코딩하는 뉴클레오타이드 서열을 벡터에 클로닝하여 목적하는 항원이 발현되도록 할 수 있다. 본 발명에 따른 항종양 백신은 일회 투여함으로써 수행되는 면역화 방법과 연속 투여함으로써 수행되는 면역화 방법을 모두 포함할 수 있다. 본 발명에서 상기 면역 치료제, 항종양 백신 또는 종양치료용 약학적 조성물의 투여 경로는 목적 조직에 도달할 수 있는 한 어떠한 일반적인 경로를 통하여 투여될 수 있다. 비경구 투여, 예를 들어, 복강 내 투여, 정맥 내 투여, 근육 내 투여, 피하 투여, 피 내 투여될 수 있으나, 이에 제한되지는 않는다. 상기 조성물은 세포 치료에 일반적으로 사용되는 약학적 담체와 함께 적합한 형태로 제형화될 수 있다. '약학적으로 허용되는' 이란 생리학적으로 허용되고 인간에게 투여될 때, 통상적으로 위장 장애, 현기증 등과 같은 알레르기 반응 또는 이와 유사한 반응을 일으키지 않는 조성물을 말한다. 약학적으로 허용되는 담체로는 예를 들면, 물, 적합한 오일, 식염수, 수성 글루코스 및 글리콜 등과 같은 비경구 투여용 담체 등이 있으며 안정화제 및 보존제를 추가로 포함할 수 있다. 적합한 안정화제로는 아황산수소나트륨, 아황산나트륨 또는 아스코르브산과 같은 항산화제가 있다. 적합한 보존제로는 벤즈알코늄 클로라이드, 메틸- 또는 프로필-파라벤 및 클로로부탄올이 있다. 그 밖의 약학적으로 허용되는 담체로는 다음의 문헌에 기재되어 있는 것을 참고로 할 수 있다(Remington's Pharmaceutical Sciences, 19th ed., Mack Publishing Company, Easton, PA, 1995). 또한, 본 발명에서 상기 면역 치료제는 표적 세포로 이동할 수 있는 임의의 장치에 의해 투여될 수도 있다. 본 발명의 면역 치료제, 항종양 백신 또는 종양치료용 약학적 조성물은 질환의 치료를 위하여 치료학적으로 유효한 양의 수지상 세포를 포함할 수 있다. 치료학적으로 유효한 양(therapeutically effective amount)은 연구자, 수의사, 의사 또는 기타 임상에 의해 생각되는 조직계, 동물 또는 인간에서 생물학적 또는 의학적 반응을 유도하는 유효 성분 또는 약학적 조성물의 양을 의미하는 것으로, 이는 치료되는 질환 또는 장애의 증상의 완화를 유도하는 양을 포함한다. 본 발명의 면역 치료제, 항종양 백신 또는 종양치료용 약학적 조성물에 포함되는 수지상 세포의 함량(수)은 원하는 효과에 따라 변화될 것임은 당업자에게 자명하다. 그러므로 최적의 세포 치료제 함량은 당업자에 의해 쉽게 결정될 수 있으며, 질환의 종류, 질환의 중증도, 조성물에 함유된 다른 성분의 함량, 제형의 종류, 및 환자의 연령, 체중, 일반 건강 상태, 성별 및 식이, 투여 시간, 투여 경로 및 조성물의 분비율, 치료 기간, 동시 사용되는 약물을 비롯한 다양한 인자에 따라 조절될 수 있으나, 예를 들면, 2x104 cells/ml ~ 8x107cell/ml의 수지상 세포가 포함될 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 본 발명의 면역 치료제, 항종양 백신 또는 종양치료용 약학적 조성물은 직장, 정맥 내, 동맥 내, 복강 내, 근육 내, 흉골 내, 경피, 국소, 안구 내 피하 또는 피 내 경로를 통해 통상적인 방식으로 투여할 수 있다. 본 발명의 또 다른 구현 예에 따르면, 종양을 예방 또는 치료하기 위하여, 목적하는 개체에 본 발명에서 제공하는 수지상 세포 또는 본 발명에서 제공하는 약학적 조성물을 투여하는 단계를 포함하는, 종양의 예방 또는 치료 방법에 관한 것이다. 본 발명에서 상기 "목적하는 개체"란, 종양이 발병하였거나, 발병 가능성이 높은 개체를 의미한다. 본 발명에서 상기 종양은 간암, 담도암, 담낭암, 식도암, 위암, 난소암, 유방암, 자궁암, 결장암, 직장암, 자궁경부암, 전립선암, 피부암, 췌장암, 백혈병, 림프종, 호지킨병, 폐암, 기관지암, 다발성 골수종, 백혈병, 림프종, 편평세포암, 신장암, 요도암, 방광암, 두경부암, 뇌암 및 중추신경계 암으로 이루어진 군에서 선택된 1종 이상일 수 있으나, 이에 제한되는 것은 아니다. 본 발명에서 제공하는 수지상 세포의 투여량, 스케줄 및 투여 경로는 개체의 크기 및 조건에 따라, 그리고 표준 약학적 관행에 따라 결정될 수 있다. 예시적인 투여 경로는 정맥내, 동맥내, 복강내, 폐내, 혈관내, 근육내, 기관내, 피하, 안내, 척수강내 또는 경피를 포함한다. 개체에 투여되는 수지상 세포의 용량은, 예를 들어, 투여되는 수지상 세포의 특정 유형, 투여 경로 및 치료되는 종양의 특정 유형과 병기에 따라 달라질 수 있다. 상기 양은 심한 독성 또는 유해 사례없이, 종양에 대한 치료 반응과 같은 원하는 반응을 가져오기 충분해야 한다. 정제된 효소를 사용한 시험관내 검정, 세포 기반 검정, 동물 모델 또는 인체 실험과 같은 표준 방법을 사용하여 효과의 규모를 측정할 수 있다. 예를 들면, 상기 수지상 세포는 2x104 cells/ml ~ 8x107cell/ml의 세포수로 투여될 수 있으나, 이에 제한되는 것은 아니다. 또한, 본 발명에서는 상기 수지상 세포를 각각 통상의 방법에 따라 산제, 과립제, 캡슐, 정제, 수성 현탁액 등의 경구형 제형, 외용제, 좌제 및 멸균 주사용액의 형태로 제형화하여 투여할 수 있다. 또한, 본 발명에서는 상기 수지상 세포 외에 약제적으로 허용 가능한 담체를 함께 투여할 수 있다. 약학적으로 허용되는 담체는 경구 투여 시에는 결합제, 활탁제, 붕해제, 부형제, 가용화제, 분산제, 안정화제, 현탁화제, 색소, 향료 등을 사용할 수 있으며, 주사제의 경우에는 완충제, 보존제, 무통화제, 가용화제, 등장제, 안정화제 등을 혼합하여 사용할 수 있으며, 국소투여용의 경우에는 기제, 부형제, 윤활제, 보존제 등을 사용할 수 있다. 또한, 본 발명에서 상기 분비 단백체를 약학적으로 허용되는 담체와 혼합하여 다양하게 제조될 수 있다. 예를 들어, 경구 투여시에는 정제, 트로키, 캡슐, 엘릭서(elixir), 서스펜션, 시럽, 웨이퍼 등의 형태로 제조할 수 있으며, 주사제의 경우에는 단위 투약 앰플 또는 다수회 투약 형태로 제조할 수 있다. 기타, 용액, 현탁액, 정제, 캡슐, 서방형 제제 등으로 제형할 수 있다. 한편, 제제화에 적합한 담체, 부형제 및 희석제의 예로는, 락토즈, 덱스트로즈, 수크로즈, 솔비톨, 만니톨, 자일리톨, 에리스리톨, 말디톨, 전분, 아카시아 고무, 알지네이트, 젤라틴, 칼슘 포스페이트, 칼슘 실리케이트, 셀룰로즈, 메틸 셀룰로즈, 미정질 셀룰로즈, 폴리비닐피롤리돈, 물, 메틸하이드록시벤조에이트, 프로필하이드록시벤조에이트, 탈크, 마그네슘 스테아레이트 또는 광물유 등이 사용될 수 있다. 또한, 충진제, 항응집제, 윤활제, 습윤제, 향료, 유화제, 방부제 등을 추가로 포함할 수 있다. 본 발명의 일 구현 예에 의하면, 간단하고 용이한 공정을 통하여 골수 세포로부터 면역 관용성을 갖는 골수유래 면역반응 억제세포를 높은 수율로 유도할 수 있어, 대량의 면역 관용성 골수유래 면역반응 억제세포의 안정적인 공급을 가능하도록 한다. 또한, 본 발명에서 상기와 같이 얻어진 면역 관용성 골수유래 면역반응 억제세포는 염증성 사이토카인 및 염증 유발 인자의 발현을 억제하고, T 세포의 활성을 억제하여 다양한 자가면역질환을 효과적으로 예방 또는 치료할 수 있고, 인체에 투여하는 경우 안전하다. 본 발명의 다른 구현 예에 의하면, 본 발명은 간단하고 용이한 공정을 통하여 골수 세포로부터 면역원성의 수지상 세포로의 분화가 유도될 수 있는 골수유래 면역반응 억제세포를 유도할 수 있고, 이를 이용하여 대량의 면역원성 수지상 세포 또한 안정적으로 공급할 수 있도록 한다. 본 발명에서 상기와 같이 공급되는 면역원성 수지상 세포는 미접촉 T 세포를 Th1 세포로 분화를 유도할 수 있고, 이에 따라 투여되는 객체의 면역원성을 높임으로써 항암 효과를 발휘하여 항종양 백신 또는 종양 치료용 조성물에 유용하게 사용될 수 있다. 도 1은 본 발명의 실시예 1에서 골수 세포에 TLR 작용제를 처리하는 3가지 방법의 모식도를 나타낸 것이다. 도 2는 본 발명의 실시예 1에서 골수 세포에 다양한 TLR 작용제 처리 후 CD11c+ 세포의 유도 여부를 유세포 분석기로 분석한 결과를 나타낸 것이다. 도 3은 본 발명의 실시예 1에서 골수 세포에 다양한 TLR 작용제 처리 후 CD11c+ 세포의 비율을 측정한 결과를 나타낸 것이다. 도 4는 본 발명의 실시예 1에서 골수 세포에 처리되는 TLR 작용제의 농도별 CD11c+ 세포 비율의 변화를 측정한 결과를 나타낸 것이다. 도 5는 본 발명의 실시예 2에서 C57BL/6 마우스와 C57BL/6 MyD88-/- 마우스 각각의 골수 세포에 다양한 TLR 작용제 처리 후 CD11c+MHC-Ⅱ+ 세포의 유도 여부를 유세포 분석기로 분석한 결과를 나타낸 것이다. 도 6은 본 발명의 실시예 2에서 C57BL/6 마우스와 C57BL/6 MyD88-/- 마우스 각각의 골수 세포에 다양한 TLR 작용제 처리 후 CD11c+MHC-Ⅱ+ 세포의 비율을 측정한 결과를 나타낸 것이다. 도 7은 본 발명의 실시예 3에서 골수 세포에 다양한 TLR 작용제 처리 후 분화 유도된 세포에 있어서, CD11c, CD11b, Gr-1, F4/80, Ly6C, CD4, CD8α, CD103, PDCA-1, B220, NK1.1 및 CD49b의 표현형을 분석한 결과를 나타낸 것이다. 도 8은 본 발명의 실시예 3에서 골수 세포에 다양한 TLR 작용제 처리 후 분화 유도된 세포에서 CD11c+, CD11b+, Gr-1+, F4/80+, Ly6C+, CD4+, CD8α+, CD103+, PDCA-1+, B220+, NK1.1+ 및 CD49b+ 세포의 비율을 측정한 결과를 나타낸 것이다. 도 9는 본 발명의 실시예 4에서 골수 세포에 다양한 TLR 작용제 처리 후 분화 유도된 세포에 있어서, Gr-1의 발현 수준을 유세포 분석기로 분석한 결과를 나타낸 것이다. 도 10은 본 발명의 실시예 4에서 골수 세포에 다양한 TLR 작용제 처리 후 분화 유도된 세포에 있어서, Gr-1+CD11b+CD11c-, Gr-1highCD11b+CD11c- 및 Gr-1intCD11b+CD11c- 세포의 비율을 측정한 결과를 나타낸 것이다. 도 11은 본 발명의 실시예 4에서 골수 세포에 다양한 TLR 작용제 처리 후 분화 유도된 세포에 있어서, LyG 및 LyC의 발현 수준을 유세포 분석기로 분석한 결과를 나타낸 것이다. 도 12는 본 발명의 실시예 4에서 골수 세포에 다양한 TLR 작용제 처리 후 분화 유도된 세포에 있어서, CD11c-CD11b+LyG+LyC-, CD11c-CD11b+LyG+LyCint, CD11c-CD11b+LyG-LyCint 및 CD11c-CD11b+LyG-LyChigh 세포의 비율을 측정한 결과를 나타낸 것이다. 도 13은 본 발명의 실시예 5에서 C57BL/6 마우스와 C57BL/6 MyD88-/- 마우스로부터 추출한 골수 세포에 다양한 TLR 작용제 처리 후 분화 유도된 세포에 있어서, CD11c-CD11b+LyG+LyC-, CD11c-CD11b+LyG+LyCint, CD11c-CD11b+LyG-LyCint 및 CD11c-CD11b+LyG-LyChigh 세포의 비율을 측정한 결과를 나타낸 것이다. 도 14는 본 발명의 실시예 6에서 골수 세포에 TLR2 작용제 및 TLR9 작용제의 처리 후 유도된 M-MDSCs에 LPS와 IFN-γ로 자극하면서 NO2의 형성 수준의 변화를 측정한 결과를 그래프로 나타낸 것이다. 도 15는 본 발명의 실시예 6에서 골수 세포에 TLR2 작용제 및 TLR9 작용제의 처리 후 유도된 M-MDSCs에 LPS와 IFN-γ로 자극하면서 NOS2 및 아르기나아제-1의 발현 수준의 변화를 웨스턴 블럿으로 분선한 결과를 나타낸 것이다. 도 16은 본 발명의 실시예 6에서 골수 세포에 TLR2 작용제 및 TLR9 작용제의 처리 후 유도된 M-MDSCs에 LPS와 IFN-γ로 자극하면서 IL-10의 발현 수준의 변화를 측정한 결과를 그래프로 나타낸 것이다. 도 17은 본 발명의 실시예 6에서 골수 세포에 TLR2 작용제 및 TLR9 작용제의 처리 후 유도된 M-MDSCs에 LPS와 IFN-γ로 자극하면서 아르기나아제-1(Arg-1) 및 iNOS의 발현 수준의 변화를 FACS로 분석한 결과를 나타낸 것이다. 도 18은 본 발명의 실시예 6에서 골수 세포에 TLR2 작용제 및 TLR9 작용제의 처리 후 유도된 M-MDSCs에 LPS와 IFN-γ로 자극하면서 아르기나아제-1(Arg-1) 및 iNOS의 발현 수준과, Arg-1/iNOS의 발현 수준의 비율의 변화를 측정한 결과를 그래프로 나타낸 것이다. 도 19는 본 발명의 실시예 6에서 골수 세포에 TLR2 작용제 및 TLR9 작용제의 처리 후 유도된 M-MDSCs에 있어서, CD124, CD115, F4/80 및 PDCA-1의 발현 수준을 유세포 분석기로 분석한 결과를 나타낸 것이다. 도 20은 본 발명의 실시예 6에서 골수 세포에 TLR2 작용제 및 TLR9 작용제의 처리 후 유도된 M-MDSCs에 있어서, CD124, CD115, F4/80 및 PDCA-1를 발현하는 세포의 비율을 측정한 결과를 그래프로 나타낸 것이다. 도 21은 본 발명의 실시예 6에서 골수 세포에 TLR2 작용제 및 TLR9 작용제의 처리 후 유도된 M-MDSCs를 LPS와 IFN-γ로 자극하면서 TNF-α, IL-6, IL-12p70 및 IFN-β의 발현 수준의 변화를 그래프로 나타낸 것이다. 도 22는 본 발명의 실시예 6에서 골수 세포에 TLR2 작용제 및 TLR9 작용제의 처리 후 유도된 M-MDSCs를 LPS와 IFN-γ로 자극하면서 PD-L1, PD-L2, Tim-3, FasL 및 IDO의 발현 수준의 변화를 FACS로 분석한 결과를 나타낸 것이다. 도 23은 본 발명의 실시예 6에서 골수 세포에 TLR2 작용제 및 TLR9 작용제의 처리 후 유도된 M-MDSCs를 LPS와 IFN-γ로 자극하면서 PD-L1, PD-L2, Tim-3, FasL 및 IDO를 발현하는 세포의 비율을 측정한 결과를 그래프로 나타낸 것이다. 도 24는 본 발명의 실시예 6에서 골수 세포에 TLR2 작용제 및 TLR9 작용제의 처리 후 유도된 M-MDSCs를 LPS와 IFN-γ로 자극하면서 PD-L1, PD-L2, Tim-3, FasL 및 IDO의 발현 수준의 변화를 FACS로 분석한 결과를 나타낸 것이다. 도 25는 본 발명의 실시예 7에서 골수 세포에 3 method로 TLR2 작용제를 처리한 후 유도된 M-MDSCs를 OVA-pulsed DC와 CD4 T 세포의 공배양물에 처리한 후 T 세포 억제능을 확인한 결과를 나타낸 것이다. 도 26은 본 발명의 실시예 7에서 골수 세포에 3 method로 TLR9 작용제를 처리한 후 유도된 M-MDSCs를 OVA-pulsed DC와 CD4 T 세포의 공배양물에 처리한 후 T 세포 억제능을 확인한 결과를 나타낸 것이다. 도 27은 본 발명의 실시예 7에서 골수 세포에 3 method로 TLR2 작용제를 처리한 후 유도된 M-MDSCs를 OVA-pulsed DC와 CD4 T 세포의 공배양물에 처리한 후 T 세포의 증식능의 변화를 측정한 결과를 그래프로 나타낸 것이다. 도 28은 본 발명의 실시예 7에서 골수 세포에 3 method로 TLR9 작용제를 처리한 후 유도된 M-MDSCs를 OVA-pulsed DC와 CD4 T 세포의 공배양물에 처리한 후 T 세포의 증식능의 변화를 측정한 결과를 그래프로 나타낸 것이다. 도 29는 본 발명의 실시예 7에서 골수 세포에 3 method로 TLR2 작용제를 처리한 후 유도된 M-MDSCs를 OVA-pulsed DC와 CD4 T 세포의 공배양물에 처리한 후 Foxp3의 발현 수준을 유세포 분석기로 분석한 결과를 나타낸 것이다. 도 30은 본 발명의 실시예 7에서 골수 세포에 3 method로 TLR9 작용제를 처리한 후 유도된 M-MDSCs를 OVA-pulsed DC와 CD4 T 세포의 공배양물에 처리한 후 Foxp3의 발현 수준을 유세포 분석기로 분석한 결과를 나타낸 것이다. 도 31은 본 발명의 실시예 7에서 골수 세포에 3 method로 TLR2 작용제를 처리한 후 유도된 M-MDSCs를 OVA-pulsed DC와 CD4 T 세포의 공배양물에 처리한 후 조절 T 세포의 비율을 측정한 결과를 그래프로 나타낸 것이다. 도 32는 본 발명의 실시예 7에서 골수 세포에 3 method로 TLR9 작용제를 처리한 후 유도된 M-MDSCs를 OVA-pulsed DC와 CD4 T 세포의 공배양물에 처리한 후 조절 T 세포의 비율을 측정한 결과를 그래프로 나타낸 것이다. 도 33은 본 발명의 실시예 8에서 골수 세포에 3 method로 TLR2 작용제 및 TLR9 작용제를 처리하여 얻어진 M-MDSCs에 GM-CSF 처리를 하여 유도된 세포에 있어서 CD11c 및 MHC-Ⅱ의 발현 수준을 유세포 분석기로 분석한 결과를 나타낸 것이다. 도 34는 본 발명의 실시예 8에서 골수 세포에 3 method로 TLR2 작용제 및 TLR9 작용제를 처리하여 얻어진 M-MDSCs에 GM-CSF 처리를 하여 유도된 세포를 LPS와 IFN-γ로 자극하면서 CD11c+MHC-Ⅱ+ 세포의 비율의 변화를 측정한 결과를 그래프로 나타낸 것이다. 도 35는 본 발명의 실시예 8에서 골수 세포에 3 method로 TLR2 작용제 및 TLR9 작용제를 처리하여 얻어진 M-MDSCs에 M-CSF 처리를 하여 유도된 세포에 있어서 CD11b 및 F4/80의 발현 수준을 유세포 분석기로 분석한 결과를 나타낸 것이다. 도 36은 본 발명의 실시예 8에서 골수 세포에 3 method로 TLR2 작용제 및 TLR9 작용제를 처리하여 얻어진 M-MDSCs에 M-CSF 처리를 하여 유도된 세포를 LPS와 IFN-γ로 자극하면서 F4/80+CD11b+ 세포의 비율의 변화를 측정한 결과를 그래프로 나타낸 것이다. 도 37은 본 발명의 실시예 8에서 골수 세포에 3 method로 TLR2 작용제 및 TLR9 작용제를 처리하여 얻어진 M-MDSCs에 GM-CSF를 첨가하여 배양하며 T 세포의 증식 억제능을 분석한 결과를 나타낸 것이다. 도 38은 본 발명의 실시예 8에서 골수 세포에 3 method로 TLR2 작용제 및 TLR9 작용제를 처리하여 얻어진 M-MDSCs에 GM-CSF를 첨가하여 배양하며 T 세포의 증식 억제능과 IFN-γ의 분비능의 변화를 측정한 결과를 그래프로 나타낸 것이다. 도 39는 본 발명의 실시예 8에서 골수 세포에 3 method로 TLR2 작용제 및 TLR9 작용제를 처리하여 얻어진 M-MDSCs에 GM-CSF를 첨가하며 배양하여 유도된 세포 중 CD11c+ 세포의 비율을 측정한 결과를 그래프로 나타낸 것이다. 도 40은 본 발명의 실시예 9에서 골수 세포에 3 method로 TLR2 작용제 및 TLR9 작용제를 처리하여 얻어진 M-MDSCs에 GM-CSF 처리를 하여 유도된 세포와, 골수 유래 수지상 세포, Ly6+ 세포 유래 수지상 세포에서 CD11c, PDCA-1, CD115, CCR2, MHC-Ⅱ, CD64, CD11b 및 Ly6C의 발현 수준을 유세포 분석기로 분석한 결과를 나타낸 것이다. 도 41은 본 발명의 실시예 9에서 골수 세포에 3 method로 TLR2 작용제 및 TLR9 작용제를 처리하여 얻어진 M-MDSCs에 GM-CSF 처리를 하여 유도된 세포와, 골수 유래 수지상 세포, Ly6+ 세포 유래 수지상 세포에서 Ly6C+, MerTK+, CD11b+, CCR2+ 및 PDCA-1+ 세포의 비율을 측정한 결과를 그래프로 나타낸 것이다. 도 42는 본 발명의 실시예 9에서 골수 세포에 3 method로 TLR2 작용제 및 TLR9 작용제를 처리하여 얻어진 M-MDSCs에 GM-CSF 처리를 하여 유도된 수지상 세포와, 골수 유래 수지상 세포, Ly6+ 세포 유래 수지상 세포를 LPS 및/또는 IFN-γ로 자극하면서 TNF-α, IL-6, IL-10, IL-12p70 및 NO2의 발현 수준의 변화를 그래프로 나타낸 것이다. 도 43은 본 발명의 실시예 9에서 골수 세포에 3 method로 TLR2 작용제 및 TLR9 작용제를 처리하여 얻어진 M-MDSCs에 GM-CSF 처리를 하여 유도된 수지상 세포와, 골수 유래 수지상 세포, Ly6+ 세포 유래 수지상 세포를 LPS 및/또는 IFN-γ로 자극하면서 IFN-γ, IL-2, IL-10, IL-5 및 IL-17A의 발현 수준의 변화를 그래프로 나타낸 것이다. 도 44는 본 발명의 실시예 9에서 골수 세포에 3 method로 TLR2 작용제 및 TLR9 작용제를 처리하여 얻어진 M-MDSCs에 GM-CSF 처리를 하여 유도된 수지상 세포와, 골수 유래 수지상 세포, Ly6+ 세포 유래 수지상 세포를 CD4 T 세포에 처리한 후 T 세포 증식능과 IFN-γ의 발현 수준의 변화를 그래프로 나타낸 것이다. 도 45는 본 발명의 실시예 10에서 골수 세포에 3 method로 TLR2 작용제 및 TLR9 작용제를 처리한 후 분화 초기(TLR 자극 후 8, 18 및 36시간)에 유도되는 TNF-α, IL-6, PGE2, IFN-α 및 IFN-β 사이토카인의 발현 수준을 분석한 결과를 그래프로 나타낸 것이다. 도 46은 본 발명의 실시예 11에서 골수 세포에 3 method로 TLR 작용제 대신에 TNF-α, IL-6, PGE2, IFN-α 및 IFN-β를 처리한 후 얻어진 M-MDSCs와 수지상 세포의 비율을 그래프로 나타낸 것이다. 도 47은 본 발명의 실시예 11에서 골수 세포에 3 method로 TLR 작용제 대신에 TNF-α, IL-6, PGE2, IFN-α 및 IFN-β를 처리한 후 각 처리 농도 별 CD11c-CD11b+Ly6G-Ly6C+PDCA-1+ 및 CD11c-CD11b+Ly6G-Ly6C+PDCA-1-의 비율을 그래프로 나타낸 것이다. 도 48은 본 발명의 실시예 12에서 골수 세포에 3 method로 TLR9 작용제와 함께 재조합 IL-6 단백질과 IL-6 수용체 차단제를 처리한 후 수확된 세포 중 MDSCs와 수지상 세포의 비율의 변화를 그래프로 나타낸 것이다. 도 49는 본 발명의 실시예 12에서 골수 세포에 3 method로 TLR9 작용제와 함께 재조합 IL-6 단백질과 IL-6 수용체 차단제를 처리한 후 유도된 M-MDSCs에 GM-CSF를 처리한 후 CD11c+ 세포의 유도 비율을 그래프로 나타낸 것이다. 도 50은 본 발명의 실시예 13에서 골수 세포에 3 method로 TLR2 작용제, TLR9 작용제 또는 IFN-β를 처리하여 유도된 Ly6C+ M-MDSCs에 GM-CSF를 처리한 후 각 처리 별 CD11c+ 세포 비율을 그래프로 나타낸 것이다. 도 51은 본 발명의 실시예 13에서 골수 세포에 3 method로 TLR2 작용제와 IFN-β를 5 ng/ml 또는 25 ng/ml로 추가로 처리하여 유도된 Ly6C+ M-MDSCs에 GM-CSF를 처리한 후 각 처리 별 CD11c+ 세포 비율을 그래프로 나타낸 것이다. 도 52는 본 발명의 실시예 13에서 야생형 및 Ⅰ형 IFN 수용체 넉아웃 마우스로부터 채취한 골수 세포에 3 method로 TLR9 작용제를 처리한 뒤 PDCA-1+ M-MDSCs와 수지상 세포의 비율을 그래프로 나타낸 것이다. 본 발명의 일 구현 예에 따르면, 골수 세포에 톨 유사 수용체 작용제(toll-like receptor agonist, TLR agonist)를 처리하여 골수유래 면역반응 억제세포(myeloid-derived suppressor cells, MDSCs)로 분화를 유도하는 단계를 포함하는, 골수유래 면역반응 억제세포의 제조 방법에 관한 것이다. 여기서 상기 골수 세포에 처리되는 톨 유사 수용체 작용제로는 세포 막(plasma membrane)에 존재하는 톨 유사 수용체(exogenous Toll like receptor)의 작용제로, 톨 유사 수용체 2의 작용제 및 톨 유사 수용체 4의 작용제 중 1종 이상인 것이 본 발명에서 목적하는 특성을 갖는 안정적인 면역 관용성 골수유래 면역반응 억제세포의 분화 유도를 위하여 바람직하다. 다만, 본 발명에서 상기 골수 세포에 세포 내부, 특히 엔도리소좀 기관(endolysosomal compartment)에 존재하는 톨 유사 수용체(intracellular Toll like receptor)로, 예를 들어 톨 유사 수용체 7의 작용제 및 톨 유사 수용체 9의 작용제 중 1종 이상을 처리하는 경우, 인터루킨 6(interleukin 6)를 함께 처리함으로써 본 발명에서 목적하는 안정적인 면역 관용성 골수유래 면역반응 억제세포의 분화를 유도할 수 있다. 본 발명의 다른 구현 예에 따르면, 골수 세포에 Ⅰ형 인터페론(type Ⅰ interferon)을 처리하여 골수유래 면역반응 억제세포(myeloid-derived suppressor cells, MDSCs)로 분화를 유도하는 단계를 포함하는, 골수유래 면역반응 억제세포의 제조 방법에 관한 것이다. 여기서 상기 골수 세포에 처리하는 Ⅰ형 인터페론으로는 IFN-α, IFN-β, IFN-κ 및 IFN-ω으로 이루어진 군에서 선택된 1종 이상일 수 있고, 바람직하게는 IFN-α 및 IFN-β 중 1종 이상일 수 있으며, 보다 바람직하게는 IFN-β일 수 있다. 본 발명의 또 다른 구현 예에 따르면, (1) 골수 세포에 톨 유사 수용체 작용제(toll-like receptor agonist, TLR agonist)를 처리하여 골수유래 면역반응 억제세포(myeloid-derived suppressor cells, MDSCs)로 분화를 유도하는 단계; 및 (2) 분화 유도된 골수유래 면역반응 억제세포에 성장인자를 처리하여 수지상 세포로 분화를 유도하는 단계를 포함하는, 수지상 세포의 제조 방법에 관한 것이다. 여기서 상기 골수 세포에 처리되는 톨 유사 수용체 작용제로는 세포 내부에 존재하는 톨 유사 수용체(intracellular Toll like receptor)의 작용제인 것이 바람직하나, 세포 내부에 존재하는 톨 유사 수용체의 작용제 중에서도 특히 톨 유사 수용체 7의 작용제 및 톨 유사 수용체 9의 작용제 중 1종 이상인 것이 본 발명에서 목적하는 특성을 갖는 수지상 세포의 분화 유도를 위하여 더욱 바람직하다. 이하, 실시예를 통하여 본 발명을 더욱 상세히 설명하고자 한다. 이들 실시예는 오로지 본 발명을 보다 구체적으로 설명하기 위한 것으로서, 본 발명의 요지에 따라 본 발명의 범위가 이들 실시예에 의해 제한되지 않는다는 것은 당업계에서 통상의 지식을 가진 자에게 있어서 자명할 것이다. 실시예 [실시예 1] 골수 세포에 톨 유사 수용체 작용제의 처리 C57BL/6 마우스로부터 골수 채취용 주사를 이용하여 대퇴부 골수 세포(whole bone marrow cells)를 채취하였다. 채취한 골수 세포를 PBS로 세척한 후 적혈구 용혈 버퍼(Sigma Aldrich)를 사용하여 적혈구(red blood cells, RBCs)를 제거하였다. 상기 골수 세포를 6 웰 플레이트(1X106 세포/ml; 2 ml/웰)에 분주하고 100 U/mL 페니실린/스트렙토마이신 (Lonza, Basel, Switzerland), 10% 우태아 혈청 (Lonza), 50 μM 머캅토에탄올 (Lonza), 0.1 mM 비필수 아미노산 (Lonza) 및 GM-CSF (20 ng/mL)로 보충된 완전-RPMI 1640 (c-RPMI 1640) 배지에서 5% CO2 분위기 및 37℃의 온도 조건 하에서 배양하였다. 단, 도 1에 나타낸 바와 같이, TLR2 작용제(Pam3CSK4), TLR3 작용제(poly I:C), TLR4 작용제(LPS, from Escherichia coli O111:B4), TLR7 작용제(이미퀴모드, R837) 및 TLR9 작용제(ODN1826) 각각을 50 ng/ml의 양으로 분화 개시 시점(1 method), 분화 개시 후 3일 째(2 method), 또는 분화 개시 시점과 분화 개시 후 3일 째(3 method)에 배지에 첨가하였다. 배양 3일 째에 웰에 골수 세포와 c-RPMI 1640 배지 1 ml를 추가하였다. 배양 6일 째에 세포를 수집하고, 플루오레세인(Fluorescein) 컨쥬게이트된 CD11c mAb로 염색하여 CD11c+ 세포의 비율을 측정하여 도 2 및 3에 나타내었다. 그 결과, TLR2 작용제, TLR4 작용제, TLR7 작용제 및 TLR9 작용제를 3 method로 처리한 경우 수지상 세포의 억제능이 강력하게 유도되었다. 또한, 3 method에 의하되 각 TLR 작용제의 처리 농도 별(TLR2 작용제 (Pam3) - 1, 10, 50 ng/ml; TLR3 작용제 (Poly I:C) - 10, 100, 500 ng/ml; TLR4 작용제 (LPS) - 1, 10, 50 ng/ml; TLR7 작용제 (Imiqumoid) - 1, 10, 50 ng/ml; TLR9 작용제 (CPG:ODN) - 1, 10, 50 ng/ml) CD11c+ 세포 비율을 확인하였다. 그 결과, 도 4에 나타낸 바와 같이, 처리되는 TLR 작용제의 농도 의존적으로 수지상 세포의 분화가 억제되는 것을 볼 수 있었다. 하지만, TLR3 작용제를 처리한 경우는 수지상 세포 분화 억제 효과가 관찰되지 않았다. [실시예 2] 수지상 세포의 분화 억제와 MyD88의 관계 확인 추가적으로 수지상 세포 분화의 억제 효과가 MyD88 의존적으로 유도되는 지 확인하기 위하여, C57BL/6 마우스와 C57BL/6 MyD88-/- 마우스에 대하여 상기 실시예 1의 3 method와 동일한 방법으로 TLR 작용제를 처리하여 분화를 유도한 뒤, CD11c+MHC-Ⅱ+ 세포의 비율을 측정하여 그 결과를 도 5 및 6에 나타내었다. 도 5 및 6에서 보는 바와 같이, TLR3 작용제를 처리한 경우를 제외하고, TLR2 작용제, TLR4 작용제, TLR7 작용제 및 TLR9 작용제를 처리하자 CD11c+MHC-Ⅱ+ 세포의 비율이 감소하였으나, MyD88를 넉아웃 시킨 경우 CD11c+MHC-Ⅱ+ 세포의 비율이 80% 이상 유지되어, 수지상 세포로의 분화가 유도됨을 볼 수 있었다. 이를 통하여 수지상 세포로의 분화는 MyD88 의존적으로 유도된다는 것을 확인할 수 있었다. [실시예 3] TLR 자극에 의해 유도되는 세포의 표현형 분석 상기 실시예 1에서 3 method와 동일한 방법으로 골수 세포에 TLR 작용제를 처리하여 6일간 배양 후 수확된 세포의 표현형을 분석한 결과를 도 7 및 8에 나타내었다. 그 결과, TLR 자극으로 유도된 세포들은 수지상 세포의 표현형(CD11c, CD4, CD103, CD8a)은 모두 감소한 반면, Gr-1, Ly6C, CD11b의 발현은 높게 유도된 것을 확인할 수 있었다. 이러한 발현 양상을 통하여 골수 세포로부터 분화 유도된 세포가 골수유래 면역반응 억제세포(myeloid-derived suppressor cells, MDSCs)임을 예측할 수 있었다. 단, TLR 작용제 중에서 특히 TLR7 작용제와 TLR9 작용제를 처리한 경우 플라즈마사이토이드 수지상 세포(plasmacytoid dendritic cells, pDC)의 마커인 PDCA-1가 높게 유도됨을 볼 수 있었지만, pDC의 다른 마커인 B220에는 별다른 차이를 보이지 않아 pDC가 유도된 것은 아님을 알 수 있었다. 이를 통하여 TLR2 작용제 및 TLR4 작용제와, TLR7 작용제 및 TLR9 작용제의 처리 시 서로 다른 종류의 MDSCs가 유도됨을 알 수 있었다. [실시예 4] TLR 자극에 의해 유도된 MDSCs의 표현형 확인 상기 실시예 3에서 보는 바와 같이, 실시예 1의 3 method에 따라 골수 세포에 TLR 자극을 가하여 분화 유도된 세포는 MDSCs임을 알 수 있었다. 한편, 상기 MDSC의 아형은 단핵구(monocytic)-MDSC (M-MDSCs)와 과립구(Granulocytic)-MDSC (G-MDSCs)로 나눌 수 있는데, Gr-1high 세포는 대부분 G-MDSCs에 해당하고, Gr-1low은 M-MDSCs로 분류할 수 있다. 이에, Gr-1 항체를 이용하여 상기 실시예 1에서 3 method의 방법으로 6일간 배양 후 수확된 MDSCs에 대하여 Gr-1 발현 수준을 확인하여 도 9 및 10에 나타내었다. 그 결과, TLR2 작용제와 TLR4 작용제에 의해 유도된 세포들은 Gr-1low한 MDSCs가 높게 유도되었으나, 반대로 TLR7 작용제와 TLR9 작용제로 유도된 세포들은 Gr-1high한 MDSCs가 높게 유도된 것을 확인할 수 있었다. 더 나아가, MDSCs의 정확한 아형을 분류하기 위하여, Ly6G와 Ly6C 항체를 이용해 그 발현 양상을 확인한 결과, 도 11 및 12에서 보는 바와 같이 TLR의 자극에 의하여 골수 세포로부터 G-MDSC (X2 세포)와 M-MDSCs (X3 세포 및 X4 세포)가 유도되었고, 그 중에서도 M-MDSCs의 비율이 높았으나, TLR2 작용제와 TLR4 작용제 처리 시 Ly6Cint M-MDSCs (X3 세포)가, TLR7 작용제와 TLR9 작용제 처리 시 Ly6Chigh M-MDSCs (X4 세포)가 유도됨을 확인할 수 있었다. [실시예 5] MDSCs의 분화와 MyD88의 관계 확인 MDSCs 각 아형별 분화가 MyD88 의존적으로 유도되는 지 확인하기 위하여, C57BL/6 마우스와 C57BL/6 MyD88-/- 마우스에 대하여 상기 실시예 1에서 3 method와 동일한 방법으로 수행한 뒤, 상기 실시예 4와 동일한 방법으로 Ly6G와 Ly6C의 그 발현 양상을 확인하였다(도 13). 그 결과, TLR2 작용제와 TLR4 작용제 처리 시 Ly6Cint M-MDSCs (X3 세포)가 유도되고, TLR7 작용제와 TLR9 작용제 처리 시 Ly6Chigh M-MDSCs (X4 세포)가 유도되는 것은 MyD88 의존적인 것임을 알 수 있었다. [실시예 6] TLR2 작용제와 TLR9 작용제에 의해 유도되는 분자적 파라미터 실시예 4에서 보는 바와 같이 골수 세포에 대하여 3 method의 TLR 자극에 의해 분화 유도된 세포가 M-MDSCs인지를 정확히 판단하기 위하여, M-MDSCs에서 유도되는 다양한 인자들을 분석하였다. 또한, 이러한 분석에서 TLR2 작용제 및 TLR4 작용제에 의해서 유도되는 Ly6Cint M-MDSCs와, TLR7 작용제 및 TLR9 작용제에 의해서 유도되는 Ly6Chigh M-MDSCs의 기능적 차이를 확인하기 위하여 TLR2-M-MDSC와 TLR9-M-MDSC를 MACS 시스템을 이용하여 분리하였다. 여기서 M-MDSCs의 활성을 유도하기 위하여 LPS와 IFN-γ를 24시간 처리하였다. 구체적으로, NO 키트를 이용하여 NO2의 형성 수준을, 웨스턴 블럿을 통해 NOS2 및 아르기나아제-1(arginase-1)의 발현 수준을, ELISA를 통하여 IL-10의 발현 수준을 분석하여 그 결과를 각각 도 14, 15 및 16에 나타내었다. 또한, FACS를 통하여 아르기나아제-1 및 iNOS의 발현 수준을 확인하여 그 결과를 도 17 및 18에 나타내었다. 도 14 내지 18에서 보는 바와 같이, TLR2 작용제와 TLR9 작용제를 처리하여 유도된 M-MDSCs를 자극하자 항염증성 사이토카인(IL-10) 및 면역 억제물질(Arg-1, NOS)의 발현이 증가하는 것을 확인할 수 있었다. 또한, TLR2 작용제 및 TLR9 작용제를 처리한 경우 유도된 M-MDSCs의 표현형을 확인하기 위하여 CD124, CD115, F4/80 및 PDCA-1의 다양한 마커의 발현 수준을 분석한 결과, 도 19 및 20에서 보는 바와 같이 CD124는 TLR2 자극 후 유도된 M-MDSCs에서 높게 발현되었고, CD115, F4/60 및 PDCA-1은 TLR2 자극 후 유도된 M-MDSCs에서 낮게 발현되었다. 추가적으로, TLR2 작용제 및 TLR9 작용제를 처리한 경우 유도된 M-MDSCs에 있어서 ELISA를 이용하여 염증성 사이토카인의 발현 수준을 분석하여 그 결과를 도 21에 나타내었고, FACS를 이용하여 면역 억제 인자의 발현 수준을 확인하여 그 결과를 도 22 내지 24에 나타내었다. 그 결과, TLR2 작용제 처리 후 유도된 M-MDSCs는 TLR9 작용제 처리 후 유도된 M-MDSCs 보다 활성화 되었을 때 염증성 사이토카인의 발현을 억제하는 것을 확인할 수 있었다. [실시예 7] TLR2 작용제와 TLR9 작용제에 의해 유도된 M-MDSCs에 의한 T 세포의 증식 억제 및 조절 T 세포의 분화 확인 이하에서는 M-MDSCs의 또 다른 특징 중 하나는 T 세포의 증식 억제능과 조절 T 세포의 분화 유도를 확인하였다. 보다 상세하게는 OVA-pulsed DC와 OT-II 마우스의 CellTrace-labeled CD4 T 세포의 공배양(co-culture)을 통하여 T 세포를 활성화 시키고, 상기 실시예 1에서 3 method에 의해 분화 유도된 M-MDSCs를 추가한 뒤 T 세포 억제능을 확인하여 그 결과를 도 25 내지 28에 나타내었고, Foxp3의 발현 수준을 확인하여 조절 T 세포의 비율을 확인해 그 결과를 도 29 내지 32에 나타내었다. 도 25 내지 32에서 보는 바와 같이, TLR2 자극 후 유도된 M-MDSCs와 TLR9 자극 후 유도된 M-MDSCs 모두 수 의존적으로 T 세포의 증식을 억제하였고, Foxp3+ CD4 T 세포의 분화를 현저히 유도한 것을 볼 수 있었다. [실시예 8] TLR2 작용제와 TLR9 작용제에 의해 유도된 M-MDSCs의 2차 분화 차이점 평가 상기 실시예 1에서 3 method에 따라 분화 유도된 M-MDSCs 각각을 6-웰 플레이트(1X106 cells/ml; 2 ml/well)에 분주한 뒤 10% 우태아 혈청, 100 U/ml 페니실린/스트렙토마이신, 50 μM 머캅토에탄올, 0.1 mM 비필수 아미노산 및 20 ng/ml GM-CSF 또는 M-CSF가 보충된 cRPMI 1640에서 5일 동안 배양하고 세포를 수확하였다. 상기 배양으로 수지상 세포의 분화가 유도되었는지 확인하기 위하여 수지상 세포의 항-CD11c와 항-MHC-II를 염색 후 유세포분석기 FACSverse를 통하여 분석하여 그 결과를 도 33 및 34에 나타내었다. 또한, 상기 배양으로 큰포식 세포의 분화가 유도되었는지 확인하기 위하여 큰포식 세포의 항-CD11b와 항-F40/80으로 염색 후 유세포분석기 FACSverse를 통하여 분석하여 그 결과를 도 35 및 36에 나타내었다. 도 33 내지 36에서 보는 바와 같이, TLR2 작용제에 의해 유도된 M-MDSCs는 일부 큰포식 세포로 분화가 유도되었지만, 수지상 세포로는 거의 분화가 되지 않은 반면, TLR9 작용제에 의해 유도된 M-MDSCs는 수지상 세포와 큰포식 세포로 분화가 유도된 것을 확인할 수 있었다. 추가적으로 T 세포의 존재 하에서 상기 실시예 1의 3 method에 따라 분화 유도된 M-MDSCs 각각에 GM-CSF를 첨가하여 배양하며 T 세포의 증식 억제능과 수지상 세포로의 2차 분화 정도를 평가하였다. 그 결과 도 37 및 38에서 보는 바와 같이, TLR2 자극에 의해 유도된 M-MDSCs에서는 이러한 변화를 보이지 않고 지속적으로 T 세포 증식 억제 및 IFN-γ 억제능을 보인 반면, TLR9 자극에 의해 유도된 M-MDSCs는 GM-CSF 존재 시 T 세포 증식 억제능 및 IFN-γ 억제능이 현저하게 감소한 것을 볼 수 있었다. 또한, 이러한 조건에서 CD11c의 2차 분화 정도를 확인한 결과 도 39에서 보는 바와 같이 TLR2 자극에 의해 유도된 M-MDSCs는 안정적으로 세포 특성을 유지한 반면, TLR9 자극에 의해 유도된 M-MDSCs는 수지상 세포로 분화가 유도되었음을 확인할 수 있었다. 이를 통하여, TLR2 작용제에 의해 분화 유도된 M-MDSCs는 추가적으로 성장인자를 처리하여도 수지상 세포로 분화가 유도되지 않고 M-MDSCs의 특성을 안정적으로 유지하는 반면, TLR9 작용제에 의해 분화 유도된 M-MDSCs는 수지상 세포로의 2차 분화가 유도되는 것을 알 수 있었다. [실시예 9] TLR9 작용제에 의해 유도된 M-MDSCs로부터 2차 분화된 수지상 세포와 큰포식 세포의 기능 분석 이하에서는 본 발명에서 상기 TLR9 작용제에 의해 분화 유도된 M-MDSCs로부터 2차 분화된 수지상 세포의 특성을 다른 방법으로 분화된 수지상 세포와 비교 분석하였다. 수지상 세포의 In vitro 분화 방법으로는 골수 세포를 이용한 분화 방법과, Ly6C+ 세포를 통하여 분화하는 방법 등이 있다. 이에, 상기 골수 세포를 이용한 분화 방법으로, 마우스의 대퇴부 골수로부터 분리된 세포들을 상기 실시예 8에서의 수지상 세포 분화법과 같은 방법으로 5일 동안 배양하였다(Bone marrow derived Dendritic cells, BMDC). 또한 마우스의 대퇴부 골수에서 Ly6C MicroBeads를 통하여 Ly6C+ 세포들을 분리 후 위와 같이 배양하였다(Ly6C+-derived DC). 이러한 세포들은 5일 후 CD11c MicroBeads를 통하여 수지상 세포만 다시 분리 하였다(>90%). 상기한 방법으로 분리된 수지상 세포와, 상기 실시예 8에서 2차 분화된 수지상 세포의 표현형을 분석하여 그 결과를 도 40 및 41에 나타내었다. 또한 상기한 3종의 수지상 세포 각각을 48-웰 플레이트(1X105 cells/ml) 내 cRPMI 1640 배지에 분주한 뒤 수지상 세포의 자극제로 LPS와 IFN-γ를 처리하여 각각의 수지상 세포가 유도하는 사이토카인의 발현 수준을 ELISA로 분석하였고, NO2의 형성 수준을 NO 키트로 분석하여 그 결과를 도 42 및 43에 나타내었다. 그 결과 TLR9 작용제에 의해 분화 유도된 M-MDSCs로부터 2차 분화된 수지상 세포는 다른 방법으로 유도된 수지상 세포에 비하여 Th1 및 Th2 타입 세포의 분화에 중요한 IL-12p70 및 IL-10을 높은 수준으로 유도하는 것을 확인할 수 있었다. 추가로, 본 발명에 따른 수지상 세포가 T 세포에 미치는 영향을 확인하기 위하여, 상기 얻어진 3종의 수지상 세포를 OVA323-339 펩타이드로 1시간 자극시킨 후 OT-II 마우스로부터 분리된 CD4 T 세포와 1:5(DC:T 세포)의 비율로 3일간 공배양한 뒤, T 세포의 증식능과 IFN-γ의 발현 수준을 분석하였다. 도 44에서 보는 바와 같이, TLR9 작용제에 의해 분화 유도된 M-MDSCs로부터 2차 분화된 수지상 세포는 Ly6C+ 유래 수지상 세포보다 T 세포 증식능이 현저히 뛰어난 것을 볼 수 있었으며, TLR9 작용제에 의해 분화 유도된 M-MDSCs로부터 2차 분화된 수지상 세포는 다른 방법으로 분화된 수지상 세포에 비하여 Th1 세포에서 유도되는 IFN-γ가 매우 높은 수준으로 유도되는 것을 확인할 수 있었다. 이를 통하여 상기 TLR9 작용제에 의해 분화 유도된 M-MDSCs로부터 2차 분화된 수지상 세포는 미접촉 T 세포를 Th1 세포로 효과적으로 유도할 수 있음을 알 수 있었다. [실시예 10] TLR2 및 TLR9에 의해 유도된 M-MDSCs에 있어서 사이토카인의 영향 이하에서는 TLR2 작용제와 TLR9 작용제의 처리에 따라 분화 유도된 M-MDSCs 각각에 있어서 표현형, T 세포 억제능, 조절 T 세포 형성능 및 수지상 세포로의 분화 차이가, 상기 TLR 자극에 의해 유도되는 사이토카인의 분비 차이로 인한 것임을 가정하고 실험을 진행하였다. 따라서, 골수 세포에 TLR2 작용제와 TLR9 작용제의 처리 후 분화 초기(TLR 작용제 자극 후 8, 18 및 36시간)에 유도되는 사이토카인을 분석하였다. 그 결과, 도 45에서 보는 바와 같이 TLR2 작용제로 처리한 경우 TNF-α, IL-6 및 PGE2가 유도되었고, TLR9 작용제로 처리한 경우 TNF-α, IL-6, IFN-α 및 IFN-β가 유도되었는데, 특히 TLR2 작용제로 처리한 경우 TLR9 작용제로 처리한 경우에 비하여 IL-6의 유도 정도가 두드러지는 것을 확인할 수 있었다. 단, 데이터에는 나타내지 않았으나, TLR2 및 TLR9 자극 시 IFN-γ, IL-15, IL-1β, TGF-β, IL-4, IL-12p70, IL-10 및 FLT2L은 유도되지 않은 것을 확인할 수 있었다. [실시예 11] 사이토카인에 의한 M-MDSCs 분화 연관성 분석 상기 실시예 10에서 확인한 바와 같이 TLR 자극에 의해 유도되는 사이토카인에 의한 M-MDSCs 형성 및 2차 분화 억제와의 관련성을 확인하기 위하여, 상기 실시예 1의 3 method 방법에 의하되, TLR 작용제 대신에 TNF-α, IL-6, PGE2, IFN-α 및 IFN-β를 처리하고 배양 6일 째에 M-MDSCs와 수지상 세포의 형성 유무를 확인하였다. 도 46에서 보는 바와 같이, IL-6, PGE2, IFN-α 및 IFN-β의 처리 시 농도 의존적으로 M-MDSCs가 형성되고 수지상 세포의 분화가 억제되는 것을 확인할 수 있었다. 추가적으로 TLR9 작용제 처리 시 유도되었던 PDCA-1+ M-MDSCs 형성이 이러한 사이토카인에 의한 것인지 확인하기 위하여 상기와 같이 배양 6일 째에 얻어진 세포에 대하여 CD11c-CD11b+Ly6G-Ly6C+PDCA-1+ 및 CD11c-CD11b+Ly6G-Ly6C+PDCA-1-의 분포를 확인하였다. 그 결과 도 47에서 보는 바와 같이, 특히 IL-6 자극 시 CD11c-CD11b+Ly6G-Ly6C+PDCA-1-의 표현형을 갖는 M-MDSCs가 다량 유도되는 것을 확인할 수 있었다. [실시예 12] TLR9 및 IL-6에 의한 M-MDSC의 유도능 평가 이에 IL-6를 통한 M-MDSCs의 분화 및 기능 평가를 위하여, 상기 실시예 1의 3 method 방법에 따라 TLR9 작용제와 함께 재조합 IL-6 또는 IL-6 수용체 차단제(IL-6 receptor blocker)를 처리한 후 배양 6일째 세포를 수확하였다. 각 처리에 따라 수확된 세포 중 MDSCs와 수지상 세포의 비율을 확인한 결과 도 48에서 보는 바와 같이, IL-6를 처리한 경우 PDCA-1+ M-MDSCs로의 분화는 증가하였고, 수지상 세포로의 분화는 더욱더 감소하였으며, IL-6 수용체 차단제를 처리한 경우에는 수지상 세포로의 분화는 증가하였고, PDCA-1+ M-MDSC로의 분화는 감소한 것을 확인할 수 있었다. 상기와 같이 각 처리에 따라 유도된 M-MDSCs가 수지상 세포로 2차 분화되는 지 확인하기 위하여, 실시예 8에서의 수지상 세포 분화법과 같은 방법으로 5일 동안 배양하였다. 그 결과 도 49에서 보는 바와 같이, IL-6를 추가로 처리한 경우 TLR9 작용제만 처리한 경우에 비하여 M-MDSCs의 수지상 세포로의 분화 정도가 현저히 감소하여 M-MDSCs를 유지하였고, IL-6 수용체 차단제를 처리한 경우에는 그 분화 정도가 증가한 것을 볼 수 있었다. 이를 통하여 골수세포에 TLR9 작용제와 같이 세포 내부에 존재하는 톨 유사 수용체의 작용제를 처리하는 경우 IL-6를 함께 처리하면 수지상 세포로 분화가 유도되지 않는 안정적인 면역 관용성 골수유래 면역반응 억제세포를 얻을 수 있음을 알 수 있다. [실시예 13] Ⅰ형 IFN에 의해 유도된 M-MDSCs의 수지상 세포로의 분화능 평가 상기 실시예 1의 3 method 방법에 의하되, TLR2 작용제, TLR9 작용제 또는 IFN-β를 처리한 뒤 배양 6일 째에 Ly6C+ M-MDSCs 만을 수집한 후 실시예 8과 동일한 방법으로 GM-CSF를 처리하여 3일 배양한 뒤 각 처리 별 CD11c+ 세포 비율을 확인하였다. 그 결과 도 50에서 보는 바와 같이, Ⅰ형 IFN인 IFN-β 처리 시 TLR9 작용제 처리한 경우와 마찬가지로 수지상 세포의 분화가 유도된 것을 확인할 수 있었다. 추가로, 상기 실시예 1의 3 method 방법에 의하여 TLR2 작용제를 처리하면서 IFN-β를 5 ng/ml 또는 25 ng/ml로 추가로 처리한 뒤 배양 6일 째에 Ly6C+ M-MDSCs 만을 수집한 후 실시예 8과 동일한 방법으로 GM-CSF를 처리하여 3일 배양한 뒤 각 처리 별 CD11c+ 세포 비율을 확인하였다. 그 결과 도 51에서 보는 바와 같이, TLR2 작용제를 처리한 경우 수지상 세포로의 분화가 거의 유도되지 않았지만, TLR2 작용제에 Ⅰ형 IFN인 IFN-β를 함께 처리하자 수지상 세포로의 분화가 Ⅰ형 IFN의 처리 농도 의존적으로 증가하는 것을 확일할 수 있었다. 마지막으로, Ⅰ형 IFN의 기능을 확실히 알아보기 위하여, 야생형 및 Ⅰ형 IFN 수용체 넉아웃 마우스로부터 채취한 골수 세포에 상기 실시예 1의 3 method로 TLR9 작용제를 처리하여 배양 6일째에 PDCA-1+ M-MDSCs와 수지상 세포의 형성 정도를 평가하였다. 그 결과 도 52에서 보는 바와 같이, Ⅰ형 IFN 수용체 넉아웃 마우스로부터는 MDSCs 자체가 유도되지 않음을 확인할 수 있었다. 이를 통하여 본 발명에서 상기 Ⅰ형 IFN 수용체는 골수 세포로부터 PDCA-1+ M-MDSCs의 분화 유도와 그로부터 면역원성 수지상 세포의 분화 유도에 중요한 역할을 하는 것임을 알 수 있었다. 이상으로 본 발명의 특정한 부분을 상세히 기술하였는 바, 당업계의 통상의 지식을 가진 자에게 있어서 이러한 구체적인 기술은 단지 바람직한 구현 예일 뿐이며, 이에 본 발명의 범위가 제한되는 것이 아닌 점은 명백하다. 따라서, 본 발명의 실질적인 범위는 첨부된 청구항과 그의 등가물에 의하여 정의된다고 할 것이다. 본 발명의 일 구현 예에 따르면 골수유래 면역반응 억제세포, 이에 의해 제조된 골수유래 면역반응 억제세포 및 그 용도에 관한 것이다. 본 발명의 다른 구현 예에 따르면 수지상 세포의 제조방법, 이에 의해 제조된 수지상 세포 및 그 용도에 관한 것이다. The present invention relates to a method for inducing differentiation of bone marrow cells into myeloid-derived suppressor cells (MDSCs) by treating the bone marrow cells with a toll-like receptor agonist (TLR agonist) or a type I interferon or for inducing dendritic cells from the MDSCs. 골수 세포에 톨 유사 수용체 작용제(toll-like receptor agonist, TLR agonist)를 처리하여 골수유래 면역반응 억제세포(myeloid-derived suppressor cells, MDSCs)로 분화를 유도하는 단계를 포함하는, 골수유래 면역반응 억제세포의 제조 방법. 제1항에 있어서, 상기 톨 유사 수용체 작용제는 세포 막(plasma membrane)에 존재하는 톨 유사 수용체(exogenous Toll like receptor)인, 골수유래 면역반응 억제세포의 제조 방법. 제2항에 있어서, 상기 톨 유사 수용체 작용제는 톨 유사 수용체 2의 작용제 및 톨 유사 수용체 4의 작용제 중 1종 이상인, 골수유래 면역반응 억제세포의 제조 방법. 제1항에 있어서, 상기 톨 유사 수용체 작용제는 세포 내부에 존재하는 톨 유사 수용체(intracellular Toll like receptor)인, 골수유래 면역반응 억제세포의 제조 방법. 제4항에 있어서, 상기 톨 유사 수용체 작용제는 톨 유사 수용체 7의 작용제 및 톨 유사 수용체 9의 작용제 중 1종 이상인, 골수유래 면역반응 억제세포의 제조 방법. 제4항에 있어서, 상기 골수 세포에 톨 유사 수용체 작용제와 함께 인터루킨 6(interleukin 6)를 추가로 처리하는, 골수유래 면역반응 억제세포의 제조 방법. 제1항에 있어서, 상기 톨 유사 수용체 작용제는 골수 세포의 분화 개시 이전, 분화 개시 시점 또는 분화 중에 1회 이상 처리되는, 골수유래 면역반응 억제세포의 제조 방법. 제1항에 있어서, 상기 톨 유사 수용체 작용제는 골수 세포의 분화 개시 시점에 처리된 후, 분화 개시 후 3일 이내에 1회 이상 처리되는, 골수유래 면역반응 억제세포의 제조 방법. 제1항에 있어서, 상기 톨 유사 수용체 작용제는 10 ng/ml 내지 1000 ng/ml의 양으로 처리되는, 골수유래 면역반응 억제세포의 제조 방법. 제6항에 있어서, 상기 인터루킨 6는 1 내지 100 ng/ml의 양으로 처리되는, 골수유래 면역반응 억제세포의 제조 방법. 제1항에 있어서, 상기 골수유래 면역반응 억제세포로 분화를 유도하는 단계는 골수 세포를 성장인자 및 톨 유사 수용체 작용제를 포함하는 배지에서 배양하며 수행되는, 골수유래 면역반응 억제세포의 제조 방법. 제7항에 있어서, 상기 골수 세포의 분화는 성장인자를 포함하는 배지에 상기 골수 세포를 접종하여 5일 내지 10일 배양하며 수행되는, 골수유래 면역반응 억제세포의 제조 방법. 제12항에 있어서, 상기 성장인자는 과립구-큰포식 세포 콜로니 자극 인자(granulocyte-macrophage colony stimulating factor, GM-CSF), 과립구 콜로니 자극 인자(granulocyte colony stimulating factor, G-CSF), 큰포식 세포 콜로니 자극 인자(macrophage colony stimulating factor, M-CSF), 줄기세포 인자(stem cell factor, SCF), FMS-유사 티로신 키네이즈 3(FMS-like tyrosine kinase 3, Flt3) 및 인터루킨 3(interlukin 3, IL-3)로 이루어진 군에서 선택된 1종 이상인, 골수유래 면역반응 억제세포의 제조 방법. 제12항에 있어서, 상기 성장인자는 10 ng/ml 내지 500 ng/ml의 양으로 첨가되는, 골수유래 면역반응 억제세포의 제조 방법. 제1항에 있어서, 상기 골수유래 면역반응 억제세포는 단핵구 골수유래 면역반응 억제세포(monocytic myeloid-derived suppressor cells, M-MDSCs)인, 골수유래 면역반응 억제세포의 제조 방법. 톨 유사 수용체 작용제를 포함하는, 골수유래 면역반응 억제세포의 분화 유도용 조성물. 제16항에 있어서, 상기 톨 유사 수용체 작용제는 세포 막(plasma membrane)에 존재하는 톨 유사 수용체(exogenous Toll like receptor)인, 골수유래 면역반응 억제세포의 분화 유도용 조성물. 제17항에 있어서, 상기 톨 유사 수용체 작용제는 톨 유사 수용체 2의 작용제 및 톨 유사 수용체 4의 작용제 중 1종 이상인, 골수유래 면역반응 억제세포의 분화 유도용 조성물. 제16항에 있어서, 상기 톨 유사 수용체 작용제는 세포 내부에 존재하는 톨 유사 수용체(intracellular Toll like receptor)인, 골수유래 면역반응 억제세포의 분화 유도용 조성물. 제19항에 있어서, 상기 톨 유사 수용체 작용제는 톨 유사 수용체 7의 작용제 및 톨 유사 수용체 9의 작용제 중 1종 이상인, 골수유래 면역반응 억제세포의 분화 유도용 조성물. 제19항에 있어서, 상기 조성물은 인터루킨 6(interleukin 6)를 추가로 더 포함하는, 골수유래 면역반응 억제세포의 분화 유도용 조성물. 제16항에 있어서, 상기 톨 유사 수용체 작용제는 10 ng/ml 내지 1000 ng/ml의 양으로 포함되는, 골수유래 면역반응 억제세포의 분화 유도용 조성물. 제21항에 있어서, 상기 인터루킨 6는 10 ng/ml 내지 1000 ng/ml의 양으로 포함되는, 골수유래 면역반응 억제세포의 분화 유도용 조성물. 제16항에 있어서, 상기 조성물은 성장인자를 더 포함하는, 골수유래 면역반응 억제세포의 분화 유도용 조성물. 제24항에 있어서, 상기 성장인자는 과립구-큰포식 세포 콜로니 자극 인자(granulocyte-macrophage colony stimulating factor, GM-CSF), 과립구 콜로니 자극 인자(granulocyte colony stimulating factor, G-CSF), 큰포식 세포 콜로니 자극 인자(macrophage colony stimulating factor, M-CSF), 줄기세포 인자(stem cell factor, SCF), FMS-유사 티로신 키네이즈 3(FMS-like tyrosine kinase 3, Flt3) 및 인터루킨 3(interlukin 3, IL-3)로 이루어진 군에서 선택된 1종 이상인, 골수유래 면역반응 억제세포의 분화 유도용 조성물. 제24항에 있어서, 상기 성장인자는 10 ng/ml 내지 500 ng/ml의 양으로 포함되는, 골수유래 면역반응 억제세포의 분화 유도용 조성물. 제1항 내지 제15항 중 어느 한 항의 제조 방법으로 제조된 골수유래 면역반응 억제세포. 제27항의 골수유래 면역반응 억제세포를 유효 성분으로 포함하는 면역 질환의 예방 또는 치료용 약학적 조성물. 제28항에 있어서, 상기 면역 질환은 장기이식 거부반응; 조혈모세포 이식; 자가면역질환; 또는 알러지성 질환인, 면역 질환의 예방 또는 치료용 약학적 조성물. 제27항의 골수유래 면역반응 억제세포를 유효 성분으로 포함하는 면역 질환의 예방 또는 개선용 화장료 조성물. 제27항의 골수유래 면역반응 억제세포를 유효 성분으로 포함하는 면역 질환의 예방 또는 개선용 식품 조성물. 골수 세포에 Ⅰ형 인터페론(type Ⅰ interferon)을 처리하여 골수유래 면역반응 억제세포(myeloid-derived suppressor cells, MDSCs)로 분화를 유도하는 단계를 포함하는, 골수유래 면역반응 억제세포의 제조 방법. 제32항에 있어서, 상기 Ⅰ형 인터페론은 IFN-α, IFN-β, IFN-κ 및 IFN-ω으로 이루어진 군에서 선택된 1종 이상인, 골수유래 면역반응 억제세포의 제조 방법. 제33항에 있어서, 상기 Ⅰ형 인터페론은 IFN-α 및 IFN-β 중 1종 이상인, 골수유래 면역반응 억제세포의 제조 방법. 제32항에 있어서, 상기 Ⅰ형 인터페론은 골수 세포의 분화 개시 이전, 분화 개시 시점 또는 분화 중에 1회 이상 처리되는, 골수유래 면역반응 억제세포의 제조 방법. 제32항에 있어서, 상기 Ⅰ형 인터페론은 골수 세포의 분화 개시 시점에 처리된 후, 분화 개시 후 3일 이내에 1회 이상 처리되는, 골수유래 면역반응 억제세포의 제조 방법. 제32항에 있어서, 상기 Ⅰ형 인터페론은 10 ng/ml 내지 1000 ng/ml의 양으로 처리되는, 골수유래 면역반응 억제세포의 제조 방법. 제32항에 있어서, 상기 골수유래 면역반응 억제세포의 분화 유도는, 성장인자 및 Ⅰ형 인터페론을 포함하는 배지에서 골수 세포를 배양하며 수행되는, 골수유래 면역반응 억제세포의 제조 방법. 제35항에 있어서, 상기 골수 세포의 분화는 성장인자를 포함하는 배지에 상기 골수 세포를 접종하여 5일 내지 10일 배양하며 수행되는, 골수유래 면역반응 억제세포의 제조 방법. 제39항에 있어서, 상기 성장인자는 과립구-큰포식 세포 콜로니 자극 인자(granulocyte-macrophage colony stimulating factor, GM-CSF), 과립구 콜로니 자극 인자(granulocyte colony stimulating factor, G-CSF), 큰포식 세포 콜로니 자극 인자(macrophage colony stimulating factor, M-CSF), 줄기세포 인자(stem cell factor, SCF), FMS-유사 티로신 키네이즈 3(FMS-like tyrosine kinase 3, Flt3) 및 인터루킨 3(interlukin 3, IL-3)로 이루어진 군에서 선택된 1종 이상인, 골수유래 면역반응 억제세포의 제조 방법. 제39항에 있어서, 상기 성장인자는 10 ng/ml 내지 500 ng/ml의 양으로 첨가되는, 골수유래 면역반응 억제세포의 제조 방법. 제32항에 있어서, 상기 골수유래 면역반응 억제세포는 단핵구 골수유래 면역반응 억제세포(monocytic myeloid-derived suppressor cells, M-MDSCs)인, 골수유래 면역반응 억제세포의 제조 방법. 제42항에 있어서, 상기 단핵구 골수유래 면역반응 억제세포는 CD11c-CD11b+Ly6G-Ly6C+PDCA-1+의 표현형을 갖는, 골수유래 면역반응 억제세포의 제조 방법. 제32항 내지 제43항 중 어느 한 항의 제조 방법으로 제조된 골수유래 면역반응 억제세포. (1) 골수 세포에 Ⅰ형 인터페론(type Ⅰ interferon)을 처리하여 골수유래 면역반응 억제세포(myeloid-derived suppressor cells, MDSCs)로 분화를 유도하는 단계; 및 (2) 상기 골수유래 면역반응 억제세포에 성장인자를 처리하여 수지상 세포로 분화를 유도하는 단계를 포함하는, 수지상 세포의 제조 방법. 제45항에 있어서, 상기 Ⅰ형 인터페론은 IFN-α, IFN-β, IFN-κ 및 IFN-ω으로 이루어진 군에서 선택된 1종 이상인, 수지상 세포의 제조 방법. 제45항에 있어서, 상기 Ⅰ형 인터페론은 골수 세포의 분화 개시 이전, 분화 개시 시점 또는 분화 중에 1회 이상 처리되는, 수지상 세포의 제조 방법. 제47항에 있어서, 상기 골수 세포의 분화는 성장인자를 포함하는 배지에 상기 골수 세포를 접종하여 5일 내지 10일 배양하며 수행되는, 수지상 세포의 제조 방법. 제45항에 있어서, 상기 (1) 단계는 골수 세포를 성장인자 및 Ⅰ형 인터페론을 포함하는 배지에서 배양하며 수행되는, 수지상 세포의 제조 방법. 제45항에 있어서, 상기 (2) 단계에서 상기 성장인자는 과립구-큰포식 세포 콜로니 자극 인자(granulocyte-macrophage colony stimulating factor, GM-CSF)인, 수지상 세포의 제조 방법. 제45항에 있어서, 상기 (2) 단계에서 상기 성장인자는 12시간 내지 7일 동안 처리되는, 수지상 세포의 제조 방법. 제45항에 있어서, 상기 (2) 단계에서 상기 성장인자는 10 ng/ml 내지 500 ng/ml의 양으로 처리되는, 수지상 세포의 제조 방법. 제45항에 있어서, 상기 수지상 세포는 미접촉 T 세포를 Th1 세포로 분화를 유도하는, 수지상 세포의 제조 방법. 제45항 내지 제53항 중 어느 한 항의 제조 방법으로 제조된 수지상 세포. 제54항의 수지상 세포를 유효 성분으로 포함하는 면역 치료제. 제54항의 수지상 세포를 유효 성분으로 포함하는 항종양 백신. 제54항의 수지상 세포를 유효 성분으로 포함하는 종양치료용 약학적 조성물. (1) 골수 세포에 톨 유사 수용체 작용제 (toll-like receptor agonist, TLR agonist)를 처리하여 골수유래 면역반응 억제세포(myeloid-derived suppressor cells, MDSCs)로 분화를 유도하는 단계; 및 (2) 분화 유도된 골수유래 면역반응 억제세포에 성장인자를 처리하여 수지상 세포로 분화를 유도하는 단계를 포함하는, 수지상 세포의 제조 방법. 제58항에 있어서, 상기 톨 유사 수용체 작용제는 세포 내부에 존재하는 톨 유사 수용체(intracellular Toll like receptor)의 작용제인, 수지상 세포의 제조 방법. 제59항에 있어서, 상기 톨 유사 수용체 작용제는 톨 유사 수용체 7의 작용제 및 톨 유사 수용체 9의 작용제 중 1종 이상인, 수지상 세포의 제조 방법. 제58항에 있어서, 상기 톨 유사 수용체 작용제는 골수 세포의 분화 개시 이전, 분화 개시 시점 또는 분화 중에 1회 이상 처리되는, 수지상 세포의 제조 방법. 제58항에 있어서, 상기 톨 유사 수용체 작용제는 골수 세포의 분화 개시 시점에 처리된 후, 분화 개시 후 3일 이내에 1회 이상 처리되는, 수지상 세포의 제조 방법. 제58항에 있어서, 상기 톨 유사 수용체 작용제는 10 ng/ml 내지 1000 ng/ml의 양으로 처리되는, 수지상 세포의 제조 방법. 제58항에 있어서, 상기 (1) 단계는 골수 세포를 성장인자 및 톨 유사 수용체 작용제를 포함하는 배지에서 배양하며 수행되는, 수지상 세포의 제조 방법. 제61항에 있어서, 상기 골수 세포의 분화는 성장인자를 포함하는 배지에 상기 골수 세포를 접종하여 5일 내지 10일 배양하며 수행되는, 수지상 세포의 제조 방법. 제65항에 있어서, 상기 성장인자는 과립구-큰포식 세포 콜로니 자극 인자(granulocyte-macrophage colony stimulating factor, GM-CSF), 과립구 콜로니 자극 인자(granulocyte colony stimulating factor, G-CSF), 큰포식 세포 콜로니 자극 인자(macrophage colony stimulating factor, M-CSF), 줄기세포 인자(stem cell factor, SCF), FMS-유사 티로신 키네이즈 3(FMS-like tyrosine kinase 3, Flt3) 및 인터루킨 3(interlukin 3, IL-3)로 이루어진 군에서 선택된 1종 이상인, 수지상 세포의 제조 방법. 제65항에 있어서, 상기 성장인자는 10 ng/ml 내지 500 ng/ml의 양으로 첨가되는, 수지상 세포의 제조 방법. 제58항에 있어서, 상기 골수유래 면역반응 억제세포는 단핵구 골수유래 면역반응 억제세포(monocytic myeloid-derived suppressor cells, M-MDSCs)인, 수지상 세포의 제조 방법. 제68항에 있어서, 상기 단핵구 골수유래 면역반응 억제세포는 CD11c-CD11b+Ly6G-Ly6C+PDCA-1+의 표현형을 갖는, 수지상 세포의 제조 방법. 제58항에 있어서, 상기 성장인자는 과립구-큰포식 세포 콜로니 자극 인자(granulocyte-macrophage colony stimulating factor, GM-CSF)인, 수지상 세포의 제조 방법. 제58항에 있어서, 상기 (2) 단계는 성장인자는 12시간 내지 7일 동안 처리되는, 수지상 세포의 제조 방법. 제58항에 있어서, 상기 성장인자는 10 ng/ml 내지 500 ng/ml의 양으로 처리되는, 수지상 세포의 제조 방법. 제58항에 있어서, 상기 수지상 세포는 미접촉 T 세포를 Th1 세포로 분화를 유도하는, 수지상 세포의 제조 방법. 제58항 내지 제73항 중 어느 한 항의 제조 방법으로 제조된 수지상 세포. 제74항의 수지상 세포를 유효 성분으로 포함하는 면역 치료제. 제74항의 수지상 세포를 유효 성분으로 포함하는 항종양 백신. 제74항의 수지상 세포를 유효 성분으로 포함하는 종양치료용 약학적 조성물.