COMPOSITION FOR PREPARING TAGATOSE AND METHOD FOR PREPARING TAGATOSE FROM FRUCTOSE
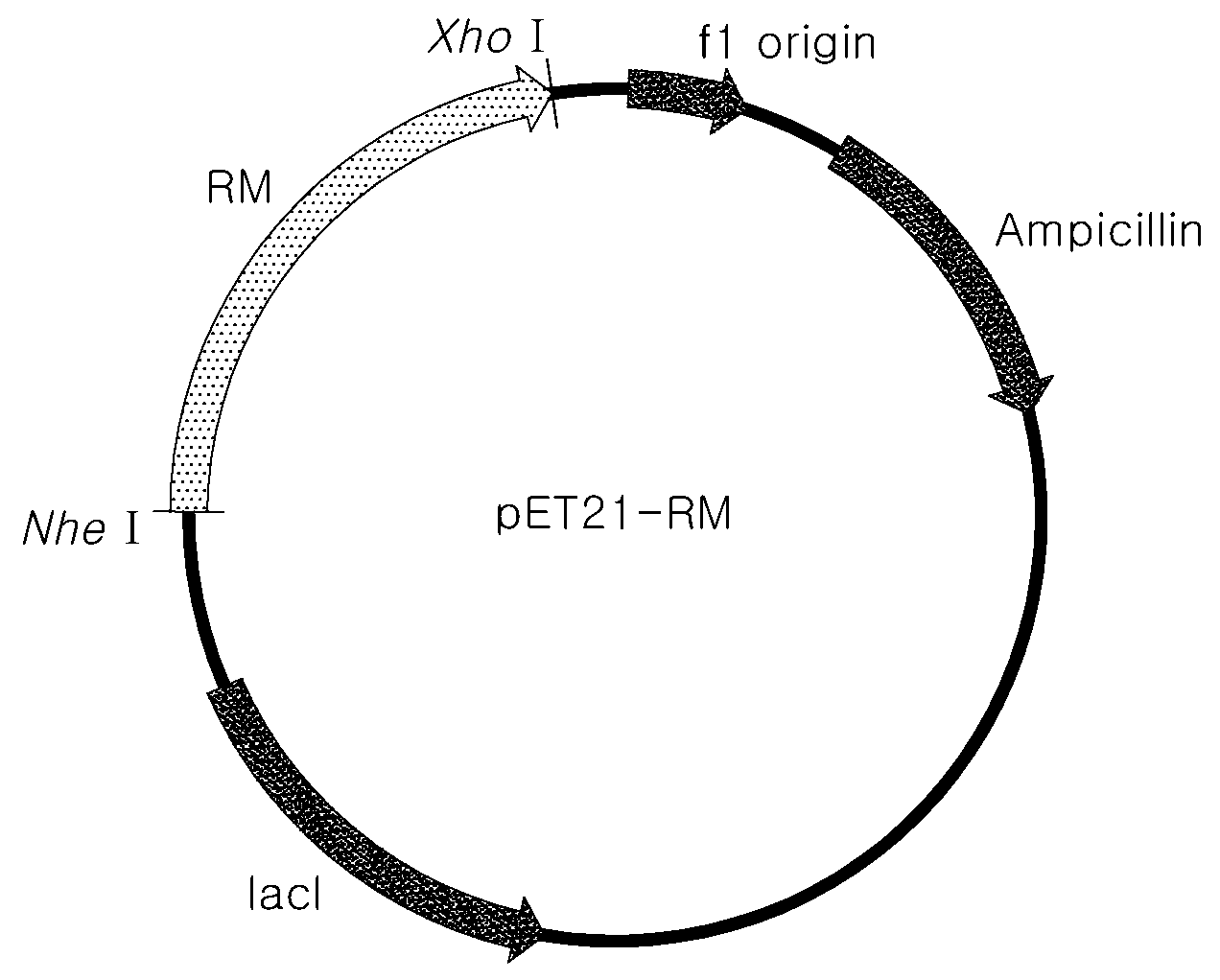
본 발명은 타가토스 제조용 조성물 및 과당으로부터 타가토스를 제조하는 방법, 더욱 상세하게는, 고온균 미생물로부터 유래된 호열성 과당 4-에피머화 효소를 코딩하는 유전자 및 상기 효소를 이용하여 과당으로부터 타가토스를 제조하는 방법에 관한 것이다. 타가토스는 과당(D-fructose)의 에피머로, 타가토스는 설탕과 거의 구별할 수 없는 천연의 단맛을 가지고 있으며, 물리적 성질 또한 설탕과 비슷하다. 타가토스는 우유, 치즈, 카카오 등의 식품, 사과와 귤과 같은 단맛이 나는 천연과일에 소량 존재하는 천연감미료로, 칼로리는 1.5 kcal/g으로 설탕의 1/3 수준이며 GI(Glycemic index, 혈당지수)는 3으로 설탕의 5% 수준인데 반해, 설탕의 맛과 유사한 단맛을 내면서 다양한 건강 기능성을 가지고 있기 때문에 여러 제품 적용 시 건강과 맛을 동시에 만족시킬 수 있는 대체감미료로 이용될 수 있다. 종래 알려진 타가토스의 생산 방법으로는 주로 갈락토스를 원료로 한 화학적(촉매 반응)방법과 생물학적 (이성화 효소반응) 방법이 있다(대한민국 공개특허 제2009-0082774호, 2009. 07. 31 공개). 상기 반응들의 원료인 갈락토스를 경제적으로 수득하기 위하여 갈락토스를 함유하는 다양한 기초 원료 및 이로부터 갈락토스의 수득 및 타가토스의 제조에 대한 연구가 선행되어 왔다. 갈락토스를 얻기 위한 대표적인 기초 원료는 유당이며, 국제 시장에서의 원유(原乳) 및 유당의 생산량, 수요, 공급량 등에 따라 유당 또는 유당을 함유하는 제품의 가격의 불안정성이 존재하여, 안정적인 타가토스의 생산 원료 수급에 한계가 있다. 특히, 2012년 전후 국제 유당 가격의 급격한 상승은 중국의 급격한 경제 성장에 따른 유당을 포함하는 탈/전지 분유 등의 수요 급증과 기후 온난화에 따른 낙농국가들의 연간 우유 생산량 감소가 주요 원인이었다. 이러한 원료 가격 불안정성이 안정적인 타가토스 생산을 어렵게 하고 있는 실정이다. 따라서, 보편화된 일반당(설탕, 포도당, 과당 등)을 사용하여 타가토스를 제조할 수 있는 새로운 방법이 필요하다. 종래에는 갈락토스를 수득하기 위하여 식품원료로서 유당외 식품원료 가용 부산물인 탈단백 유청(whey permeate), 식물계 바이오매스인 낙엽송 등 다양한 생물자원으로부터 분해되는 갈락토스를 이용하여 타가토스를 생산하였다. 그러나, 원료의 안정적인 수급 및 투자 효율성 등을 고려해 볼 때, 산업적으로 이용가능하거나, 그 수준까지의 제조가 가능한 적당한 원료가 존재하지 않는다. 따라서, 본 발명이 해결하고자 하는 과제는 종래 갈락토스로부터 타가토스 생산방법에 비해 산업적으로 적용되기 적합한 일반당으로부터 타가토스 생산하기 위한 타가토스 제조용 조성물 및 타가토스를 생산하는 방법을 제공하는 것을 과제로 한다. 구체적으로, 본 발명은 종래에 기능이 밝혀지지 않은 단백질로서, D-과당 4-에피머화 효소 활성을 가지며, 과당으로부터 고수율로 타가토스를 제조할 수 있는 신규 효소 단백질, 이를 암호화하는 유전자 및 이를 이용한 타가토스 제조용 조성물 및 과당으로부터 타가토스를 제조하는 방법을 제공하는 것을 과제로 한다. 이에, 본 발명의 일 실시예에서는, 본 발명의 서열번호 1 내지 서열번호 7 중 어느 하나의 아미노산 서열로 이루어진 단백질 또는 상기 단백질을 발현하는 균주를 포함하는, 과당으로부터 타가토스의 제조용 조성물을 제공한다. 또한, 본 발명의 다른 실시예에서는, 본 발명의 일 실시예의 조성물을 과당과 반응시키는 단계를 포함하는, 과당으로부터 타가토스를 제조하는 방법을 제공한다. 본 발명은 과당의 4 번째 탄소 위치를 에피머화하여 타가토스를 생산하는 활성을 보유한 효소인 신규한 D-과당 4-에피머화 효소를 개발함으로써, 보편화된 원료인 과당을 사용하여 제조원가를 절감시킴으로써 경제적이면서도 높은 수율의 타가토스의 제조를 가능하게 한다. 또한, 본 발명에서는 가격 변동이 큰 유당이 아닌, 보편화된 원료인 과당을 사용하여 제조원가를 절감시킴으로써 경제적이면서도 높은 수율의 타가토스 제조방법을 제공할 수 있다. 보편적으로 과당을 포도당 또는 설탕으로부터 공업적으로 제조 가능함은 매우 널리 알려져 있는 사실이므로, 본 발명에서 제시하는 공정의 원료는 과당 이외에 보다 저렴한 생산을 위하여 과당을 전체에 혹은 일부 함유한 형태로 사용하는 경우까지 확장하여 포함할 수 있다. 즉, 본 발명은 타가토스를 전분질, 원당 또는 설탕으로부터 효소적 전환을 통하여 생산하는 것을 포함한다. 또한, 본 발명은 과당을 이용하여 타가토스를 제조하여 오늘날 중요한 식품 소재로 각광받고 있는 타가토스를 효율적으로 대량 생산할 수 있다. 도 1a 내지 도 1g는 각각의 고온성 미생물 유래 7종의 D-과당 4-에피머화 효소를 발현하기 위한 재조합 벡터의 개열 지도이다. 도 2a 내지 도 2g는 과당을 기질로 하여 D-과당 4-에피머화 효소 반응에 의한 각각의 고온성 미생물 유래 7종의 타가토스 생성을 보여주는 HPLC 그래프이다. 도 3a 내지 도 3g는 각각의 고온성 미생물 유래 7종의 D-과당 4-에피머화 효소의 온도에 따른 활성을 보여주는 그래프이다. 도 4a 내지 도 4g는 각각의 고온성 미생물 유래 7종의 D-과당 4-에피머화 효소에 대한 pH 변화에 따른 활성을 보여주는 그래프이다. 도 5a 내지 도 5g는 각각의 고온성 미생물 유래 7종의 D-과당 4-에피머화 효소에 대한 활성을 금속이온 종류에 따른 활성 비교평가 그래프이다. 도 6a 내지 도 6g는 각각의 고온성 미생물 7종에서 유래된 단백질의 아미노산 서열(서열번호 1 내지 서열번호 7)을 보여준다. 이하 본 발명을 구체적인 실시예에 의해 더 상세히 설명하고자 한다. 하지만 본 발명은 하기 실시예에 한정된 것이 아니며, 본 명세서에 기재되지 않은 내용은 본 발명의 기술 분야 또는 유사 분야에서 숙련된 자이면 충분히 인식하고 유추할 수 있는 것이므로 그 설명을 생략한다. 본원에서 상기 용어 "n번째 탄소 위치"란, IUPAC에서 규정하는 탄소 번호를 매기는 규칙에 따라 정해진 탄소 위치를 의미하며, 이는 Cn으로 표현할 수 있다. 이 때, n은 1 이상인 정수를 말한다. 예를 들어, "4번 탄소 위치에서 에피머화"되는 것을 "C4-에피머화"로 나타낼 수 있다. 본 발명의 일 실시예에 따르면, 서열번호 1 내지 서열번호 7 중 어느 하나의 아미노산 서열로 이루어진 단백질 또는 상기 단백질을 발현하는 균주를 포함하는, 과당으로부터 타가토스를 제조하기 위한 타가토스 제조용 조성물을 제공한다. 일반적으로, 단당류는 알도헥소오스(aldohexose)와 케토헥소오스(ketohexose)로 분류될 수 있다. 알도헥소오스란 탄소 원자 여섯 개로 이루어진 알도스로, 한쪽 끝에 알데하이드기를 가지고 있는 것을 의미하고, 비제한적인예로는 포도당(glucose), 갈락토스(galactose), 알로스(allose), 굴로스(gulose), 알트로스(altrose), 만노스(mannose), 탈로스(talose), 아이도스(idose)가 있다. 또한, 본원에서 케토헥소오스는 탄소 원자 여섯 개로 이루어지고 케톤기를 가진 단당류를 의미하고, 비제한적인 예로는 과당(fructose), 타가토스(tagatose), 사이코스(psicose) 및 소보스(sorbose)가 있으며, 구체적으로, 과당일 수 있다. 상기 과당 및 상기 타가토스는 본원에서 특별한 다른 언급이 없는 한 D-형 과당 또는 D-형 타가토스를 의미한다. 본 발명의 일 실시예에서, 상기 서열번호 1 내지 서열번호 7 중 어느 하나의 아미노산 서열은 과당의 4 번째 탄소 위치를 에피머화하여 타가토스를 생산하는 활성을 보유한 효소일 수 있다. 구체적으로, 본 발명의 발명자들은 고온성 로도써머스( 상기 서열번호 1 내지 서열번호 7 중 어느 하나의 아미노산 서열은, 상기 서열로 이루어진 단백질을 각각 코딩하는 유전자를 포함하는 재조합 벡터로 형질 전환된 것일 수 있다. 상기 형질 전환용 균주로는 구체적으로, 본 발명의 일 실시예의 서열번호 1의 아미노산 서열로 이루어진 단백질은 로도써머스 마리누스 ( 상기 단백질은 분자량이 55 kDa 내지 60 kDa이고, 최적 활성 온도가 50 ℃ 내지 90 ℃이며, 최적 활성 pH가 6.0 내지 9.0일 수 있다. 보다 구체적으로, 상기 최적 활성 온도는 60 ℃ 내지 80 ℃일 수 있고, 상기 최적 활성 pH 는 7.0 내지 9.0 일 수 있다. 구체적으로, 본 발명의 일 실시예의 서열번호 2의 아미노산 서열로 이루어진 단백질은 써모토가 페트로필라 상기 단백질은 분자량이 55 kDa 내지 58 kDa이고, 최적 활성 온도가 50 ℃ 내지 90 ℃이며, 최적 활성 pH가 7.0 내지 9.0일 수 있다. 보다 구체적으로, 상기 최적 활성 온도는 70 ℃ 내지 90 ℃일 수 있다. 구체적으로, 본 발명의 일 실시예의 서열번호 3의 아미노산 서열로 이루어진 단백질은 써모토가 레틴게 상기 단백질은 분자량이 55 kDa 내지 58 kDa이고, 최적 활성 온도가 50 ℃ 내지 90 ℃이며, 최적 활성 pH가 7.0 내지 9.0일 수 있다. 보다 구체적으로, 상기 최적 활성 온도는 60 ℃ 내지 80 ℃일 수 있다. 구체적으로, 본 발명의 일 실시예의 서열번호 4의 아미노산 서열로 이루어진 단백질은 써모언에로박터 마쓰라니 상기 단백질은 분자량이 55 kDa 내지 58 kDa이고, 최적 활성 온도가 50 ℃ 내지 90 ℃이며, 최적 활성 pH가 7.0 내지 10.0일 수 있다. 보다 구체적으로, 상기 최적 활성 온도는 70 ℃ 내지 90 ℃일 수 있고, 최적 활성 pH는 8.0 내지 10.0일 수 있다. 구체적으로, 본 발명의 일 실시예의 서열번호 5의 아미노산 서열로 이루어진 단백질은 딕티오글로무스 터지덤 상기 단백질은 분자량이 55 kDa 내지 58 kDa이고, 최적 활성 온도가 50 ℃ 내지 90 ℃이며, 최적 활성 pH가 7.0 내지 9.0일 수 있다. 보다 구체적으로, 상기 최적 활성 온도는 60 ℃ 내지 80 ℃일 수 있다. 구체적으로, 본 발명의 일 실시예의 서열번호 6의 아미노산 서열로 이루어진 단백질은 써모언에로막테리움 자일노리티쿰( 상기 단백질은 분자량이 53 kDa 내지 58 kDa이고, 최적 활성 온도가 50 ℃ 내지 90 ℃이며, 최적 활성 pH가 6.0 내지 9.0일 수 있다. 보다 구체적으로, 상기 최적 활성 온도는 60 ℃ 내지 80 ℃일 수 있고, 상기 최적 pH 는 6.0 내지 8.0일 수 있다. 구체적으로, 본 발명의 일 실시예의 서열번호 7의 아미노산 서열로 이루어진 단백질은 써모언에로박터 시데로필러스( 상기 단백질은 분자량이 55 kDa 내지 58 kDa이고, 최적 활성 온도가 50 ℃ 내지 80 ℃이며, 최적 활성 pH가 7.0 내지 10.0일 수 있다. 보다 구체적으로, 상기 최적 활성 온도는 60 ℃ 내지 80 ℃일 수 있고, 상기 최적 pH 는 8.0 내지 10.0일 수 있다. 본 발명의 다른 실시예에 따르면, 본 발명의 일 실시예 중 어느 하나의 조성물을 과당과 반응시키는 단계를 포함하는, 과당으로부터 타가토스를 제조하는 방법일 수 있다. 구체적으로, 상기 반응은 50 ℃ 내지 80 ℃에서 이루어질 수 있다. 또한, 상기 반응은 pH 6.0 내지 9.0에서 이루어질 수 있다. 또한, 상기 반응은 마그네슘 이온, 아연 이온, 니켈 이온, 코발트 이온, 철 이온, 망간 이온, 또는 이들 혼합물을 추가로 포함하여 이루어질 수 있다. 또한, 기질로 작용하는 과당은 5%(w/v) 내지 60%(w/v) 농도일 수 있다. 본 발명의 일 실시예에 따르면, 과당은 설탕 또는 포도당으로부터 얻어질 수 있다. 이를 통해, 포도당, 과당, 설탕과 같이 보편화되고 저렴한 원료를 사용하여 높은 수율의 타가토스를 제조하는 방법을 제공하여 타가토스의 대량 생산을 가능하게 할 수 있다. 따라서, 본 발명의 일 실시예 중 어느 하나의 조성물을 과당과 반응시키는 단계 전, 설탕을 가수분해하거나, 포도당을 이성질화하여 과당을 얻는 단계를 추가적으로 수행할 수 있다. 상기 가수분해에 사용되는 효소는 β-프룩토푸라노시다아제, 인버타아제, 사카라제 등을 포함하는 β-D-프룩토시다아제; 수크라아제, α-글루코시다아제 및 α-D-글루코하이드롤라아제로 이루어지는 군에서 선택된 1종 이상일 수 있으나, 이에 제한되지 않는다. 상기 포도당을 이성질화 효소로는 글루코스 아이소머라아제 또는 포스포글루코 아이소머라아제일 수 있으나, 이에 제한되지 않는다. 실시예 실시예 1. D-과당 4-에피머화 효소를 생산하는 재조합 균주의 제조 하기 표 1과 같이, 고온성 미생물 7종으로부터 유래된 서열 번호 1 내지 서열번호 7(도 6a 내지 도 6g)의 아미노산 서열을 암호화하는 폴리뉴클레오티드를 제한효소 NdeI 과 XhoI을 사용하여 발현벡터인 pET21a(Novagen)의 동일한 제한효소 부위에 삽입하여 재조합 벡터 pET21a-RM, pET21a-TAM, pET21a-TAS, pET21a-TAX, pET21a-TP, pET21a-TL, pET21a-DT를 제조하였다(도 1a 내지 도 1g). 상기 재조합 벡터를 열충격(heat shock)방법 (Sambrook and Russell: Molecular Cloning.)에 의하여 대장균 BL21(DE3)(invitrogen)를 형질전환 하여 재조합 균주를 제조하였다. 형질 전환된 재조합 균주를 5ml LB-암피실린 배지(Difco)에 접종한 후 600nm에서 흡광도(OD)가 1.5에 도달할 때까지 37℃, 180rpm에서 진탕 배양하고, 이를 다시 500ml LB-암피실린 배지에 접종하고, 목적 효소의 과발현을 유도하기 위하여 초기에 5mM의 유당을 첨가하여 37 ℃의 진탕 배양기에서 배양하였다. 배양조건은 37 ℃, 180rpm으로 16 시간 동안 유지하였다. 이후 원심분리기 4000rpm에서 20분간 원심 분리하여 균체만을 회수하였다. 상기 제조된 재조합 균주는 실시예 2. D-과당 4-에피머화 효소 정제 및 특성 확인 2-1. D-과당 4-에피머화 효소의 정제 실시예 1에서 회수된 균체 총 7종을 용해 버퍼(lysis buffer)(50mM K-phosphate)에 혼탁시킨 후 음파진동기(Ultrasonic processor)를 사용하여 4 ℃에서 10분 동안 파쇄하였다. 파쇄액을 60 ℃ 진탕배양기에서 30분 동안 열처리를 한 후, 13,000 rpm에서 10 분 동안 원심 분리하여 상등액만을 확보하였다. 확보한 상등액을 미리 용해 버퍼(lysis buffer)로 평형시킨 Q-세파로스(Sepharose) DEAE 에 적용시킨 다음 50mM K-포스페이트(phosphate) 200mM NaCl이 함유된 완충용액을 순차적으로 흘려 줌으로써 목적 단백질을 정제하였다. 용출된 단백질은 효소 활성 측정용 완충용액 (50mM K-phosphate, pH 7)으로 전환 및 투석 후 다음 실험에 사용하였다. 또한 정제된 7종의 D-과당 4-에피머화 효소인 RM, TAM, TAS, TAX, TP, TL, DT는 SDS-PAGE를 통하여 분자량이 각각 약 58kDa, 56kDa, 56kDa, 55kDa, 56kDa, 57kDa, 57kDa 인 것을 확인하였다. 2-2. D-과당 4-에피머화 효소의 온도, pH 변화에 따른 활성 분석 실시예 2-1에서 정제된 효소 7종의 pH 및 온도변화에 따른 D-과당 4-에피머화 효소의 활성을 확인하기 위해, 다양한 pH 및 온도에서 효소와 과당 기질을 반응시키고 활성을 확인하였다. 이 때 활성측정은 50Mm 과당, 효소 1mg/ml, 0.1mM NiSO4로 각각의 pH와 온도 범위에서 이루어졌으며, 얼음에서 반응을 중지시킨 후 HPLC로 분석하였다. 상기 HPLC 분석은 SUGAR SP0810(Shodex) 컬럼을 사용하여 80℃에서, 이동상으로 물을 0.6 ml/분 유속으로 흘려 주면서 수행하였으며, 시차 굴절률 검출기(Refractive Index Detector)로 타가토스를 검출하여 타가토스 생산성을 분석하였다. 먼저 pH를 7로 하고 온도에 따른 활성을 평가하기 위해 40 ℃ 내지 90 ℃에서 타가토스 생산성을 측정해본 결과, 상기 7종 효소 중 2종인 TAM, TP의 경우, 80 ℃에서 최대 전환율을 나타냈으며, 5종인 RM, TAS, TAX, TL, DT 의 경우, 70 ℃에서 최대 전환율을 보였다(도 3a 내지 도 3g). 또한 pH 변화에 따른 활성을 알아보기 위해, 70 ℃에서 50mM 소듐 아세테이트(sodium acetate) pH 4-6, 50mM K-포스페이트(phosphate) pH 6-8, 50mM Tris-HCl pH 7 내지 pH 9의 완충용액을 각각 사용하여, 최대 활성을 나타내는 pH를 살펴본 결과, 각 유사종별에 따른 pH 특성이 다르며, 특히 pH 7 내지 pH 9에서 높은 활성을 보임을 확인할 수 있었다. 구체적으로, TAX는 pH7, TP, TL, RM, DT는 pH8, TAS, TAM는 pH9 에서 활성이 특히 높게 나타났다. 또한, 각각의 pH에 해당되는 완충용액 중에서도 Tris-HCl 완충용액에서 활성이 최대로 나타나 해당 완충용액에서 가장 높은 활성을 보임을 확인하였다(도 4a 내지 도 4g). 도 5a 내지 도 5g 에 나타난 바와 같이, 실시예 2-1의 효소는 과당으로부터 타가토스를 제조할 수 있는 것을 확인하였다. 2-3. D-과당 4-에피머화 효소의 금속이온 요구성 분석 기존에 알려진 에피머효소(사이코스 3-에피머화 효소), 이성화 효소(포도당 이성화 효소, 아라비노스 이성화 효소)는 금속이온을 요구하는 것으로 알려져 있다. 상기 실시예 2-1에 얻어진 D-과당 4-에피머화 효소에 대해서도 금속이온이 영향을 미치는지 알아보았다. 상기 실시예 2-1에서 정제된 7종의 단백질에 금속이온 NiSO4, NiCl2, CuCl2, MnCl2, CaCl2, ZnSO4, MgSO4, MgCl, FeSO4, NaCl, LiCl, KCl 또는 CoCl2를 각각 1 mM씩 처리하여 효소활성을 측정하였다. 대조군으로 금속이온을 처리하지 않은 것을 사용하였다. 상기 측정된 각 금속 이온을 처리한 경우의 효소 활성을 대조군에서의 효소 활성과 비교하여 도 5a 내지 도 5g에 나타냈다. 도 5a 내지 도 5g 에 나타난 바와 같이, 실시예 2-1의 효소는 니켈이온 및 코발트이온 첨가에 의하여 활성이 증가하는 것으로 나타나 금속 이온 요구성이 있음을 알 수 있다. 특히, NiSO4를 첨가한 경우, 최대 활성을 보임을 확인하였다. 실시예 3. 과당으로부터 타가토스의 제조 상기 실시예 2에서 선정된 최적 효소반응 조건 하에서 타가토스 생산성을 확인하였다. 구체적으로는 실시예 2-1에서 정제한 D-과당 4-에피머화 효소를1mg/ml의 농도로 사용하여 반응온도는 상기 7종 효소 중 2종인 TAM, TP의 경우, 80 ℃에서, 5종인 RM, TAS, TAX, TL, DT 의 경우, 70 ℃에서, 50mM Tris-Cl 완충용액을 각각의 pH 별로 만들어 TAX는 pH7, TP, TL, RM, DT는 pH8, TAS, TAM는 pH9 및 황산니켈 0.1mM의 조건하에서 20g/L (약 110mM 농도)과당과 반응시켰다. 상기 실시예 2-2와 동일한 방법인 HPLC 분석을 진행하였다(도 2a 내지 도 2g). 상기 반응 결과 생산된 타가토스 생산량을 정량한 결과 과당에서 타가토스로의 전환율을 측정하였다. 그 결과는 표 2와 같다. 상기 확보된 반응완료액(타가토스와 과당 혼합액)을 탈색(활성탄 이용), 이온정제, 크로마토그래피, 결정화 공정을 거쳐 최종 결정 타가토스를 확보할 수 있다. The present invention relates to a composition for preparing tagatose, wherein the composition is used for preparing tagatose from fructose and contains a protein including any one amino acid sequence of SEQ ID NOS: 1 to 7 or a strain expressing the protein. In addition, the present invention relates to a method for preparing tagatose from fructose, the method comprising a step of allowing the composition to react with fructose. 서열번호 1 내지 7 중 어느 하나의 아미노산 서열로 이루어진 단백질 또는 상기 단백질을 발현하는 균주를 포함하는, 과당으로부터 타가토스를 제조하기 위한, 타가토스 제조용 조성물. 제1항에서 상기 단백질은 과당의 4번 탄소 위치를 에피머화하여 타가토스로 전환하는 효소 단백질인, 조성물. 제1항에 있어서, 상기 서열번호 1의 아미노산 서열로 이루어진 단백질은 로도써머스 마리누스( 제1항에 있어서, 상기 서열번호 2의 아미노산 서열로 이루어진 단백질은 써모토가 페트로필라( 제1항에 있어서, 상기 서열번호 3의 아미노산 서열로 이루어진 단백질은 써모토가 레틴게( 제1항에 있어서, 상기 서열번호 4의 아미노산 서열로 이루어진 단백질은 써모언에로박터 마쓰라니( 제1항에 있어서, 상기 서열번호 5의 아미노산 서열로 이루어진 단백질은 딕티오글로무스 터지덤( 제1항에 있어서, 상기 서열번호 6의 아미노산 서열로 이루어진 단백질은 써모언에로막테리움 자일노리티쿰 ( 제1항에 있어서, 상기 서열번호 7의 아미노산 서열로 이루어진 단백질은 써모언에로박터 시데로필러스( 제1항에 있어서, 상기 균주는 각각 서열번호 1 내지 7의 아미노산 서열로 이루어진 단백질을 코딩하는 유전자를 포함하는 재조합 벡터로 형질전환된, 조성물. 제1항에 있어서, 상기 서열번호 1의 아미노산으로 이루진 단백질은 분자량이 55 kDa 내지 60 kDa이고, 최적 활성 온도가 50 ℃ 내지 90 ℃이며, 최적 활성 pH가 6.0 내지 9.0인, 조성물. 제1항에 있어서, 상기 서열번호 2의 아미노산으로 이루진 단백질은 분자량이 55 kDa 내지 58 kDa이고, 최적 활성 온도가 50 ℃ 내지 90 ℃이며, 최적 활성 pH가 7.0 내지 9.0인, 조성물. 제1항에 있어서, 상기 서열번호 3의 아미노산으로 이루진 단백질은 분자량이 55 kDa 내지 58 kDa이고, 최적 활성 온도가 50 ℃ 내지 90 ℃이며, 최적 활성 pH가 7.0 내지 9.0인, 조성물. 제1항에 있어서, 상기 서열번호 4의 아미노산으로 이루진 단백질은 분자량이 55 kDa 내지 58 kDa이고, 최적 활성 온도가 50 ℃ 내지 80 ℃이며, 최적 활성 pH가 7.0 내지 10.0인, 조성물. 제1항에 있어서, 상기 서열번호 5의 아미노산으로 이루진 단백질은 분자량이 55 kDa 내지 58 kDa이고, 최적 활성 온도가 50 ℃ 내지 90 ℃이며, 최적 활성 pH가 7.0 내지 9.0인, 조성물. 제1항에 있어서, 상기 서열번호 6의 아미노산으로 이루진 단백질은 분자량이 53 kDa 내지 58 kDa이고, 최적 활성 온도가 50 ℃ 내지 90 ℃이며, 최적 활성 pH가 6.0 내지 9.0인, 조성물. 제1항에 있어서, 상기 서열번호 7의 아미노산으로 이루진 단백질은 분자량이 55 kDa 내지 58 kDa이고, 최적 활성 온도가 50 ℃ 내지 80 ℃이며, 최적 활성 pH가 7.0 내지 10.0인, 조성물. 제1항 내지 제17항 중 어느 한 항의 조성물을 과당과 반응시키는 단계를 포함하는, 과당으로부터 타가토스를 제조하는 방법. 제18항에 있어서, 상기 반응은 하기의 a) 내지 c)의 조건에서 이루어지는 것인 방법. a) 50 ℃ 내지 80 ℃의 반응 온도 b) pH 6.0 내지 9.0의 반응 pH c) 5%(w/v) 내지 60%(w/v)의 과당 농도 제18항에 있어서, 마그네슘 이온, 아연 이온, 니켈 이온, 코발트 이온, 철 이온, 망간 이온 또는 이들 혼합물을 추가로 포함하여 이루어지는 것인 방법.RM TAM TAS TAX TP TL DT 과당농도(g/L) 타가토스농도(g/L) 전환율(%) RM 20 3.8 19.0 TAX 20 1.7 8.6 TAM 20 3.3 16.7 TAS 20 2.5 12.4 TP 20 3.6 18.1 TL 20 3.9 19.4 DT 20 2.5 12.6