BRAIN TARGETING LONG-ACTING PROTEIN CONJUGATE
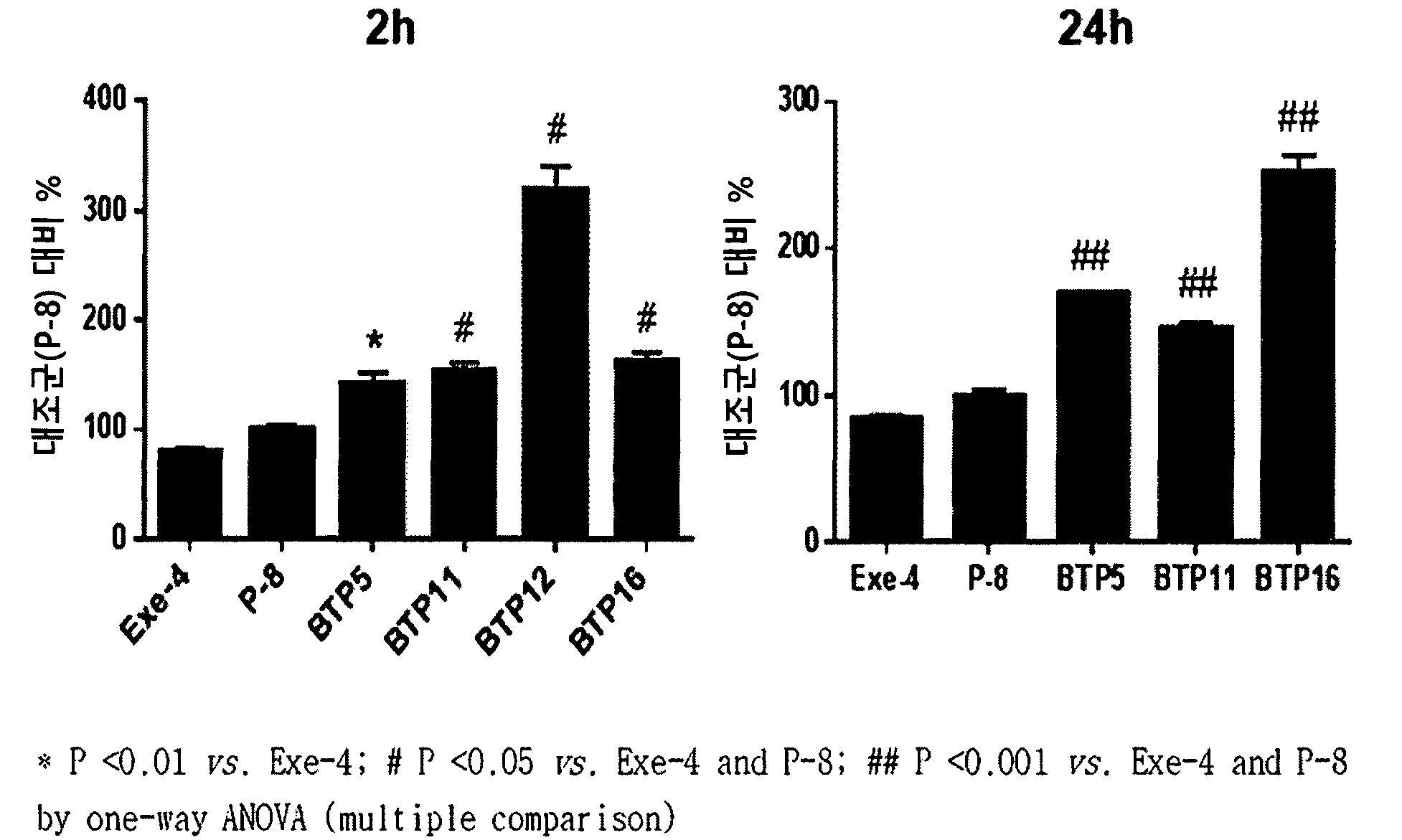
본 발명은 뇌 표적 가능한 지속형 단백질 결합체 및 이의 제조 방법에 관한 것이다. 또한, 본 발명은 신규한 뇌 표적 펩타이드 및 이의 용도에 관한 것이다. 뇌로의 효과적인 치료 약제 전달의 필요성이 대두되고 있으나, 뇌에 대한 새로운 약제의 개발은 나머지 신체에 비하여 훨씬 느린 속도로 진행되고 있다. 이러한 느린 진행은 대부분의 약제가 뇌혈관 장벽(blood-brain barrier, BBB)을 형성하는 뇌 모세관 벽(brain capillary wall)을 통하여 뇌 내로 침투할 수 없는 상황에 상당 부분 기인한다. 뇌혈관 장벽(blood-brain barrier, BBB)이란 뇌혈관의 내피세포 간의 조밀한 연결(tight junction) 및 이를 더욱 강화하는 성상세포(astrocyte)로 이루어진 구조물로서, 혈관 내부의 물질이 혈관벽을 통과하여 뇌 실질 내로 쉽게 나오지 않게 해 주는 기능을 한다. 이런 이유로 뇌질환 치료제로 개발된 상당수의 약이 뇌혈관 장벽의 통과가 잘 이루어지지 않는 문제점을 갖고 있다. 거의 100%의 거대-분자 약제 및 98% 이상의 소형-분자 약제는 BBB를 통과하지 못한다. 극히 일부의 약제, 높은 지질 용해도 및 400-500 달톤(dalton) 이하의 분자량을 보유하는 소형 분자만이 BBB를 실제로 통과한다. 또한, BBB를 통과하는 소형 분자 중에서, 극히 일부만 약학적으로 유의한 양으로 BBB를 통과한다. 소수의 뇌 질환, 예를 들면, 우울증, 정동 장애, 만성 통증, 간질만이 BBB를 통과하는 소형 분자 약제에 반응한다. 훨씬 많은 뇌 질환, 예를 들면, 알츠하이머병, 뇌졸중/신경 보호, 뇌와 척수 손상, 뇌암, 뇌의 HIV 감염, 다양한 실조증 유발성 장애(ataxia-producing disorder), 근위축성 측삭경화증(amyotrophic lateral sclerosis,ALS), 헌팅턴병(Huntington disease), 뇌에 영향을 주는 유년기 선천성 유전자 오류(childhood inborn genetic error), 파킨슨병(Parkinson's disease), 다발성 경화증(multiple sclerosis)은 통상적인 지질-용해성 소형 분자량 약제에 반응하지 않는다. 현재 뇌혈관 장벽을 통과하여 약물 등을 전달해 줄 수 있는 전달체(carrier)에 대한 개발이 활발하게 진행 중이다. 한편, 특정한 아미노산 서열을 갖는 펩타이드는 뇌혈관 장벽을 통과하며 약물이나 siRNA 등을 전달하는 기능을 갖고 있다고 알려져 있으나, 여전히 특정 구조체의 크기가 큰 생리활성 물질의 전달 가능성이 있는지에 대한 연구는 미비한 상태이다(Kumar 본 발명의 하나의 목적은 뇌 혈관 장벽을 통과하고, 생리활성 효력을 유지하고, 생리활성 물질의 반감기를 연장시킬 수 있는 생체 적합성 물질이 포함된, 뇌 표적 지속형 결합체를 제공하는 것이다. 본 발명의 또 하나의 목적은 생리활성 물질을, 면역글로불린 Fc영역이 융합된 뇌 표적 펩타이드의 면역글로불린 Fc 영역과 상호 결합에 의해 결합된, 뇌 표적 지속형 결합체를 제공하는 것이다. 본 발명의 또 하나의 목적은 뇌 표적 펩타이드와 생리활성 물질을 포함하는 지속형 결합체인, 하기의 화학식 1으로 표시되는 뇌 표적 지속형 결합체를 제공하는 것이다. X-L1-F-L2-Y 여기에서, X 는 생리 활성 물질이며, Y는 뇌 표적 펩타이드이고, L1 및 L2는 펩타이드성 또는 비펩타이드성 링커이고, L1 및 L2가 펩타이드성 링커일 때, 상기 펩타이드성 링커는 0부터 1000개의 아미노산을 포함하며, F는 FcRn 결합부위를 포함하는 면역글로불린 불변 영역임. 본 발명의 또 하나의 목적은 상기 면역글로불린 Fc 영역이 융합 또는 비펩타이드성 링커에 의해 연결된 뇌 표적 펩타이드 또는 생리활성 물질을 코딩하는 폴리뉴클레오티드, 상기 폴리뉴클레오티드를 포함하는 벡터, 상기 벡터를 포함하는 형질전환체, 상기 폴리뉴클레오티드, 벡터, 형질전환체를 하나 이상 포함하는 키트를 제공하는 것이다. 본 발명의 또 하나의 목적은 면역글로불린 Fc 영역과 융합된 뇌 표적 펩타이드 결합체가 코딩된 후 화학결합되고, 면역글로불린 Fc 영역과 융합된 뇌 표적 펩타이드결합체의 면역글로불린 Fc 영역이 생리활성 물질과 상호 결합에 의해 결합된 뇌 표적 지속형 결합체를 제공하는 것이다. 본 발명의 또 하나의 목적은 면역글로불린 Fc 영역과 융합된 뇌 표적 펩타이드 결합체가 코딩된 후 화학결합되고, 면역글로불린 Fc영역과 융합된 뇌 표적 펩타이드 결합체의 면역글로불린 Fc영역이 생리활성 물질과 상호결합에 의해 결합된 뇌 표적 지속성 결합체를 제조하는 방법을 제공하는 것이다. 본 발명의 또 하나의 목적은 상기 화학식 1을 갖는 뇌 표적 지속형 결합체를 제조하는 방법을 제공하는 것이다. 본 발명의 또 다른 목적은 상기 뇌 표적 지속형 결합체를 포함하는 조성물을 제공하는 것이다. 본 발명의 또 다른 목적은 약제의 제조에 있어서 상기 뇌 표적 지속형 결합체의 용도를 제공하는 것이다. 본 발명의 또 다른 목적은 신규한 뇌 표적 펩타이드를 제공하는 것이다. 본 발명의 또 하나의 목적은 상기 뇌 표적 펩타이드를 코딩하는 폴리뉴클레오티드, 상기 폴리뉴클레오티드를 포함하는 벡터, 상기 벡터를 포함하는 형질전환체, 또는 상기 폴리뉴클레오티드, 벡터, 및 형질전환체를 하나 이상 포함하는 키트를 제공하는 것이다. 본 발명을 구현하기 위한 하나의 양태는, 뇌 혈관 장벽을 통과하는, 생리 활성 효력을 유지하고, 생리 활성 물질의 반감기를 연장 시킬 수 있는 생체 적합성 물질이 포함된, 뇌 표적 지속형 결합체, 또는 이의 제조 방법을 제공한다. 본 발명을 구현하기 위한 보다 구체적인 양태는, 하기 화학식 1로 표시되는, 뇌 표적 지속형 결합체를 제공한다: [화학식 1] X-L1-F-L2-Y 여기에서, X 는 생리 활성 물질이며, Y는 뇌 표적 펩타이드이고, L1 및 L2는 펩타이드성 또는 비펩타이드성 링커이고, L1 및 L2가 펩타이드성 링커일 때, 상기 펩타이드성 링커는 0부터 1000개의 아미노산을 포함하며, F는 FcRn 결합부위를 포함하는 면역글로불린 불변 영역임. 하나의 구체예에서, 상기 F는 이량체 형태일 수 있다. 앞선 구체예에 따른 상기 뇌 표적 지속형 결합체에서, 상기 지속형 결합체는 뇌 혈관 장벽을 통과하여, 뇌 조직 내로 생리 활성 물질이 전달되는 것을 특징으로 한다. 앞선 구체예에 따른 상기 뇌 표적 지속형 결합체에서, 상기 뇌 표적 펩타이드는 뇌 혈관 장벽을 통과 가능한 아미노산 서열을 가지는, 펩타이드, 단백질 또는 항체를 포함하는 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 뇌 표적 펩타이드는 수동전달(passive transport)에 의한 경로 또는 수용체 매개 전달(receptor-mediated transport)에 의한 경로를 통해 뇌 혈관 장벽을 통과하는 것을 특징으로 할 수 있으나, 이에 제한되는 것은 아니다. 그 예로 뇌 혈관 장벽을 통과할 수 있는 펩타이드, 단백질 또는 항체로 특별히 그 종류 및 크기에 제한을 두지 않는다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 “아미노산”은 임의의 자연-발생 또는 비-자연 발생 또는 합성 아미노산 잔기를 포함하는 아미노산 모이어티(moiety), 다시 말하면, 1개, 2개, 3개 또는 그 이상의 탄소 원자, 전형적으로, 1개의 (α) 탄소원자에 의해 직접적으로 연결된 적어도 하나의 카르복실 잔기와 적어도 하나의 아미노 잔기를 포함하는 임의의 모이어티를 의미한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 뇌 표적 펩타이드는 수용체 매개 전달에 의한 경로를 통해 뇌 혈관 장벽을 통과하는 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 수용체 매개 전달(receptor-mediated transport)에 의한 경로는 인슐린 수용체(insulin receptor), 트랜스페린 수용체(transferrin receptor), 저밀도 지질단백질 수용체(low density lipoprotein receptor), 저밀도 지질단백질 수용체 관련 단백질(Low density lipoprotein receptor-related protein), 렙틴 수용체(leptin receptor), 니코틴성 아세틸콜린 수용체(nicotinic acetylcholine receptor), 글루타티온 수송체(Glutathione transporter), 칼슘의존성 칼륨통로(calcium-activated potassium channel), 및 RAGE (receptor for advanced glycation endproducts), 및 상기 수용체들의 리간드 및 상기 수용체 또는 리간드에 결합하는 항체로 이루어진 군으로부터 선택된 어느 하나를 통하여 수용체 매개 전달 경로에 의해 뇌 혈관 장벽을 통과하는 것을 특징으로 하나, 이에 제한되지 않는다. 상기 뇌 표적 펩타이드는 이러한 경로를 통해 뇌혈관 장벽을 통과하는 펩타이드, 단백질, 또는 항체로 이루어진 군에서 선택되거나, 상기 펩타이드, 단백질, 또는 항체로부터 분리된 일부 펩타이드 서열일 수 있으나, 이에 제한되지 않는다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 생리 활성 물질은 톡신; 또는 GLP-1(Glucagon like peptide-1) 수용체 아고니스트; 글루카곤 수용체 아고니스트; GIP(Gastric inhibitory polypeptide) 수용체 아고니스트; FGF(Fibroblast growth factor) 수용체 아고니스트; 콜레키스토키닌 (Cholecystokinin) 수용체 아고니스트; 가스트린(gastrin) 수용체 아고니스트; 멜라노코르틴(melanocortin) 수용체 아고니스트; 인간 성장호르몬; 성장호르몬 방출 호르몬; 성장호르몬 방출 펩타이드; 인터페론; 인터페론 수용체; 콜로니 자극인자 (과립구 콜로니 자극인자); 인터루킨; 인터루킨 수용체; 효소; 인터루킨 결합 단백질; 사이토카인 결합 단백질; 마크로파지 활성인자; 마크로파지 펩타이드; B 세포인자; T 세포인자; 단백질 A; 알러지 억제인자; 세포 괴사 당단백질; 면역독소; 림포독소; 종양 괴사인자; 종양 억제인자; 전이 성장인자; 알파-1 안티트립신; 알부민; 알파-락트알부민(alpha-lactalbumin); 아포리포 단백질-E; 적혈구 생성 인자; 고 당쇄화 적혈구 생성인자; 안지오포이에틴(angiopoietin); 헤모글로빈; 트롬빈(thrombin); 트롬빈 수용체 활성 펩타이드; 트롬보모듈린(thrombomodulin); 혈액인자 VII; 혈액인자 VIIa; 혈액인자 VIII; 혈액인자 IX; 혈액인자 XIII; 플라즈미노겐 활성인자; 피브린-결합 펩타이드; 유로키나제; 스트렙토키나제; 히루딘(hirudin); 단백질 C; C-반응성 단백질; 레닌 억제제; 콜라게나제 억제제; 수퍼옥사이드 디스뮤타제; 렙틴; 혈소판 유래 성장인자; 상피세포 성장인자; 표피세포 성장인자; 안지오스타틴(angiostatin); 안지오텐신(angiotensin); 골 형성 성장인자; 골 형성 촉진 단백질; 칼시토닌; 인슐린; 아트리오펩틴; 연골 유도인자; 엘카토닌(elcatonin); 결합조직 활성인자; 조직인자 경로 억제제(tissue factor pathway inhibitor); 여포 자극 호르몬; 황체 형성 호르몬; 황체 형성 호르몬 방출 호르몬; 신경 성장인자류; 악소제네시스 인자-1(axogenesis factor-1); 뇌-나트륨 이뇨 펩타이드(brain-natriuretic peptide); 신경교 유래 신경영양인자(glial derived neurotrophic factor); 네트린(netrin); 중성구 억제인자(neurophil inhibitor factor); 신경영양인자; 뉴트린(neuturin); 부갑상선 호르몬; 릴랙신; 시크레틴; 소마토메딘; 인슐린 유사 성장인자; 부신피질 호르몬; 글루카곤; 콜레시스토키닌; 췌장 폴리펩타이드; 가스트린 방출 펩타이드; 코티코트로핀 방출인자; 갑상선 자극호르몬; 오토탁신(autotaxin); 락토페린(lactoferrin); 미오스타틴(myostatin); ADNP(activity-dependent neuroprotective protein), BACE1(beta-secretase1), APP(Amyloid Precursor Protein), NCAM(Neural cell adhesion molecule), 아밀로이드 베타(Amyloid beta), 타우(Tau), RAGE(receptor for advanced glycation endproducts), 알파-시누클레인(alpha-synuclein), 또는 이들의 아고니스트 또는 안타고니스트; 수용체류, 수용체 아고니스트; 세포표면항원; 단일클론 항체; 다중클론 항체; 항체 단편; 바이러스 유래 백신 항원; 하나 이상의 수용체 아고니스트를 활성화 시키는 하이브리드 폴리펩타이드 또는 키메릭 (chimeric) 폴리펩타이드; 및 이들의 아날로그를 포함하는 군으로 이루어진 군에서 선택된 생리활성 물질인 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 톡신은 메이탄신(Maytansine) 또는 이의 유도체, 오리스타틴 (Auristatin) 또는 이의 유도체, 듀오카마이신(Duocarmycin) 또는 이의 유도체, 및 PBD(Pyrrolobenzodiazepine) 또는 이의 유도체로 이루어진 군에서 선택되고, GLP-1(Glucagon like peptide-1) 수용체 아고니스트는 천연형 엑센딘-3 또는 천연형 엑센딘-4, 및 이들의 아날로그로 이루어진 군에서 선택된 것이며, FGF 수용체 아고니스트는 FGF1 또는 이의 아날로그, FGF19 또는 이의 아날로그, FGF21 또는 이의 아날로그, 및 FGF23 또는 이의 아날로그로 이루어진 군에서 선택되고, 인터페론은 인터페론-알파, 인터페론-베타 및 인터페론-감마로 이루어진 군에서 선택되고, 인터페론 수용체는 인터페론-알파 수용체, 인터페론-베타 수용체, 인터페론-감마 수용체, 및 수용성 타입 I 인터페론 수용체로 이루어진 군에서 선택되고, 인터루킨은 인터루킨-1, 인터루킨-2, 인터루킨-3, 인터루킨-4, 인터루킨-5, 인터루킨-6, 인터루킨-7, 인터루킨-8, 인터루킨-9, 인터루킨-10, 인터루킨-11, 인터루킨-12, 인터루킨-13, 인터루킨-14, 인터루킨-15, 인터루킨-16, 인터루킨-17, 인터루킨-18, 인터루킨-19, 인터루킨-20, 인터루킨-21, 인터루킨-22, 인터루킨-23, 인터루킨-24, 인터루킨-25, 인터루킨-26, 인터루킨-27, 인터루킨-28, 인터루킨-29, 및 인터루킨-30으로 이루어진 군에서 선택되고, 인터루킨 수용체는 인터루킨- 1 수용체 또는 인터루킨-4 수용체이고, 효소는 베타글루코시다제(beta-glucosidase), 알파갈락토시다제(alpha-galactosidase), 베타갈락토시다제(beta-galactosidase), 이두로니다제(iduronidase), 이두로네이트 2-설파타제(iduronate-2-sulfatase), 갈락토스-6-설파타제(Galactose-6-sulfatase), 산성 알파-글루코시다제(acid alpha-glucosidase), 산성 세라미다제(acid ceramidase), 산성 스핑고미엘리나제(acid sphingomyelinsase), 갈락토세레브로시다제(galactocerebrosidsase), 아릴설파타제(arylsulfatase) A, 아릴설파타제 B, 베타-헥소사미니다제 (beta-hexosaminidase) A, 베타-헥소사미니다제 B, 헤파린-N-설파타제(heparin N-sulfatase), 알파-D-마노시다제(alpha-D-mannosidase), 베타-글루쿠로니다제(beta-glucuronidase), N-아세틸갈락토사민-6-설파타제(N-acetylgalactosamine-6 sulfatase), 리소좀 산성 리파제(lysosomal acid lipase), 알파-N-아세틸-글루코사미니다제(alpha-N-acetyl-glucosaminidase), 글루코세레브로시다제(glucocerebrosidase), 부티릴콜린에스터라제(butyrylcholinesterase), 키티나제(Chitinase), 글루타메이트 디카르복실라제(glutamate decarboxylase), 이미글루세라제(imiglucerase), 리파아제(lipase), 우리카제(Uricase), 혈소판활성인자 아세틸하이드로라제(Platelet-Activating Factor Acetylhydrolase), 뉴트럴 엔도펩티다제(neutral endopeptidase), 미엘로퍼옥시다제(myeloperoxidase), 알파-갈락토시다제-A, 아갈시다제 알파(agalsidase alpha), 아갈시다제 베타, 알파-L-이두로니다제(alpha-L-iduronidase), 뷰티릴콜린에스터라제(butyrylcholinesterase), 키티나제(chitinase), 글루타메이트 디카르복실라제(glutamate decarboxylase), 및 이미글루세라제(imiglucerase)로 이루어진 군에서 선택되고, 인터루킨 결합 단백질은 IL-18bp이고, 사이토카인 결합 단백질은 TNF (Tumor necrosis factor) 결합 단백질이고, 신경 성장인자류는 신경 성장인자, 모양체 신경영양인자(cilliary neurotrophic factor), 악소제네시스 인자-1(axogenesis factor-1), 뇌-나트륨 이뇨 펩타이드(brain-natriuretic peptide), 신경교 유래 신경영양인자(glial derived neurotrophic factor), 네트린(netrin), 중성구 억제인자(neurophil inhibitor factor), 신경영양인자, 및 뉴트린(neuturin)으로 이루어진 군에서 선택되고, 미오스타틴 수용체는 TNFR(P75), TNFR(P55), IL-1 수용체, VEGF 수용체, 및 B 세포 활성인자 수용체로 이루어진 군에서 선택되고, 미오스타틴 수용체 안타고니스트는 IL1-Ra이고, 세포표면 항원은 CD2, CD3, CD4, CD5, CD7, CD11a, CD11b, CD18, CD19, CD20, CD23, CD25, CD33, CD38, CD40, CD45 및 CD69로 이루어진 군에서 선택되고, 항체 단편류는 scFv, Fab, Fab', F(ab')2 및 Fd로 이루어진 군에서 선택되는 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 GLP-1 수용체 아고니스트는 천연형 엑센딘-4, 천연형 엑센딘-4의 N-말단 아민 그룹이 제거된 엑센딘-4, 천연형 엑센딘-4의 N-말단 아민 그룹이 하이드록실 그룹으로 치환된 엑센딘-4, 천연형 엑센딘-4의 N-말단 아민 그룹이 디메틸기로 수식된 엑센딘-4, 천연형 엑센딘-4의 N-말단 아민기가 카르복실기로 치환된 엑센딘-4, 천연형 엑센딘-4의 첫 번째 아미노산(히스티딘)의 알파 탄소가 제거된 엑센딘-4; 및 상기 엑센딘-4의 열두 번째 아미노산(라이신)이 세린으로 치환된 엑센딘-4 및 상기 엑센딘-4의 열두 번째 아미노산(라이신)이 알지닌으로 치환된 엑센딘-4로 이루어진 군에서 선택되는 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 L1은 F의 N-말단 영역에 연결되고, L2는 F의 C-말단 영역에 연결된 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 화학식 1의 F-L2-Y는 하기 화학식 2로 표시되는 구조인 것인, 뇌 표적 지속형 결합체인 것을 특징으로 한다: [화학식 2] 여기에서,Fa 및 Fb는 각각 힌지 영역, CH2 도메인, 및 CH3 도메인을 포함하는 면역글로불린 Fc 영역을 포함하는 한 가닥의 폴리펩타이드 사슬로서, Fa와 Fb는 힌지 영역에서 이황화 결합으로 서로 연결되어 Fc 절편을 포함하며, Fa는 L1과 공유결합으로 연결되고,각각의 BTPa1, ······, BTPan은 서로 같거나 다른 뇌 표적 펩타이드이고,각각의 BTPb1, ······, BTPbn'은 서로 같거나 다른 뇌 표적 펩타이드이며, 각각의 L2a1, ······, L2an은 서로 같거나 다른 펩타이드성 링커이고, 각각의 L2b1, ······, L2bn'은 서로 같거나 다른 펩타이드성 링커이며 이 때 n 및 n'은 각각 독립적으로 자연수이다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 L1은 Fa의 N-말단에 연결된 것이고, L2a1 및 L2b1는 각각 Fa 및 Fb의 C-말단에 연결된 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, n=n'이고 각각 L2a1 = L2b1, ······, L2an= L2bn'과 BTPa1 = BTPb1, ······, BTPan= BTPbn'의 조건을 만족하는 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 F는 Fa 및 Fb이며, L2-Y는 (L2a-Y)n 및 (L2b-Y)n'로서, 상기 뇌 표적 지속형 결합체는 하기 화학식 3으로 표시되는 것인, 뇌 표적 지속형 결합체인 것을 특징으로 한다: [화학식 3] 여기에서, 상기 X는 생리 활성 물질이며, L1은 펩타이드성 링커 또는 비펩타이드성 링커이고, Fa 및 Fb는 각각 힌지 영역, CH2 도메인, 및 CH3 도메인을 포함하는 면역글로불린 Fc 영역으로, Fa 및 Fb는 힌지 영역에 위치한 시스테인 잔기 간의 이황화 결합으로 서로 공유결합으로 연결된 것이며, Ya 및 Yb는 뇌 표적 펩타이드로, 각각 서로 같은 종류 또는 다른 종류의 뇌 표적 펩타이드고, L2a 및 L2b 각각은 펩타이드성 링커로, 상기 L2a 및 L2b는 서로 같은 종류 또는 다른 종류이며, n 및 n'은 각각 독립적으로 1이상의 자연수임. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 L1은 Fa의 N-말단 영역에 연결된 것이고, L2a 및 L2b는 각각 Fa 및 Fb의 C-말단 영역에 연결된 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 L1은 X의 아민기 또는 티올기에 연결된 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 L1은 X의 N-말단 아민기, 라이신의 측쇄에 위치한 아민기, 또는 시스테인의 측쇄에 위치한 -SH 기 (티올기)에 연결된 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 생리활성 물질인 X는 2개 내지 1000개의 아미노산으로 이루어진 폴리펩타이드인 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 n 및 n'은 1 내지 5인 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 L1은 0.5 내지 100 kDa 크기인 비펩타이드성 링커인 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 비펩타이드성 링커는 폴리에틸렌글리콜인 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 L2는 펩타이드성 링커이며, (GS)m, (GGS)m, (GGGS)m, 또는 (GGGGS)m이며, m은 1 내지 10인 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 화학식 1의 상기 L1 및 L2 중 하나는 펩타이드성 링커이고, 또 다른 하나는 비펩타이드성 링커인 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 화학식 1의 상기 L1은 비펩타이드성 링커이고, L2는 펩타이드성 링커일 때, 펩타이드성 링커는 0부터 1000개의 아미노산을 포함하는 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 화학식 1의 뇌 표적 지속형 결합체는 L1에 의해 X의 N-말단 및 F의 N-말단이 연결된 것이고, L2에 의해 Y의 N-말단 및 F의 C-말단이 연결된 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 지속형 결합체에서, 상기 화학식 1의 뇌 표적 지속형 결합체는 L1의 일 말단은 X의 라이신 잔기 또는 시스테인 잔기 등에, L1의 다른 말단은 F의 N-말단에 연결된 것이고, L2에 의해 Y의 N-말단 및 F의 C-말단이 연결된 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 화학식 1의 상기 L1 및 L2 중 어느 하나 또는 둘 다 비펩타이드성 링커일 때, 비펩타이드성 링커는 폴리에틸렌글리콜, 폴리프로필렌 글리콜, 에틸렌 글리콜-프로필렌 글리콜 공중합체, 폴리옥시에틸화폴리올, 폴리비닐알콜, 다당류, 덱스트란, 폴리비닐에틸에테르, 생분해성 고분자, 지질 중합체, 키틴류, 히알루론산, 지방산, 고분자 중합체, 저분자 화합물, 뉴클레오타이드 및 이들의 조합으로 이루어진 군으로부터 선택된 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 화학식 1의 상기 L1 및 L2 중 어느 하나 또는 둘 다 펩타이드성 링커일 때, 상기 X와 F, 또는 F와 Y는 공유 화학결합, 비공유 화학결합 또는 이들의 조합으로 L1 및 L2 에 의해 서로 결합되고, L1 및 L2 가 0부터 1000개의 아미노산을 포함하는 것을 특징으로 한다. 펩타이드성 링커가 0개의 아미노산일 경우는 공유 화학결합인 펩타이드 결합에 의해 결합된 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 화학식 1의 상기 L1 및 L2 중 어느 하나 또는 둘 다 펩타이드성 링커일 때, L1 및 L2 는 0개의 아미노산으로 이루어진 것으로, (i) X와 F, 또는 F와 Y는 펩타이드 결합에 의해 결합된 것이고; 또는 (ii) X와 F, 및 F와 Y는 펩타이드 결합에 의해 결합된 것인, 뇌 표적 지속형 결합체를 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 화학식 1의 L1 및 L2 중 어느 하나는 펩타이드성 링커이고, 이 중 다른 하나는 비펩타이드성 링커일 때, 펩타이드성 링커는 0부터 1000개의 아미노산을 포함하는 링커이며, 비펩타이드성 링커는 폴리에틸렌 글리콜인 것인, 뇌 표적 지속형 결합체인 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 화학식 1의 F는 면역글로불린 Fc 영역을 포함하는 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 면역글로불린 Fc 영역이 CH1, CH2, CH3 및 CH4 도메인으로 이루어진 군으로부터 선택되는 1개 내지 4개의 도메인을 포함하는 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 면역글로불린 Fc 영역이 힌지영역을 추가로 포함하는 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 면역글로불린 Fc 영역은 IgG의 Fc 영역인 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 면역글로불린 Fc 영역은 상기 면역글로불린 불변 영역은 IgG1 또는 IgG4 유래인 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 면역글로불린 Fc 영역은 IgG4 Fc 영역인 것을 특징으로 한다. 앞선 구체예 중 어느 하나에 따른 상기 뇌 표적 지속형 결합체에서, 상기 면역글로불린 Fc 영역이 인간 서열의 비당쇄화 IgG4 Fc 영역인 것을 특징으로 한다. 본 발명은 또 하나의 양태로서, 상기 화학식 1의 뇌 표적 지속성 결합체를 제조하는 방법을 제공한다. 하나의 구체예로서, 상기 제조 방법은 (i) (a) 생리 활성 물질인 X, 펩타이드성 또는 비펩타이드성 링커인 L1,및 면역글로불린 Fc 영역을 포함하는 F가 결합된, X-L1-F, 및 (b) 뇌 표적 펩타이드인 Y, 펩타이드성 또는 비펩타이드성 링커인 L2가 결합된 L2-Y를 제조하는 단계; 및 (ii) 상기 (a) X-L1-F 및 (b) L2-Y를 연결하는 단계를 포함하는 것을 특징으로 한다. 또 하나의 구체예로서, 상기 (a)의 L1은 펩타이드성 링커이고, (b)의 L2는 비펩타이드성 링커인 것을 특징으로 한다. 또 하나의 구체예로서, 상기 제조 방법은 (i) (a) 생리 활성 물질인 X, 및 펩타이드성 또는 비펩타이드성 링커인 L1이 결합된, X-L1 및 (b) 뇌 표적 펩타이드인 Y, 펩타이드성 또는 비펩타이드성 링커인 L2,및 면역글로불린 Fc 영역을 포함하는 F가 결합된 F-L2-Y를 제조하는 단계; 및 (ii) 상기 (a) X-L1 및 (b) F-L2-Y를 연결하는 단계를 포함하는 것을 특징으로 한다. 또 하나의 구체예로서, 상기 (a)의 L1은 비펩타이드성 링커이고, (b)의 L2는 펩타이드성 링커인 것을 특징으로 한다. 또 하나의 구체예로서, 상기 제조 방법은 (i) 뇌 표적 펩타이드인 Y, 펩타이드성 또는 비펩타이드성 링커인 L2, 및 면역글로불린 Fc 영역을 포함하는 F가 결합된 F-L2-Y를 제조하는 단계; 및 (ii) 상기 F-L2-Y와 X를 펩타이드성 또는 비펩타이드성 링커인 L1으로 연결하는 단계를 포함하는, 상기 화학식 1의 뇌 표적 지속형 결합체를 제조하는 방법인 것을 특징으로 한다. 또 하나의 구체예로서, 상기 L1은 비펩타이드성 링커이고, L2는 펩타이드성 링커인 것을 특징으로 한다. 또 하나의 구체예로서, 상기 비펩타이드성 링커 및 X 및 Y는 각각의 반응기에 의해 연결되고, 이때 비펩타이드성 링커의 반응기가 알데히드 그룹, 말레이미드(maleimide) 그룹 및 석시니미드 유도체(succinimide derivative)로 이루어진 군이 선택되는 것을 특징으로 한다. 본 발명은 또 하나의 양태로서, 면역글로불린 Fc 영역과 융합된 뇌 표적 펩타이드 결합체가 코딩된 후 화학결합하고, 화학결합된 면역글로불린 Fc 영역에 다른 생리활성 물질이 결합되어 서로 다른 생리활성 물질이 포함된 지속성 결합체를 제공한다. 상기 화학결합된 면역글로불린 Fc 영역 결합체는 2개의 면역글로불린 Fc 영역 (단량체 Fc 영역이 결합한 이량체 형태의 Fc 영역)을 가지며 각각에 결합하는 생리활성 물질은 1군데의 면역글로불린 영역 (단량체 Fc 영역)에만 결합되거나 2군데의 면역글로불린 영역 모두(이량체 형태의 Fc 영역 각각)에 결합될 수 있다. 상기 화학 결합은 공유결합일 수 있고, 보다 구체적으로 이황화 결합일 수 있고, 더욱 더 구체적으로는 두 면역글로불린 Fc 영역의 힌지 영역에서 형성되는 이황화 결합일 수 있으나, 특별히 이에 제한되는 것은 아니다. 보다 구체적으로, (i) 상기한 펩타이드성 링커 (예, 펩타이드 결합)를 통하여 뇌 표적 펩타이드가 한 분자의 면역글로불린 Fc 영역의 C-말단 부위에 연결된, 제1 면역글로불린 Fc 영역, 및 (ii) 상기한 펩타이드성 링커 (예, 펩타이드 결합)를 통하여 뇌 표적 펩타이드가 한 분자의 면역글로불린 Fc 영역의 C-말단 부위에 연결된, 제2 면역글로불린 Fc 영역이 화학결합을 통하여 이량체를 형성하고, 이러한 이량체 형태의 면역글로불린 Fc 영역 두 분자 중 한 분자의 N-말단 영역에 한 분자의 생리활성 물질이 연결되거나, 또는 두 분자 모두의 N-말단 영역 각각에 생리활성 물질이 하나씩 연결된 형태일 수 있으나, 특별히 이에 제한되지는 않는다. 상기한 제1 면역글로불린 Fc 영역 및 제2 면역글로불린 Fc 영역은 융합 단백질 형태로서, 면역글로불린 Fc 영역이 뇌 표적 펩타이드와 펩타이드 결합을 통하여 in-frame 융합된 것일 수 있으며, 상기 면역글로불린 Fc 영역은 힌지 영역, CH2 도메인, 및 CH3 도메인을 포함할 수 있으나, 특별히 이에 제한되지는 않는다. 상기 제1 면역글로불린 Fc 영역 및 제2 면역글로불린 Fc 영역 간의 화학 결합은 구체적으로 공유결합일 수 있으며, 보다 구체적으로 이황화 결합일 수 있고, 더욱 더 구체적으로는 두 면역글로불린 Fc 영역의 힌지 영역에서 형성되는 이황화 결합일 수 있으나, 특별히 이에 제한되는 것은 아니다. 본 발명을 구현하는 다른 하나의 양태는 상기 뇌 표적 지속형 단백질 결합체를 포함하는 조성물이다. 본 발명을 구현하는 다른 하나의 양태는 약제의 제조에 있어 상기 뇌 표적 지속형 단백질 결합체의 용도이다. 본 발명을 구현하는 다른 하나의 양태는, 신규한 뇌 표적 펩타이드이다. 하나의 구체예에서, 상기 뇌 표적 펩타이드는 서열번호 2, 4, 6, 8, 10, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38 및 40으로 표시되는 아미노산 서열 중 선택된 어느 하나의 아미노산 서열로 이루어진, 뇌 표적 펩타이드 인 것을 특징으로 한다. 본 발명을 구현하기 위한 다른 양태는 상기 뇌 표적 펩타이드를 코딩하는 분리된 폴리뉴클레오티드이다. 본 발명을 구현하기 위한 다른 양태는 상기 폴리뉴클레오티드를 포함하는 재조합 발현 벡터이다. 본 발명을 구현하기 위한 다른 양태는 상기 재조합 발현 벡터를 포함하는, 형질전환체이다. 본 발명의 뇌 표적 펩타이드와 생리활성 물질을 포함하는 뇌 표적 지속형 결합체는 생체내에서 뇌혈관 장벽을 통과하고, 생리활성을 유지하고, 혈중 반감기가 현저히 증가되는 효과가 있다. 상기 뇌 표적 지속형 결합체는 안정성 역시 개선되어, 뇌 관련 질환의 치료제로 이용 될 수 있다. 또한 신규한 뇌 표적 펩타이드를 제공하여, 신규한 뇌 표적 지속형 결합체를 제조하여, 뇌 관련 질환의 치료제로 이용될 수 있다. 도 1은 뇌 표적 펩타이드들의 뇌 혈관 장벽 (blood brain barrier) 통과 정도를 확인하기 위한 통과세포외배출 (transcytosis) 실험 결과를 나타낸 도이다. 도 2는 뇌 표적 펩타이드들의 뇌 혈관 장벽 통과 정도를 마우스에서 뇌 분포 실험을 수행하여 확인한 결과를 나타낸 도이다. 도 3은 면역글로불린 Fc 영역이 결합된 뇌 표적 펩타이드들과 면역글로불린 Fc 영역 단독의 뇌 혈관 장벽 통과 정도를 확인한 도이다. 도 4는 생리 활성 물질인 GIP 유도체를 포함하는 뇌 표적 지속형 결합체의 뇌 혈관 장벽 통과 정도를 확인하기 위한 통과세포외배출 실험 결과를 나타낸 도이다. 도 5는 생리 활성 물질인 이두설파제를 포함하는 뇌 표적 지속형 결합체에서 생리 활성 물질인 이두설파제의 생리 활성 유지 여부를 확인한 도이다. 이하, 본 발명을 상세히 설명한다. 한편, 본원에서 개시되는 각각의 설명 및 실시형태는 각각의 다른 설명 및 실시 형태에도 적용될 수 있다. 즉, 본원에서 개시된 다양한 요소들의 모든 조합이 본 발명의 범주에 속한다. 또한, 하기 기술되는 구체적인 서술에 의하여 본 발명의 범주가 제한된다고 할 수 없다. 또한, 당해 기술분야의 통상의 지식을 가진 자는 통상의 실험만을 사용하여 본 출원에 기재된 본 발명의 특정 양태에 대한 다수의 등가물을 인지하거나 확인할 수 있다. 또한, 이러한 등가물은 본 발명에 포함되는 것으로 의도된다. 본 명세서 전반을 통하여, 아미노산에 대한 통상의 1문자 및 3문자 코드가 사용된다. 또한, Dap (다이아미노프로피오닉산, diaminopropionic acid) 등과 같은 다른 아미노산에 대해 일반적으로 허용되는 3문자 코드가 사용된다. 또한, 본 명세서에서 약어로 언급된 아미노산은 IUPAC-IUB 명명법에 따라 기재되었다. 본 발명을 구현하기 하나의 양태는 뇌 표적 펩타이드와 생리 활성 물질을 포함하는 뇌 표적 지속형 결합체를 제공한다. 보다 구체적으로, 상기 뇌 표적 지속형 결합체는 면역글로불린 Fc 영역을 중심으로, 각각 펩타이드성 링커 및/또는 직접 융합 또는 비펩타이드성 링커에 의해 연결된 뇌 표적 펩타이드 및 생리 활성 물질이 결합된 것일 수 있으나, 이에 제한되지 않는다. 본 발명의 뇌 표적 지속형 결합체는 뇌 표적 펩타이드가 생리 활성 물질이 아닌, 면역글로불린 Fc 영역에 펩타이드성 링커, 직접 융합, 비펩타이드성 링커에 의해 연결된 것을 특징으로 한다. 본 발명을 구현하기 위한 보다 구체적인 양태는, 하기 화학식 1을 갖는 뇌 표적 지속형 결합체를 제공한다: [화학식 1] X-L1-F-L2-Y 여기에서, X는 생리 활성 물질이며, Y는 뇌 표적 펩타이드이고, L1 및 L2는 펩타이드성 또는 비펩타이드성 링커이고, L1 및 L2가 펩타이드성 링커일 때, 상기 펩타이드성 링커는 0부터 1000개의 아미노산을 포함하며, F는 FcRn 결합 부위를 포함하는 면역글로불린 불변 영역임. 이와 같은 본 발명의 지속형 결합체 형태는 뇌 표적 펩타이드와 Fc 영역을 중심으로 생리활성물질이 결합된 것을 특징으로 한다. 구체적으로는, 면역글로불린 Fc 영역에 결합하는 뇌 표적 펩타이드는 면역글로불린 Fc 영역과 펩타이드성 링커로 결합하고, 생리 활성 물질은 비펩타이성 링커로 결합하는 것을 특징으로 하나, 두 종류 모두 펩타이드성 링커 및/또는 비펩타이드성 링커로 결합할 수 있으며, 이에 제한되지 않는다. 상기 펩타이드성 링커는 0개 내지 1000개의 아미노산을 포함하는 링커일 수 있으나, 본 발명의 결합체를 형성할 수 있는 펩타이드성 링커는 제한 없이 포함된다. 상기 펩타이드성 링커가 0개의 아미노산을 포함하는 경우, 이는 링커가 아닌, 펩타이드 결합에 의해 융합된 형태의 결합체일 수 있다. 상기 뇌 표적 지속형 결합체의 화학식 1의 F-L2-Y는 하기 화학식 2로 표시되는 구조인 것인, 뇌 표적 지속형 결합체일 수 있다: [화학식 2] 여기에서, Fa 및 Fb는 각각 힌지 영역, CH2 도메인, 및 CH3 도메인을 포함하는 면역글로불린 Fc 영역을 포함하는 한 가닥의 폴리펩타이드 사슬로서, Fa와 Fb는 힌지 영역에서 이황화 결합으로 서로 연결되어 Fc 절편을 포함하며, Fa는 L1과 공유결합으로 연결되고,각각의 BTPa1, ······, BTPan은 서로 같거나 다른 뇌 표적 펩타이드이고,각각의 BTPb1, ······, BTPbn'은 서로 같거나 다른 뇌 표적 펩타이드이며, 각각의 L2a1, ······, L2an은 서로 같거나 다른 펩타이드성 링커이고, 각각의 L2b1, ······, L2bn'은 서로 같거나 다른 펩타이드성 링커이며 이 때 n 및 n'은 각각 독립적으로 자연수일 수 있다. 상기 뇌 표적 지속형 결합체에서, 상기 L1은 Fa의 N-말단에 연결된 것이고, L2a1 및 L2b1는 각각 Fa 및 Fb의 C-말단에 연결된 것일 수 있다. 상기 화학식 2의 뇌 표적 지속형 결합체에서, n=n'이고 각각 L2a1 = L2b1, ······, L2an= L2bn'과 BTPa1 = BTPb1, ······, BTPan= BTPbn'의 조건을 만족할 수 있으나, 이에 제한되지 않는다. 상기 뇌 표적 지속형 결합체의 화학식 1의 F는 Fa 및 Fb이며, L2-Y는 (L2a-Y)n 및 (L2b-Y)n'로서, 상기 뇌 표적 지속형 결합체는 하기 화학식 3로 표시되는 것일 수 있다: [화학식 3] 여기에서, 상기 X는 생리 활성 물질이며, L1은 펩타이드성 링커 또는 비펩타이드성 링커이고, Fa 및 Fb는 각각 힌지 영역, CH2 도메인, 및 CH3 도메인을 포함하는 면역글로불린 Fc 영역으로, Fa 및 Fb는 힌지 영역에 위치한 시스테인 잔기 간의 이황화 결합으로 서로 공유결합으로 연결된 것이며, Ya 및 Yb는 뇌 표적 펩타이드로, 각각 서로 같은 종류 또는 다른 종류의 뇌 표적 펩타이드고, L2a 및 L2b 각각은 펩타이드성 링커로, 상기 L2a 및 L2b는 서로 같은 종류 또는 다른 종류이며, n 및 n'은 각각 독립적으로 1이상의 자연수임. 상기 n 및 n'가 각각 독립적으로 2 이상의 자연수일 경우, 동일하거나 다른 종류의 뇌 표적 펩타이드가 2개 이상 연결되어 있는 것일 수 있으며, 상기 2이상의 뇌 표적 펩타이드는 종렬 (tandem)로 연결되어 있는 형태일 수 있으나, 이에 제한되지 않는다. 상기 n 및 n'은 1 또는 2이상의 자연수일 수 있으며, n 및 n'은 동일한 자연수이거나, 서로 상이한 자연수일 수 있으나, 이에 제한되지 않는다. n 및 n'은 1 내지 10, 1 내지 5일 수 있으며, 그 예로, 각각 1, 2, 3, 4, 5, 6, 7, 8, 9 또는 10일 수 있으나, 본 발명의 뇌 표적 지속형 결합체의 한 모이어티(moiety)를 구성하는 일 부분으로 결합된 Fc 영역 및 생리 활성 물질을 BBB를 통과하여, 뇌로 전달시킬 수 있는 개수는 제한없이 포함된다. 상기 뇌 표적 지속형 결합체는 L1에 의해 X의 N-말단 영역 및 F의 N-말단 영역이 연결된 것이고, L2에 의해 Y의 N-말단 영역 및 F의 C-말단 영역이 연결된 것일 수 있다. 또한, 상기 뇌 표적 지속형 결합체는 L1의 일 말단은 X의 라이신 잔기 또는 시스테인 잔기 등에, L1의 다른 말단은 F의 N-말단 영역에 연결된 것이고, L2에 의해 Y의 N-말단 영역 및 F의 C-말단 영역이 연결된 형태일 수 있다. 상기 뇌 표적 지속형 결합체의 L1은 F의 N-말단 영역에 연결되고, L2는 F의 C-말단 영역에 연결된 것일 수 있으며, 상기 L1은 Fa의 N-말단 영역에 연결된 것이고, L2a 및 L2b는 각각 Fa 및 Fb의 C-말단 영역에 연결된 것일 수 있다. 상기 L1은 X의 아민기 또는 티올기에 연결된 것일 수 있으며, L1은 X의 N-말단 아민기, 라이신의 측쇄에 위치한 아민기, 또는 시스테인의 측쇄에 위치한 -SH 기 (티올기)에 연결된 것일 수 있으나, 이에 제한되지 않는다. 본 발명에서 용어 "N-말단 영역"은 펩타이드 또는 단백질의 아미노 말단을 의미하는 것으로, 본 발명의 목적상 비펩타이드성 링커를 비롯한 링커와 결합할 수 있는 위치를 말한다. 그 예로, 이에 제한되지는 않으나, N-말단 영역의 최말단 아미노산 잔기뿐만 아니라 N-말단 주위의 아미노산 잔기를 모두 포함할 수 있으며, 구체적으로는 최말단으로부터 첫 번째 내지 20 번째의 아미노산 잔기를 포함할 수 있다. 그러나, 특별히 이에 제한되는 것은 아니다. 본 발명에서 용어 "C-말단 영역"은 펩타이드 또는 단백질의 카르복실 말단을 의미하는 것으로, 본 발명의 목적상 비펩타이드성 링커를 비롯한 링커와 결합할 수 있는 위치를 말한다. 그 예로, 이에 제한되지는 않으나, C-말단 영역의 최말단 아미노산 잔기뿐만 아니라 C-말단 영역 주위의 아미노산 잔기를 모두 포함할 수 있으며, 구체적으로는 최말단으로부터 첫 번째 내지 20번째의 아미노산 잔기를 포함할 수 있다. 그러나, 특별히 이에 제한되는 것은 아니다. 본 발명에서 용어, "뇌 표적 지속형 결합체"는 뇌 표적 펩타이드 및 생리활성 물질을 포함하며, 면역글로불린 불변 영역을 포함하고 FcRn 결합 부위을 갖는 물질에 뇌 표적 펩타이드 및 생리활성 물질이 각각 직간접적으로 연결된 구조를 가지는 결합체를 말한다. 상기 지속형 결합체는 "지속성 결합체"와 혼용될 수 있으며, 상기 지속형 결합체에 포함되는 생리활성 물질이, 생리활성 물질의 활성 지속 시간을 늘려 줄 수 있는, 면역글로불린 불변 영역을 포함하며 FcRn 결합부위를 갖는 생체 적합성 물질과 상기 0개 내지 1000개의 아미노산을 포함하는 펩타이드성 링커 및/또는 비펩타이드성 링커와 결합한 물질을 의미한다. 상기 뇌 표적 지속형 결합체는 뇌 혈관 장벽을 통과하여, 뇌 조직 내로 생리활성 물질을 전달할 수 있으나, 특별히 이에 제한되는 것은 아니다. 상기 뇌 표적 지속형 결합체를 구성하는 요소들을 보다 구체적으로 설명하면 다음과 같다. 본 발명에서, “뇌 표적 펩타이드”는 뇌 혈관 장벽을 통과할 수 있는 아미노산 서열을 포함하는 펩타이드, 또는 단백질, 또는 항체를 포함한다. 상기 뇌 표적 펩타이드는 본 발명의 뇌 표적 지속형 결합체를 구성하는 하나의 모이어티에 해당한다. 또한, 상기 뇌 표적 펩타이드는 공지의 펩타이드, 단백질, 또는 항체로부터 분리된 일부 서열로서, BBB를 통과하여 뇌 혈관 장벽을 통과할 수 있는 활성을 보유한 것일 수 있다. 본 발명에서 용어, “아미노산”은 임의의 자연-발생 또는 비-자연 발생 또는 합성 아미노산 잔기를 포함하는 아미노산 모이어티(moiety), 다시 말하면, 1개, 2개, 3개 또는 그 이상의 탄소 원자, 전형적으로, 1개의 (α) 탄소원자에 의해 직접적으로 연결된 적어도 하나의 카르복실 잔기와 적어도 하나의 아미노 잔기를 포함하는 임의의 모이어티를 의미한다. 본 발명의 뇌 표적 펩타이드는 수동전달(passive transport)에 의한 경로 또는 수용체 매개 전달(receptor-mediated transport)에 의한 경로를 통해 뇌 혈관 장벽을 통과하는 것을 특징으로 할 수 있으나, 이에 제한되는 것은 아니다. 그 예로 뇌 혈관 장벽을 통과할 수 있는 펩타이드, 단백질 또는 항체로 특별히 그 종류 및 크기에 제한을 두지 않는다. 한편, 상기 뇌 표적 펩타이드는 수용체 매개 전달에 의한 경로를 통해 뇌혈관 장벽을 통과하는 것일 수 있다. 한편, 상기 뇌 표적 펩타이드는 수용체 매개 전달에 의한 경로를 통해 뇌 혈관 장벽을 통과하는 것일 수 있다. 구체적으로, 상기 뇌 표적 펩타이드는 인슐린 수용체(insulin receptor); 트랜스페린 수용체(transferrin receptor); 저밀도 지질단백질 수용체(low density lipoprotein receptor); 저밀도 지질단백질 수용체 관련 단백질(Low density lipoprotein receptor-related protein); 렙틴 수용체(leptin receptor); 니코틴성 아세틸콜린 수용체(nicotinic acetylcholine receptor); 글루타티온 수송체(Glutathione transporter); 칼슘의존성 칼륨통로(calcium-activated potassium channel); 및 RAGE (receptor for advanced glycation endproducts); 및 상기 수용체들의 리간드, 및 상기 수용체 또는 리간드에 결합하는 항체로 이루어진 군에서 선택되는 어느 하나를 통하여 수용체 매개 전달 경로에 의해 뇌 혈관 장벽을 통과할 수 있으나, 특별히 이에 제한되지 않는다. 이러한 경로를 통해 뇌혈관 장벽을 통과하는 펩타이드, 단백질, 항체로 이루어진 군에서 선택된 것일 수 있으며, 또는, 상기 펩타이드, 단백질, 또는 항체로부터 분리된 일부 펩타이드 서열일 수 있으나, 이에 제한되지 않는다. 그 예로, 서열번호 2의 HAITYPRH 펩타이드(BTP1 펩타이드), 서열번호 4의 THR 펩타이드 (BTP2 펩타이드), 서열번호 6의 Angiopep-2 펩타이드 (BTP3 펩타이드), 서열번호 8의 ApoB 펩타이드 (BTP4 펩타이드), 서열번호 10의 ApoE 펩타이드(BTP5 펩타이드) 등의 펩타이드가 이용될 수 있으나, 본 발명의 뇌 표적 지속형 결합체에 포함되어, 결합된 F-L2-Y 구조체를 BBB를 통과하여 뇌 내로 전달 시킬 수 있는 펩타이드는 제한 없이 포함된다. 또 하나의 구체예로서, 서열번호 20의 BTP6 펩타이드, 서열번호 22의 BTP7 펩타이드, 서열번호 24의 BTP8 펩타이드, 서열번호 26의 BTP9 펩타이드, 서열번호 28의 BTP10 펩타이드, 서열번호 30의 BTP11 펩타이드, 서열번호 32의 BTP12 펩타이드, 서열번호 34의 BTP13 펩타이드, 서열번호 36의 BTP14 펩타이드, 서열번호 38의 BTP15 펩타이드, 또는 서열번호 40의 BTP16 펩타이드일 수 있으나, 이에 제한되지 않는다. 또 하나의 구체예로서, 상기 뇌 표적 펩타이드는 (1) Angiopep-2 : TFFYGGSRGKRNNFKTEEY- (2) ApoB(3371-3409) : SVIDALQYKLEGTTRLTRKRGLKLATALSLSNKFVEGS (서열번호: 42), (3) ApoE(159-167)2 : (LRKLRKRLL)2 (서열번호: 43), (4) 펩타이드-22 : Ac-C(&)MPRLRGC(&)-NH2 (서열번호: 44), (5) THR : THRPPMWSPVWP-NH2 (서열번호: 45), (6) THR (7) CRT : C(&)RTIGPSVC(&)(서열번호: 47), (8) Leptin 30 : YQQILTSMPSRNVIQISNDLENLRDLLHVL(서열번호: 48), (9) RVG29 : YTIWMPENPRPGTPCDIFTNSRGKRASNG- (10)DCDX : GreirtGraerwsekf-OH (서열번호: 50) (11) Apamin : C(&1)NC(&2)KAPETALC(&1)-ARRC(&2)QQH-NH2 (12) MiniAp-4 :(&)KAPETALD(&)(서열번호: 52), (13) GSH : γ-L-glutamyl-CG-OH (14) G23 : HLNILSTLWKYRC(서열번호: 53), (15) g7 : GFtGFLS(O-β-Glc)-NH2 (서열번호: 54), (16) TGN : TGNYKALHPHNG (서열번호: 55), (17) TAT(47-57) : YGRKKRRQRRR-NH2 (서열번호: 56), (18) SynB1 : RGGRLSYSRRRFSTSTGR (서열번호: 57), (19) Diketopiperazines : &(N-MePhe)-(N-MePhe)Diketopiperazines, 또는 (20) PhPro : (Phenylproline)4-NH2(서열번호: 58)일 수 있으나, 이에 제한되지 않는다. 상기 서열에서 &은 J. Pept. Res., 2005, 65, 550-555 (J.Spengler et al.)에 기재된 고리형 펩타이드에 대한 명명법에 따른 기호로서, '&'은 연결 위치(connecting point)를 말한다. 예를 들어, 단일 쇄에서 첫 번째로 기재된 '&'은 화학 결합의 일 말단의 위치를, 두 번째로 기재된 '&'은 상기 화학 결합이 부착되는 부위를 말한다. 예컨대, "&Ala-Ala-Phe-Leu-Pro&"은 알라닌과 프롤린 간에 화학 결합이 형성되어 고리형 펩타이드를 형성함을 나타낸다. 2 이상의 화학 결합이 존재할 경우, 해당 화학 결합이 형성되는 위치를 나타내기 위하여 &1, &2와 같은 기호를 사용할 수 있다. 예를 들어, &1Asp(&2)-Trp-Phe-Dpr(&2)-Leu-Met&1과 같이 표시된 경우, Asp 및 Met 간에 화학 결합이 형성되고, Asp 및 Dpr 간에 화학 결합이 형성되는 것을 말한다. 한편,은 다이아미노프로피오닉산(diaminopropionic acid)을 나타낸다. 본 발명에서, "생리 활성 물질"은 상기 뇌 표적 지속형 결합체의 모이어티(moiety)를 이루는 일 구성일 수 있는 것으로, 생체 내에서 어떤 생리 작용을 가지는 물질을 총칭하는 개념으로서, 다양한 생리활성을 가진다. 상기 생리활성 물질인 X는 2개 내지 1000개의 아미노산, 2개 내지 950개, 2개 내지 900개, 2개 내지 850개, 2개 내지 800개, 2개 내지 750개, 2개 내지 700개, 5개 내지 700개 의 아미노산, 5개 내지 650개, 5개 내지 600개, 5개 내지 550개, 5개 내지 500개, 5개 450개, 5개 400개, 5개 내지 350개, 5개 내지 300개, 5개 내지 250개, 5개 내지 200개, 5개 내지 150개, 5개 내지 100개, 5개 내지 90개, 5개 내지 80개, 5개 내지 70개, 5개 60개, 5개 내지 50개, 5개 내지 40개, 5개 내지 30개, 5개 내지 25개, 또는 5개 내지 20개 내외로 이루어진 폴리펩타이드일 수 있으나, 이에 제한되지 않는다. 상기 생리 활성 물질을 구성하는 폴리펩타이드는 펩타이드, 올리고펩타이드, 폴리펩타이드 또는 단백질을 모두 포함한다. 상기 생리활성 물질은 톡신 또는 생리활성 폴리펩타이드일 수 있고, 인간의 질병을 치료 또는 예방할 목적으로 사용되는 사이토카인, 인터루킨, 인터루킨 결합 단백질, 효소, 항체, 성장인자, 전사조절인자, 혈액인자, 백신, 구조단백질, 리간드 단백질 또는 수용체, 세포표면항원, 수용체 안타고니스트, 당뇨 및 비만에 치료효과를 보이는 소장 및 췌장에서 분비되는 생리활성 펩타이드, GPCR (G protein-coupled receptors) 아고니스트 혹은 안타고니스트 등과 같은 다양한 생리활성 폴리펩타이드, 이들의 아날로그들을 예시할 수 있으나, 이에 제한되지 않는다. 본 발명에서 사용되는 용어, "X의 아날로그"는 X와 동일한 종류의 활성을 나타낼 수 있는 물질로서, X의 아고니스트(agonist), X의 유도체(derivatives), X의 단편(fragments), X의 변이체(variants) 등을 모두 포함한다. 구체적으로 톡신은 암세포 사멸에 효과적인 메이탄신 (maytansine) 및/또는 이의 유도체, 오리스타틴 (auristatin) 및/또는 그 유도체, 듀오카마이신 (duocarmycin) 및/또는 그 유도체, PBD (pyrrolobenzodiazepine) 및/또는 그 유도체 중에서 선택될 수 있으나, 암세포 사멸에 효력을 보이는 톡신은 제한 없이 포함된다. 구체적으로, 생리활성 폴리펩타이드는 GLP-1 수용체 아고니스트, 글루카곤 수용체 아고니스트, GIP (Gastric inhibitory polypeptide) 수용체 아고니스트, FGF (Fibroblast growth factors) 수용체 아고니스트 (FGF1, FGF19, FGF21, FGF23 등), 콜레시스토키닌 (Cholecystokinin) 수용체 아고니스트, 가스트린 (gastrin) 수용체 아고니스트, 멜라노코르틴 (melanocortin) 수용체 아고니스트, 인간 성장호르몬, 성장호르몬 방출 호르몬, 성장호르몬 방출 펩타이드, 인터페론류와 인터페론 수용체류 (예: 인터페론-알파, -베타 및 -감마, 수용성 타입 I 인터페론 수용체 등), 콜로니 자극인자, 인터루킨류(예: 인터루킨-1, -2, -3, -4, -5, -6, -7, -8, -9, -10, -11, -12, -13, -14, -15, -16, -17, -18, -19, -20, -21, -22, -23, -24, -25, -26, -27, -28, -29, -30 등)와 인터루킨 수용체류(예: IL-1 수용체, IL-4 수용체 등), 효소류 (예: 베타글루코시다제 (beta-glucosidase), 알파갈락토시다제 (alpha-galactosidase), 베타갈락토시다제 (beta-galactosidase), 이두로니다제 (iduronidase), 이두로네이트 2-설파타제 (iduronate-2-sulfatase), 갈락토스-6-설파타제 (Galactose-6-sulfatase), 산성 알파-글루코시다제 (acid alpha-glucosidase), 산성 세라미다제 (acid ceramidase), 산성 스핑고미엘리나제 (acid sphingomyelinsase), 갈락토세레브로시다제 (galactocerebrosidsase), 아릴설파타제 (arylsulfatase) A, B, 베타-헥소사미니다제 (beta-hexosaminidase) A, B, 헤파린-N-설파타제 (heparin N-sulfatase), 알파-D-마노시다제 (alpha-D-mannosidase), 베타-글루쿠로니다제 (beta-glucuronidase), N-아세틸갈락토사민-6-설파타제 (N-acetylgalactosamine-6 sulfatase), 리소좀 산성 리파제 (lysosomal acid lipase), 알파-N-아세틸-글루코사미니다제 (alpha-N-acetyl-glucosaminidase), 글루코세레브로시다제 (glucocerebrosidase), 부티릴콜린에스터라제 (butyrylcholinesterase), 키티나제 (Chitinase), 글루타메이트 디카르복실라제 (glutamate decarboxylase), 이미글루세라제 (imiglucerase), 리파아제 (lipase), 우리카제 (Uricase), 혈소판활성인자 아세틸하이드로라제 (Platelet-Activating Factor Acetylhydrolase), 뉴트럴 엔도펩티다제 (neutral endopeptidase), 미엘로퍼옥시다제 (myeloperoxidase), 알파-갈락토시다제-A, 아갈시다제 알파(agalsidase alpha), 베타, 알파-L-이두로니다제(alpha-L-iduronidase), 뷰티릴콜린에스터라제(butyrylcholinesterase), 키티나제(chitinase), 글루타메이트 디카르복실라제(glutamate decarboxylase), 이미글루세라제(imiglucerase), 리파제(lipase), 유리케이즈(uricase), 혈소판-활성인자 아세틸하이드롤라제(platelet-activating factor acetylhydrolase), 중성 엔도펩티다제(neutral endopeptidase), 및 마이엘로퍼옥시다제(myeloperoxidase) 등), 인터루킨 및 사이토카인 결합 단백질류(예: IL-18bp, TNF-결합 단백질 등), 마크로파지 활성인자, 마크로파지 펩타이드, B 세포인자, T 세포인자, 단백질 A, 알러지 억제인자, 세포 괴사 당단백질, 면역독소, 림포독소, 종양 괴사인자, 종양 억제인자, 전이 성장인자, 알파-1 안티트립신, 알부민, 알파-락트알부민(alpha-lactalbumin), 아포리포단백질-E, 적혈구 생성인자, 고 당쇄화 적혈구 생성인자, 안지오포이에틴류(angiopoietin), 헤모글로빈, 트롬빈(thrombin), 트롬빈 수용체 활성 펩타이드, 트롬보모듈린(thrombomodulin), 혈액인자 VII, 혈액인자 VIIa, 혈액인자 VIII, 혈액인자 IX, 혈액인자 XIII, 플라즈미노겐 활성인자, 피브린-결합 펩타이드, 유로키나제, 스트렙토키나제, 히루딘(hirudin), 단백질 C, C-반응성 단백질, 레닌 억제제, 콜라게나제 억제제, 수퍼옥사이드 디스뮤타제, 렙틴, 혈소판 유래 성장인자, 상피세포 성장인자, 표피세포 성장인자, 안지오스타틴(angiostatin), 안지오텐신(angiotensin), 골 형성 성장인자, 골 형성 촉진 단백질, 칼시토닌, 인슐린, 아트리오펩틴, 연골 유도인자, 엘카토닌(elcatonin), 결합조직 활성인자, 조직인자 경로 억제제(tissue factor pathway inhibitor), 여포 자극 호르몬, 황체 형성 호르몬, 황체 형성 호르몬 방출 호르몬, 신경 성장인자류(예: 신경 성장인자, 모양체 신경영양인자(cilliary neurotrophic factor), 악소제네시스 인자-1(axogenesis factor-1), 뇌-나트륨 이뇨 펩타이드(brain-natriuretic peptide), 신경교 유래 신경영양인자(glial derived neurotrophic factor), 네트린(netrin), 중성구 억제인자(neurophil inhibitor factor), 신경영양인자, 뉴트린(neuturin), 부갑상선 호르몬, 릴랙신, 시크레틴, 소마토메딘, 인슐린 유사 성장인자, 부신피질 호르몬, 글루카곤, 콜레시스토키닌, 췌장 폴리펩타이드, 가스트린 방출 펩타이드, 코티코트로핀 방출인자, 갑상선 자극호르몬, 오토탁신(autotaxin), 락토페린(lactoferrin), 미오스타틴(myostatin), ADNP(activity-dependent neuroprotective protein), BACE1(beta-secretase1), APP(Amyloid Precursor Protein), NCAM(Neural cell adhesion molecule), 아밀로이드 베타(Amyloid beta), 타우(Tau), RAGE(receptor for advanced glycation endproducts), 알파-시누클레인(alpha-synuclein), 또는 이들의 아고니스트 또는 안타고니스트, 이들의 수용체류(예: TNFR(P75), TNFR(P55), IL-1 수용체, VEGF 수용체, B 세포 활성인자 수용체 등), 수용체 길항물질(예: IL1-Ra 등), 세포표면항원(예: CD 2, 3, 4, 5, 7, 11a, 11b, 18, 19, 20, 23, 25, 33, 38, 40, 45, 69 등), 단일클론 항체, 다중클론 항체, 항체 단편류(예: scFv, Fab, Fab', F(ab')2 및 Fd), 바이러스 유래 백신 항원, 하나 이상의 수용체 아고니스트를 활성화 시키는 하이브리드 폴리펩타이드 혹은 키메릭 (chimeric) 폴리펩타이드 등을 예시할 수 있으나, 이에 한정되는 것은 아니다. 본 발명의 용어, "이두로네이트 2-설파타제(iduronate-2-sulfatase)"는, 헌터 증후군(Hunter syndrome, MPS-II)에 관계된 설파타제 효소로서, 헤파란 설페이트(heparin sulfate) 및 데르마탄 설페이트(dermatan sulfate)의 리소좀 분해에 필요한 효소이다. 본 발명의 한 구체적인 형태에서는 "이두로네이트 2-설파타제(iduronate-2-sulfatase)"로 사람 이두로네이트 2-설파타제의 한 정제 형태인 "이두설파제(idursulfase)"를 사용할 수 있으며, 상기 이두로네이트 2-설파타제에 포함됨은 자명하다. 상기 이두설파제는 예를 들어 이두설파제 알파 또는 이두설파제 베타일 수 있으나, 이에 제한되지 않는다. 상기 이두로네이트 2-설파타제 효소는 당업계에서 알려진 방법으로 준비 또는 제조할 수 있으며, 구체적으로, 동물세포 발현 벡터를 삽입한 동물세포를 배양하여, 배양물로부터 정제할 수 있고, 또는 상업적으로 이용 가능한 효소를 구입하여 사용할 수 있으나, 이에 제한되지 않는다. 본 발명에서 적용 가능한 생리활성 폴리펩타이드는 천연형이거나, 대장균과 같은 원핵세포나 효모세포, 곤충세포 또는 동물세포와 같은 진핵세포에서 유전자 재조합에 의해 생산된 것일 수 있으며, 또한 천연형과 동등한 활성 또는 동종의 활성을 보유하는 아날로그일 수 있으며, 예컨대 하나 이상의 아미노산 위치에서 돌연변이가 일어난 유도체일 수 있으나, 이에 제한되지 않는다. 한편, 상기 GLP-1 수용체 아고니스트는 천연형 엑센딘-4, 엑센딘-4의 N-말단 아민 그룹이 제거된 엑센딘-4 유도체, 엑센딘-4의 N-말단 아민 그룹이 하이드록실 그룹으로 치환된 엑센딘-4 유도체, 엑센딘-4의 N-말단 아민 그룹이 디메틸기로 수식된 엑센딘-4 유도체, 엑센딘-4의 첫 번째 아미노산(히스티딘)의 알파 탄소를 제거 (deletion)한 엑센딘-4 유도체, 엑센딘-4의 열두 번째 아미노산(라이신)이 세린으로 치환된 엑센딘-4 유도체, 및 엑센딘-4의 열두 번째 아미노산(라이신)이 알지닌으로 치환된 엑센딘-4 유도체로 이루어진 군에서 선택될 수 있으나, 특별히 이에 제한되지 않는다. 본 발명은 하나의 구체예로서, 생리활성 물질이 면역글로불린 Fc 영역과 융합된 뇌 표적 펩타이드의 면역글로불린 Fc 영역에 상호결합으로 결합된 것을 특징으로 하는, 뇌 표적 지속형 결합체를 제공하는 것이다. 본 발명에서 “F”는 면역글로불린 불변 영역을 포함하며, FcRn 결합부위를 포함하는 물질을 말한다. 구체적으로, 본 발명의 뇌 표적 지속형 결합체를 구성하는 하나의 모이어티에 해당한다. 그 예로, 상기 F는 FcRn 결합부위를 함유하는 면역글로불린 Fc 영역일 수 있다. 또 하나의 구체예로서 면역글로불린 Fc 영역과 융합된 뇌 표적 펩타이드의 면역글로불린 Fc 영역은 면역글로불린 Fc 영역외에 생체적합성 물질일 수 있다. 본 발명에서 용어, "생체적합성 물질"이란 생리활성 물질과 융합 또는 공유결합되어 결합체를 형성했을 때, 생리활성 물질의 생체 내 반감기를 증가하여 활성 지속시간을 늘려줄 수 있는 물질이다. 그 예로, 반감기 증대 및 생체 이용율 및 지속적인 활성유지가 최우선 목적이므로 생리활성 물질과 융합 또는 결합될 수 있는 것은 다양한 생체적합성 물질, 예를 들어 폴리에틸렌 글리콜, 지방산, 콜레스테롤, 알부민 및 이의 단편, 알부민 결합물질, 엘라스틴, 엘라스틴의 수용성 전구체 및 엘라스틴 단백질 서열 일부의 반복단위의 중합체, 특정 아미노산 서열의 반복단위의 중합체, 항체, 항체단편, FcRn 결합물질, 생체내 결합조직, 뉴클레오타이드, 파이브로넥틴, 트랜스페린(Transferrin), 다당류(saccharide), 고분자 중합체 등을 제한 없이 포함한다. 면역글로불린 Fc 영역은 생체 내에서 대사되는 생분해성의 폴리펩타이드이기 때문에, 약물의 캐리어로 사용하기에 안전하다. 또한, 면역글로불린 Fc 영역은 면역글로불린 전체 분자에 비해 상대적으로 분자량이 적기 때문에 결합체의 제조, 정제 및 수율 면에서 유리할 뿐만 아니라, 아미노산 서열이 항체마다 다르기 때문에 높은 비균질성을 나타내는 Fab 부분이 제거되기 때문에, 물질의 동질성이 크게 증가되고 혈중 항원성의 유발 가능성도 낮아지게 되는 효과도 기대할 수 있다. 본 발명에서 사용되는 면역글로불린 Fc 영역과 융합된 뇌 표적 펩타이드 결합체는 면역글로불린 Fc 영역과 펩타이드 결합으로 연결되어 발현 숙주에서 지속형 결합체로 생산된다. 발현 숙주는 외부 유전자로 형질전환시켜 단백질을 생산할 수 있는 대장균과 같은 미생물일 수 있으며, 효모, 곤충세포, 동물세포등 제한이 없다. 본 발명에서, "면역글로불린 불변영역"은 뇌 표적 지속형 결합체의 모이어티(moiety)를 이루는 일 구성일 수 있는 것으로, 면역글로불린의 중쇄와 경쇄 가변영역과 경쇄 불변영역(CL1)을 제외한, 중쇄 불변영역 2 (CH2)및 중쇄 불변영역 3(CH3)부분을 포함한다. 중쇄 불변영역에 힌지(hinge) 부분을 포함하기도 한다. 상기 면역글로불린 불변 영역은 면역글로불린 Fc 영역일 수 있다. 상기 F의 면역글로불린 불변 영역은 면역글로불린 CH1, CH2, CH3, 및 CH4 도메인으로 이루어진 군으로부터 선택된 1개 내지 4개의 도메인을 포함하는 것일 수 있다. 본 발명의 면역글로불린 불변영역은 1) CH1 도메인, CH2 도메인, CH3 도메인 및 CH4 도메인, 2) CH1 도메인 및 CH2 도메인, 3) CH1 도메인 및 CH3 도메인, 4) CH2 도메인 및 CH3 도메인, 5) CH1 도메인, CH2 도메인, CH3 도메인 및 CH4 도메인 중 1개 또는 2개의 이상의 도메인과 면역글로불린 힌지 영역(또는 힌지 영역의 일부)와의 조합 (예컨대, CH2 도메인과 CH3 도메인 그리고 힌지 영역 (또는 그 일부)와의 조합), 6) 중쇄 불변영역 각 도메인과 경쇄 불변영역의 이량체일 수 있다. 본 발명의 힌지 영역은 천연의 힌지 영역 뿐 아니라, 공지의 힌지 영역의 일부를 모두 포함한다. 구체적으로, 상기 F의 면역글로불린 불변 영역은 힌지 영역, CH2 도메인 및 CH3 도메인을 포함할 수 있으나, 특별히 이에 제한되지는 않는다. 또한, 본 발명의 면역글로불린 Fc 영역은 천연형 아미노산 서열뿐만 아니라 이의 서열유도체(mutant)를 포함한다. 아미노산 서열 유도체란 천연 아미노산 서열중의 하나 이상의 아미노산 잔기가 결실, 삽입, 비보전적 또는 보전적 치환 또는 이들의 조합에 의하여 상이한 서열을 가지는 것을 의미한다. 예를 들면, IgG Fc의 경우 결합에 중요하다고 알려진 214 내지 238, 297 내지 299, 318 내지 322 또는 327 내지 331번 아미노산 잔기들이 변형을 위해 적당한 부위로서 이용될 수 있다. 또한, 이황화 결합을 형성할 수 있는 부위가 제거되거나, 천연형 Fc에서 N-말단의 몇몇 아미노산이 제거되거나 또는 천연형 Fc의 N-말단에 메티오닌 잔기가 부가될 수도 있는 등 다양한 종류의 유도체가 가능하다. 또한, 이펙터 기능을 없애기 위해 보체결합부위, 예로 C1q 결합부위가 제거될 수도 있고, ADCC(antibody dependent cell mediated cytotoxicity) 부위가 제거될 수도 있다. 이러한 면역글로불린 Fc 영역의 서열 유도체를 제조하는 기술은 국제특허공개 제WO97/34631호, 국제특허공개 제WO96/32478호 등에 개시되어 있다. 분자의 활성을 전체적으로 변경시키지 않는 단백질 및 펩타이드에서의 아미노산 교환은 당해 분야에 공지되어 있다(H.Neurath, R.L.Hill, The Proteins, Academic Press, New York, 1979). 가장 통상적으로 일어나는 교환은 아미노산 잔기 Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Thy/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu, Asp/Gly 간의 교환이다. 경우에 따라서는 인산화(phosphorylation), 황화(sulfation), 아크릴화(acrylation), 당화(glycosylation), 메틸화(methylation), 파네실화(farnesylation), 아세틸화(acetylation) 및 아미드화(amidation) 등으로 수식(modification)될 수도 있다. 상기 기술한 면역글로불린 불변 영역 유도체는 본 발명의 면역글로불린 불변 영역 영역과 동등한 생물학적 활성을 나타내며 면역글로불린 불변 영역의 열, pH 등에 대한 구조적 안정성을 증대시킨 것일 수 있다. 또한, 이러한 면역글로불린 불변 영역은 인간, 소, 염소, 돼지, 마우스, 래빗, 햄스터, 랫트 또는 기니아 픽 등의 동물의 생체 내에서 분리한 천연형으로부터 얻어질 수도 있고, 형질전환된 동물세포 또는 미생물로부터 얻어진 재조합형 또는 이의 유도체일 수 있다. 여기서, 천연형으로부터 획득하는 방법은 전체 면역글로불린을 인간 또는 동물의 생체로부터 분리한 후, 단백질 분해효소를 처리하여 획득하는 방법일 수 있다. 파파인을 처리할 경우에는 Fab 및 Fc로 절단되고, 펩신을 처리할 경우에는 pF'c 및 F(ab)2로 절단된다. 이를 크기 배제 크로마토그래피 (size-exclusion chromatography) 등을 이용하여 Fc 또는 pF'c를 분리할 수 있다. 더 구체적인 실시 형태에서는 인간 유래의 Fc 영역을 미생물로부터 수득한 재조합형 면역글로불린 Fc 영역이다. 또한, 면역글로불린 불변 영역은 천연형 당쇄, 천연형에 비해 증가된 당쇄, 천연형에 비해 감소한 당쇄 또는 당쇄가 제거된 형태일 수 있다. 이러한 면역글로불린 Fc 당쇄의 증감 또는 제거에는 화학적 방법, 효소학적 방법 및 미생물을 이용한 유전 공학적 방법과 같은 통상적인 방법이 이용될 수 있다. 여기서, Fc에서 당쇄가 제거된 면역글로불린 Fc 영역은 보체(c1q)와의 결합력이 현저히 저하되고, 항체-의존성 세포독성 또는 보체-의존성 세포 독성이 감소 또는 제거되므로, 생체 내에서 불필요한 면역 반응을 유발하지 않는다. 이런 점에서 약물의 캐리어로서의 본래의 목적에 보다 부합하는 형태는 당쇄가 제거되거나 비당쇄화된 면역글로불린 불변 영역이라 할 것이다. 본 발명에서 "당쇄의 제거(Deglycosylation)"는 효소로 당을 제거한 Fc 영역을 말하며, 비당쇄화(Aglycosylation)는 원핵동물, 더 구체적인 실시 형태에서는 대장균에서 생산하여 당쇄화되지 않은 면역글로불린 불변 영역을 의미한다. 한편, 면역글로불린 Fc 영역은 인간 또는 소, 염소, 돼지, 마우스, 래빗, 햄스터, 랫트, 기니아 픽 등의 동물기원일 수 있으며, 바람직하게는 인간기원이다. 또한, 면역글로불린 Fc 영역은 IgG, IgA, IgD, IgE, IgM 유래 또는 이들의 조합 (combination) 또는 이들의 혼성(hybrid)에 의한 Fc 영역일 수 있다. 그 예로 인간 혈액에 가장 풍부한 IgG 또는 IgM 유래일 수 있으며, 리간드 결합 단백질의 반감기를 향상시키는 것으로 공지된 IgG 유래일 수 있다. 한편, 본 발명에서 조합(combination)이란 이량체 또는 다량체를 형성할 때, 동일 기원 단쇄 면역글로불린 Fc 영역을 암호화하는 폴리펩타이드가 상이한 기원의 단쇄 폴리펩타이드와 결합을 형성하는 것을 의미한다. 즉, IgG Fc, IgA Fc, IgM Fc, IgD Fc 및 IgE의 Fc 단편으로 이루어진 그룹으로부터 선택된 2개 이상의 단편으로부터 이량체 또는 다량체의 제조가 가능하다. 본 발명에서 "하이브리드(hybrid)"란 단쇄의 면역글로불린 Fc 영역 내에 2개 이상의 상이한 기원의 면역글로불린 Fc 단편에 해당하는 서열이 존재함을 의미하는 용어이다. 본 발명의 경우 여러 형태의 하이브리드가 가능하다. 즉, IgG Fc, IgM Fc, IgA Fc, IgE Fc 및 IgD Fc의 CH1, CH2, CH3 및 CH4로 이루어진 그룹으로부터 1개 내지 4개 도메인으로 이루어진 도메인의 하이브리드가 가능하며, 힌지를 포함할 수 있다. 한편, IgG 역시 IgG1, IgG2, IgG3 및 IgG4의 서브클래스로 나눌 수 있고 본 발명에서는 이들의 조합 또는 이들의 혼성화도 가능하다. 그 예로, IgG2 및 IgG4 서브클래스이며, 구체적인 예로, 보체 의존적 독성(CDC, Complementdependent cytotoxicity)과 같은 이펙터 기능(effector function)이 거의 없는 IgG4의 Fc 영역일 수 있으나, 이에 제한되지 않는다. 또한, 실시 형태의 한 예로 상기 면역글로불린 Fc 영역은 IgG1 Fc 영역 또는 IgG4 Fc 영역이나, 이에 제한되는 것은 아니다. 본 발명에서 상기 화학식 1의 "L1 및/또는L2"는 상기 뇌 표적 지속형 결합체의 모이어티 (moiety)를 이루는 일 구성요소로, 면역글로불린 Fc 영역에 뇌 표적 펩타이드 또는 생리활성 물질을 결합시키는 링커를 의미한다. 상기 링커(linker)란 기본적으로는 두 개의 융합 파트너를 공유결합 등을 이용하여 연결할 수 있는 연결체를 의미한다. 링커는 융합 파트너를 연결하는 역할 외에도 융합 파트너 사이에 일정한 크기의 간격을 부여하는 역할을 수행하거나, 유연성 또는 강직정을 제공하는 역할을 수행할 수 있다. 그러나, 특별히 이에 제한되는 것은 아니다. 하나의 구체예로서, 상기 화학식 1의 L1 및 L2 중 하나는 펩타이드성 링커이고, 또 다른 하나는 비펩타이드성 링커인 것을 특징으로 할 수 있다. 또는, 상기 L1 및 L2 중 하나는 펩타이드성 링커이고, 또 다른 하나는 비펩타이드성 링커일 수 있고, 상기 L1 및 L2 모두가 펩타이드성 링커일 수 있으며, 다른 한편으로는 상기 L1 및 L2 중 모두가 비펩타이드성 링커일 수 있으나, 특별히 이에 제한되지 않는다. 또 하나의 구체예로서, 상기 화학식 1의 상기 L1 및 L2 중 어느 하나 또는 둘 다 비펩타이드성 링커일 때, 비펩타이드성 링커는 폴리에틸렌글리콜, 폴리프로필렌 글리콜, 에틸렌 글리콜-프로필렌 글리콜 공중합체, 폴리옥시에틸화폴리올, 폴리비닐알콜, 다당류, 덱스트란, 폴리비닐에틸에테르, 생분해성 고분자, 지질 중합체, 키틴류, 히알루론산, 지방산, 고분자 중합체, 저분자 화합물, 뉴클레오타이드 및 이들의 조합으로 이루어진 군으로부터 선택된 것일 수 있다. 그러나, 이에 제한되지 않는다. 또 하나의 구체예로서, 상기 L1은 비펩타이드성 링커이고, L2는 펩타이드성 링커일 때, 펩타이드성 링커는 0부터 1000개의 아미노산을 포함하는 것일 수 있다. 또 하나의 구체예로서, 상기 L1은 비펩타이드성 링커이고, L2는 펩타이드성 링커로 0개의 아미노산을 포함하는 것일 경우 F와 뇌 표적 펩타이드인 Y는 직접 융합에 의해 형성될 수 있다. 또 하나의 구체예로서, 상기 화학식 1의 상기 L1 및 L2 중 어느 하나 또는 둘 다 펩타이드성 링커일 때, 상기 X와 F, 또는 F와 Y는 공유 화학결합, 비공유 화학결합 또는 이들의 조합으로 L1 및 L2에 의해 서로 결합되고, L1 및 L2가 0부터 1000개의 아미노산을 포함하는 것을 특징으로 한다. 펩타이드성 링커가 0개의 아미노산 일 경우는 공유 화학결합인 펩타이드 결합에 의해 결합된 것일 수 있다. 또 하나의 구체예로서, 상기 화학식 1의 L1 및 L2 중 어느 하나 또는 둘 다 펩타이드성 링커일 때, L1 및 L2는 0개의 아미노산으로 이루어진 것으로, (i) X와 F, 또는 F와 Y는 펩타이드 결합에 의해 결합된 것이고; 또는 (ii) X와 F, 및 F와 Y는 펩타이드 결합에 의해 결합된 것일 수 있다. 본 발명에서 "펩타이드성 링커"는 두 개의 융합 파트너를 연결하는 펩타이드 결합 또는 아미노산의 중합체를 포함한다. 구체적으로, 상기 펩타이드성 링커는 0개 내지 1000개의 아미노산 서열을 포함할 수 있으며, 보다 구체적으로 0개 내지 900개, 0개 내지 800개, 0개 내지 700개, 0개 내지 600개, 0개 내지 500개, 0개 내지 400개, 0개 내지 300개, 0개 내지 250개, 0개 내지 200개, 0개 내지 150개, 0개 내지 100개, 0개 내지 90개, 0개 내지 80개, 0개 내지 70개, 0개 내지 60개, 0개 내지 50개, 0개 내지 40개, 0개 내지 30개, 0개 내지 25개, 0개 내지 20개, 0개 내지 15개, 또는 0개 내지 10개의 아미노산 서열을 포함할 수 있으나, 특별히 이에 제한되지 않는다. 또한, 상기 펩타이드성 링커의 예로는, GGGGS (서열번호: 59) 모티프, GS 모티프, GGGS (서열번호: 60) 모티프, 또는 GGSG (서열번호: 61) 모티프가 반복되는 형태의 아미노산 서열로 구성되는 펩타이드를 들 수 있으며, 상기 모티프가 1 내지 10번 반복될 수 있으나, 특별히 이에 제한되는 것은 아니다. 또한, 상기 L2가 펩타이드성 링커인 경우, L2는 (GS)m, (GGS)m, (GGGS)m, 또는 (GGGGS)m이며, m은 1 내지 10일 수 있으나, 이에 제한되지 않는다. 또 하나의 구체예로서, 상기 화학식 1의 L1 및 L2 중 어느 하나는 펩타이드성 링커이고, 이 중 다른 하나는 비펩타이드성 링커일 때, 펩타이드성 링커는 0부터 1000개의 아미노산을 포함하는 링커이며, 비펩타이드성 링커는 폴리에틸렌 글리콜인 것을 특징으로 할 수 있다. 그러나, 이에 제한되지 않는다. 본 발명에서 상기 "비펩타이드성 링커"는 반복 단위가 2개 이상 결합된 생체적합성 링커를 의미하며, 상기 반복 단위들은 펩타이드 결합이 아닌 임의의 공유결합을 통해 서로 연결된다. 또 하나의 구체예로서, 상기 비펩타이드성 링커 및 X 및 Y는 각각의 반응기에 의해 연결되고, 이때 비펩타이드성 링커의 반응기가 알데히드 그룹, 말레이미드(maleimide) 그룹 및 석시니미드 유도체(succinimide derivative)로 이루어진 군이 선택되는 것일 수 있다. 상기 L1은 양 말단 작용기를 가지는 비펩타이드성 중합체이고, 상기 양 말단 작용기는 각각 아민 반응기 (amine-reactive group) 또는 티올 반응기 (thiol-reactive group)이고, 상기 양 말단 작용기는 서로 같은 종류이거나, 다른 종류일 수 있으나, 이에 제한되지 않는다. 본 발명에 사용 가능한 비펩타이드성 링커인 비펩타이드성 중합체는 폴리에틸렌 글리콜, 폴리프로필렌 글리콜, 에틸렌 글리콜과 프로필렌 글리콜의 공중합체, 폴리옥시 에틸화 폴리올, 폴리비닐 알콜, 다당류, 덱스트란, 폴리비닐 에틸 에테르, PLA(폴리락트산, polylactic acid) 및 PLGA(폴리락틱-글리콜산, polylactic-glycolic acid)와 같은 생분해성 고분자, 지질 중합체, 키틴류, 히알루론산, 올리고뉴클에오타이드 및 이들의 조합으로 구성된 군으로부터 선택될 수 있으며, 그 예로 폴리에틸렌글리콜일 수 있으나, 이에 제한되지 않는다. 당해 분야에 이미 알려진 이들의 유도체 및 당해 분야의 기술 수준에서 용이하게 제조할 수 있는 유도체들도 본 발명의 범위에 포함된다. 본 발명에서 사용될 수 있는 비펩타이드성 링커는 생체 내 단백질 분해 효소에 저항성 있는 중합체이면 제한 없이 사용될 수 있다. 비펩타이드성 중합체의 분자량은 0 초과 약 100 kDa 범위, 그 예로 약 0.5 내지 약 100 kDa, 약 1 내지 약 100 kDa 범위, 또는 약 1 내지 약 20 kDa 범위이나, 이에 제한되지 않는다. 본 발명에서 용어, "약"은 ±0.5, ±0.4, ±0.3, ±0.2, ±0.1 등을 모두 포함하는 범위로, 약 이란 용어 뒤에 나오는 수치와 동등하거나 유사한 범위의 수치를 모두 포함하나, 이에 제한되지 않는다. 또한, 상기 비펩타이드성 링커는 한 종류의 중합체뿐만 아니라 상이한 종류의 중합체들의 조합이 사용될 수도 있다. 한편, 본 발명에 사용되는 비펩타이드성 링커인 비펩타이드성 중합체는 면역글로불린 Fc 영역 및 생리 활성 물질이 공유결합을 형성할 수 있도록, 결합체를 형성하기 전, 비펩타이드성 링커는 F 및 X 또는 Y의 작용기와 결합될 수 있는 작용기를 보유할 수 있다. 구체적으로, 상기 비펩타이드성 링커는 적어도 2개의 말단 작용기를 가질 수 있으며, 구체적으로는 2개 또는 3개의 말단 작용기를 가질 수 있고, 보다 더 구체적으로는 2개의 말단 작용기를 가질 수 있다. 상기 작용기는 알데히드기, 말레이미드기 및 석시니미드 유도체로 구성된 군으로부터 선택될 수 있으나, 이에 제한되지 않는다. 상기에서, 알데히드기로 프로피온 알데히드기 또는 부틸 알데히드기를 예로서 들 수 있으나, 이에 제한되지 않는다. 상기에서, 석시니미드 유도체로는 석시니미딜 발레르에이트, 석시니미딜 메틸부타노에이트, 석시니미딜 메틸프로피온에이트, 석시니미딜 부타노에이트, 석시니미딜 프로피오네이트, N-하이드록시석시니미드, 히드록시 석시니미딜, 석시니미딜 카르복시메틸 또는 석시니미딜 카보네이트가 이용될 수 있으나, 이에 제한되지 않는다. 상기 비펩타이드성 링커의 양 말단 작용기는 서로 같거나 다를 수 있다. 예를 들어, 한쪽 말단에는 말레이미드기를, 다른 쪽 말단에는 알데히드기, 예컨대, 프로피온 알데히드기, 또는 부틸 알데히드기를 가질 수 있다. 양쪽 말단에 히드록시 작용기를 갖는 폴리에틸렌 글리콜을 비펩타이드성 중합체로 이용하는 경우에는 공지의 화학반응에 의해 상기 히드록시기를 상기 다양한 반응기로 활성화하거나, 상업적으로 입수 가능한 변형된 반응기를 갖는 폴리에틸렌 글리콜을 이용하여 본 발명의 결합체를 제조할 수 있다. 또한, 상기 비펩타이드성 링커의 양 말단 또는 세 말단이 모두 알데히드기인 동종 기능성 비펩타이드성 중합체일 수 있다. 예컨대, 상기 비펩타이드성 링커는 양 말단에 프로피온 알데하이드기를 가지는 비펩타이드성 중합체, 구체적으로 양 말단에 프로피온 알데하이드기를 가지는 PEG일 수 있으나, 특별히 이에 제한되지 않는다. 상기 비펩타이드성 링커가 양 말단에 반응 알데히드기의 작용기를 갖는 경우, 비특이적 반응을 최소화하고, 비펩타이드성 중합체의 양 말단에서 생리 활성 폴리펩타이드 및 면역글로불린과 각각 결합하는데 효과적이다. 알데히드 결합에 의한 환원성 아민화로 생성된 최종 산물은 아미드 결합으로 연결된 것보다 훨씬 안정적이다. 알데히드 작용기는 낮은 pH에서 N-말단에 선택적으로 반응하며, 높은 pH, 예를 들어 pH9.0 조건에서는 라이신 잔기와 공유결합을 형성할 수 있다. 본 발명의 지속형 뇌표적 결합체는 면역글로불린 Fc 영역과 융합된 뇌 표적 펩타이드 결합체가 코딩된 후 화학결합하고, 화학결합된 면역글로불린 Fc 영역에 다른 생리활성 물질이 결합되어 서로 다른 생리활성 물질이 포함된 지속성 결합체일 수 있다. 상기 화학결합된 면역글로불린 Fc 영역 결합체는 2개의 면역글로불린 Fc 영역 (단량체 Fc 영역이 결합한 이량체 형태의 Fc 영역)을 가지며 각각에 결합하는 생리활성 물질은 1군데의 면역글로불린 영역 (단량체 Fc 영역)에만 결합되거나 2군데의 면역글로불린 영역 모두(이량체 형태의 Fc 영역 각각)에 결합될 수 있다. 상기 화학 결합은 공유결합일 수 있고, 보다 구체적으로 이황화 결합일 수 있고, 더욱 더 구체적으로는 두 면역글로불린 Fc 영역의 힌지 영역에서 형성되는 이황화 결합일 수 있으나, 특별히 이에 제한되는 것은 아니다. 보다 구체적으로, (i) 상기한 펩타이드성 링커 (예, 펩타이드 결합)를 통하여 뇌 표적 펩타이드가 한 분자의 면역글로불린 Fc 영역의 C-말단 부위에 연결된, 제1 면역글로불린 Fc 영역, 및 (ii) 상기한 펩타이드성 링커 (예, 펩타이드 결합)를 통하여 뇌 표적 펩타이드가 한 분자의 면역글로불린 Fc 영역의 C-말단 부위에 연결된, 제2 면역글로불린 Fc 영역이 화학결합을 통하여 이량체를 형성하고, 이러한 이량체 형태의 면역글로불린 Fc 영역 두 분자 중 한 분자의 N-말단 영역에 한 분자의 생리활성 물질이 연결되거나, 또는 두 분자 모두의 N-말단 영역 각각에 생리활성 물질이 하나씩 연결된 형태일 수 있으나, 특별히 이에 제한되지는 않는다. 상기한 제1 면역글로불린 Fc 영역 및 제2 면역글로불린 Fc 영역은 융합 단백질 형태로서, 면역글로불린 Fc 영역이 뇌 표적 펩타이드와 펩타이드 결합을 통하여 in-frame 융합된 것일 수 있으며, 상기 면역글로불린 Fc 영역은 힌지 영역, CH2 도메인, 및 CH3 도메인을 포함할 수 있으나, 특별히 이에 제한되지는 않는다. 상기 제1 면역글로불린 Fc 영역 및 제2 면역글로불린 Fc 영역 간의 화학 결합은 구체적으로 공유결합일 수 있으며, 보다 구체적으로 이황화 결합일 수 있고, 더욱 더 구체적으로는 두 면역글로불린 Fc 영역의 힌지 영역에서 형성되는 이황화 결합일 수 있으나, 특별히 이에 제한되는 것은 아니다. 본 발명은 또 하나의 양태로서, 상기 화학식 1의 뇌 표적 지속형 결합체를 제조하는 방법을 제공한다. 하나의 구체예로서, 상기 제조 방법은 (i) (a) 생리 활성 물질인 X, 펩타이드성 또는 비펩타이드성 링커인 L1,및 면역글로불린 Fc 영역을 포함하는 F가 결합된, X-L1-F, 및 (b) 뇌 표적 펩타이드인 Y, 펩타이드성 또는 비펩타이드성 링커인 L2가 결합된 L2-Y를 제조하는 단계; 및 (ii) 상기 (a) X-L1-F 및 (b) L2-Y를 연결하는 단계를 포함하는, 상기 화학식 1의 뇌 표적 지속형 결합체를 제조하는 방법인 것을 특징으로 할 수 있다. 이 때, 또 하나의 구체예로서, 상기 (a)의 L1은 펩타이드성 링커이고, (b)의 L2는 비펩타이드성 링커인 것을 특징으로 할 수 있다. 또 하나의 구체예로서, 상기 제조 방법은 (i) (a) 생리 활성 물질인 X, 및 펩타이드성 또는 비펩타이드성 링커인 L1이 결합된, X-L1 및 (b) 뇌 표적 펩타이드인 Y, 펩타이드성 또는 비펩타이드성 링커인 L2,및 면역글로불린 Fc 영역을 포함하는 F가 결합된 F-L2-Y를 제조하는 단계; 및 (ii) 상기 (a) X-L1 및 (b) F-L2-Y를 연결하는 단계를 포함하는, 상기 화학식 1의 뇌 표적 지속형 결합체를 제조하는 방법인 것을 특징으로 한다. 이 때, 또 하나의 구체예로서, 상기 (a)의 L1은 비펩타이드성 링커이고, (b)의 L2는 펩타이드성 링커인 것을 특징으로 할 수 있다. 또 하나의 구체예로서, 상기 제조 방법은 (i) 뇌 표적 펩타이드인 Y, 펩타이드성 또는 비펩타이드성 링커인 L2, 및 면역글로불린 Fc 영역을 포함하는 F가 결합된 F-L2-Y를 제조하는 단계; 및 (ii) 상기 F-L2-Y와 X를 펩타이드성 또는 비펩타이드성 링커인 L1으로 연결하는 단계를 포함하는, 상기 화학식 1의 뇌 표적 지속형 결합체를 제조하는 방법인 것을 특징으로 한다. 이 때, 또 하나의 구체예로서, 상기 L1은 비펩타이드성 링커이고, L2는 펩타이드성 링커인 것을 특징으로 할 수 있다. 상기 L2는 0개의 아미노산일 수 있으며, 이 경우 F-Y 형태로 직접 융합 형태일 수 있다. 또 하나의 구체예로서, 상기 비펩타이드성 링커 및 X 및 Y는 각각의 작용기에 의해 연결되고, 이때 비펩타이드성 링커의 작용기가 알데히드 기, 말레이미드(maleimide) 기 및 석시니미드 유도체(succinimide derivative)로 이루어진 군에서 선택된 것일 수 있다. 본 발명의 상기 뇌 표적 펩타이드 및 생리활성 물질을 포함하는 지속형 결합체는 뇌혈관 장벽의 통과가 가능하고 생리활성이 유지되고 지속성과 안정성이 향상된 지속성 결합체를 제공한다. 본 발명을 구현하는 다른 하나의 양태는 상기 뇌 표적 펩타이드, 상기 뇌표적 펩타이드를 코딩하는 분리된 폴리뉴클레오티드, 상기 폴리뉴클레오티드를 포함하는 발현 벡터, 및 상기 발현 벡터를 포함하는 형질전환체를 제공한다. 한편, 상기 뇌 표적 펩타이드는 펩타이드 그 자체, 이의 염 (예컨대, 상기 펩타이드의 약학적으로 허용가능한 염), 또는 이의 용매화물의 형태를 모두 포함한다. 또한, 뇌 표적 펩타이드는 약학적으로 허용되는 임의의 형태일 수 있다. 상기 염의 종류는 특별히 제한되지는 않는다. 다만, 개체, 예컨대 포유류에게 안전하고 효과적인 형태인 것이 바람직하나, 특별히 이에 제한되는 것은 아니다. 상기 용어, "약학적으로 허용되는"은 의약학적 판단의 범위 내에서,과도한 독성,자극, 또는 알레르기 반응 등을 유발하지 않고 원하는 용도에 효과적으로 사용 가능한 물질을 의미한다. 본 발명에서 용어, "약학적으로 허용되는 염" 이란 약학적으로 허용되는 무기산, 유기산, 또는 염기로부터 유도된 염을 포함한다. 적합한 산의 예로는 염산, 브롬산, 황산, 질산, 과염소산, 푸마르산,말레산, 인산, 글리콜산, 락트산, 살리실산,숙신산, 톨루엔-p-설폰산, 타르타르산, 아세트산,시트르산, 메탄설폰산,포름산, 벤조산, 말론산, 나프탈렌-2-설폰산, 벤젠설폰산 등을 들 수 있다. 적합한 염기로부터 유도된 염은 나트륨, 칼륨 등의 알칼리 금속,마그네슘 등의 알칼리 토금속,및 암모늄 등을 포함할 수 있다. 또한, 본 발명에서 사용된 용어 "용매화물"은 본 발명에 따른 펩타이드 또는 이의 염이 용매 분자와 복합체를 형성한 것을 말한다. 상기 뇌표적 펩타이드를 코딩하는 분리된 폴리뉴클레오티드는 해당 서열과 75% 이상, 구체적으로는 85% 이상, 보다 구체적으로는 90% 이상, 더욱 구체적으로는 95% 이상의 서열 동일성을 가지는 폴리뉴클레오티드 서열을 본 발명의 범주에 포함한다. 본 발명에 따른 재조합 벡터는 전형적으로 클로닝을 위한 벡터 또는 발현을 위한 벡터로서 구축될 수 있고, 원핵세포 또는 진핵세포를 숙주세포로 하여 구축될 수 있다. 본 발명에서 용어, "벡터"란 적당한 숙주세포에서 목적 단백질을 발현할 수 있는 재조합 벡터로서, 핵산 삽입물이 발현되도록 작동 가능하게 연결된 필수적인 조절요소를 포함하는 핵산 구조물(construct)을 의미한다. 상기 재조합 벡터를 숙주세포에 형질전환(transformation) 또는 형질감염(transfection) 시킴으로써, 본 발명의 뇌 표적 지속형 결합체를 수득할 수 있다. 본 발명에서 상기 뇌 표적 펩타이드를 코딩하는 폴리뉴클레오티드는 프로모터에 작동 가능하게 연결될 수 있다. 본 발명에 따른 폴리뉴클레오티드를 포함하는 재조합 벡터를 형질전환시키기 위한 방법은 상기 예들에 국한되지 않으며, 당업계에서 통상적으로 사용되는 형질전환 또는 형질감염 방법이 제한 없이 사용될 수 있다. 본 발명에 따른 폴리뉴클레오티드를 포함하는 재조합 벡터를 숙주세포 내로 도입함으로써 본 발명의 형질전환체(transformant)를 획득할 수 있다. 본 발명에 적합한 숙주는 본 발명에 따른 폴리뉴클레오티드를 발현하도록 하는 한 특별히 제한되지 않는다. 본 발명에 사용될 수 있는 숙주의 특정한 예로는 대장균( 이하, 하기 실시예에 의하여 본 발명을 보다 상세하게 설명한다. 단, 하기 실시예는 본 발명을 예시하기 위한 것일 뿐 본 발명의 범위가 이들로 한정되는 것은 아니다. 실시예 1: 면역글로불린 Fc 영역 및 뇌 표적 펩타이드가결합된 융합 단백질의 제조 면역글로불린 불변 영역을 포함하며, FcRn 결합부위를 갖는 생체 적합성 물질, 뇌 표적 펩타이드 및 생리활성물질이, 펩타이드성 링커로 연결된, 뇌 표적 펩타이드 및 생리활성 폴리펩타이드를 포함하는 지속성 결합체를 제조하기 위해, 면역글로불린 Fc 영역 및 뇌 표적 펩타이드가 결합된 융합 단백질을 제조하였다. 이에, 뇌 표적 펩타이드의 예로 5가지 펩타이드를 선택하였다(표 1). 결합된 생리활성 폴리펩타이드의 반감기를 증가시킬 수 있는, 생체 적합성 물질로 힌지 영역이 포함된 IgG4 Fc 영역을 선택하였으며, 상기 힌지 영역이 포함된 IgG4 Fc 영역과 뇌 표적 펩타이드를 유전자 수준에서 융합하여 발현 벡터에 각각 삽입하였다. 상기 힌지 영역이 포함된 IgG4 Fc 영역과 뇌 표적 펩타이드는 펩타이드 링커로 연결하거나, 직접 융합하는 방식에 의해 구체적으로, 하기와 같은 힌지 영역이 포함된 IgG4 Fc 영역과 뇌 표적 펩타이드가 포함된 융합 단백질을 합성하였다(Bioneer에서 합성) (표 2). 하기 표 2-1 내지 2-6의 서열에서 알 수 있듯이, IgG4 Fc 영역의 C-말단에 뇌 표적 펩타이드의 N-말단이 펩타이드 링커로 연결되거나, 직접 융합하는 방식에 의해 제조된 면역글로불린 Fc 영역 및 뇌 표적 펩타이드가 결합된 융합 단백질을 제조하였다. 합성된 면역글로불린 Fc 영역과 융합된 뇌 표적 펩타이드를 코딩하는 유전자는 양쪽 말단에 NdeI과 BamHI를 포함하고 있어 NdeI과 BamHI로 절단한 pET22b 발현 벡터에 삽입하였다. 상기 면역글로불린 Fc 영역과 융합된 뇌 표적 펩타이드를 코딩하는 유전자가 삽입된 발현벡터를 BL21(DE3)균주에 삽입하여 면역글로불린 Fc 영역과 뇌 표적 펩타이드가 연결된 지속형 융합 단백질을 발현시켰다. 실시예 2: 뇌 표적 펩타이드 제조 면역 글로불린 Fc영역에 융합하는 여러가지 뇌 표적 펩타이드를 탐색하기 위해 상기 BTP1 내지 BTP5를 포함하여, 추가적인 뇌 표적 펩타이드를 설계하여 합성하였다 (표 3). 상기 뇌 표적 펩타이드들이 실제로 뇌 표적이 되는지 확인하기 위해 실시예 3: 뇌 표적 펩타이드의 통과세포외배출 분석(Transcytosis assay) 뇌 표적 펩타이드들의 뇌 혈관 장벽 (blood brain barrier, BBB) 통과 정도를 확인하기 위해 통과세포외배출 (transcytosis) 실험을 진행 하였다. 인간 뇌 내피세포 (Human cerebral endothelial cells)인 hCMEC/D3세포를 미소공성의 막 (microporous membrane)위에서 5 X 104 cells/cm2로 10일 동안 배양하였다. BBB 형성이 되었는지 확인하기 위해 FITC-Dextran (70kDa)으로 침투 실험 (penetration test)을 진행하여 밀착연접)(tight junction)이 형성되는 것을 확인한 뒤, 25mM의 FITC-BTP5, FITC-BTP11, FITC-BTP12, FITC-BTP16 그리고 FITC-Exendin4, FITC-P-8 (음성 대조구, P-8)을 hCMEC/D3위에 놓고 2시간, 24시간 후에 FITC의 형광 광도(fluorescence intensity)를 측정하였다(도 1). 그 결과, 모든 BTP들은 Exendin-4와 음성 대조구(P-8)보다 높은 통과를 보였다. 시간이 지남에 따라 BTP5, BTP11, BTP16등의 뇌 표적 펩타이들의 통과가 증가되는 것을 확인 할 수 있었다. 상기와 같은 결과는, 본 발명에서 확인한 뇌 표적 펩타이드들이 효과적으로 BBB를 통과할 수 있음을 시사하는 것이다. 실시예 4: 뇌 표적 펩타이드의 뇌 분포 (brain distribution) 확인 뇌 표적 펩타이드들의 뇌 혈관 장벽 (blood brain barrier) 통과 정도를 확인하기 위해 마우스에서 뇌 분포 실험 (brain distribution test)을 진행 하였다. 마우스의 CCA (common carotid artery)를 통해 2 mg/head로 투여한 뒤 마우스의 뇌를 분리한 후 단편으로 잘라 FITC의 형광 (fluorescence)을 이용하여 현미경으로 뇌 표적 펩타이드의 뇌 혈관 장벽 통과 정도를 확인하였다 (도 2). CCA를 통해 주입된 뇌 표적 펩타이드는 주입 특성상 한쪽의 뇌 영역으로 퍼져야 하는데, 시험 결과 뇌의 한쪽 지역으로 퍼지는 것을 12.5배율의 현미경으로 관찰 할 수가 있었다. 또한, 장기기억에 중요한 역할을 하는 해마체 (hippocampus)의 세포바디가 분포하는 지역에 FITC의 형광이 관찰되는 것을 200배율의 현미경으로 확인 할 수 있었다. 이를 통해 뇌 표적 펩타이드가 뇌 혈관 장벽을 통과하여 뇌 조직으로 들어가는 것을 확인하였다. 이와 같은 결과들은 본 발명의 뇌 표적 펩타이드들이 in vitro 뿐 만 아니라, 실제 생체 내에서도 뇌로의 표적화가 가능함을 시사하는 것으로, 뇌 표적 펩타이드들에 결합된 생리 활성 물질 역시 BBB를 통과하여 효과적으로 뇌로의 전달이 가능함을 시사하는 것이다. 더욱이, 지속형 결합체 형태인 본 발명의 결합체는 생체 내 지속성이 증가하며 이와 같은 지속성이 증가할수록 뇌로의 표적화가 더욱더 효율적으로 수행될 수 있음을 시사하는 것이다. 실시예 5: 면역글로불린 Fc영역과 뇌 표적 펩타이드를 포함하는 융합단백질의 발현벡터 제조 추가적인 융합단백질을 발현하기위해 발현벡터를 제조하였다. 결합된 생리활성 폴리펩타이드의 반감기를 증가시킬 수 있는, 생체 적합성 물질로 힌지 영역이 포함된 IgG4 Fc 영역을 선택하였으며, 상기 힌지 영역이 포함된 IgG4 Fc 영역과 뇌 표적 펩타이드를 유전자 수준에서 융합하여 발현 벡터에 각각 삽입하였다. 상기 힌지 영역이 포함된 IgG4 Fc 영역과 뇌 표적 펩타이드는 펩타이드 링커로 연결하거나, 직접 융합하는 방식에 의해 구체적으로, 하기 표 4와 같은 서열을 지니는, 힌지 영역이 포함된 IgG4 Fc 영역과 이 Fc CH3 영역의 C-말단 방향에 뇌 표적 펩타이드가 펩타이드 결합으로 연결된 융합 단백질들을 합성하였다(한국 바이오니어사에서 합성)(표 4). 하기 표 4-1 내지 표 4-7의 서열에서 알 수 있듯이, IgG4 Fc 영역의 C-말단에 뇌 표적 펩타이드의 N-말단이 펩타이드 링커로 연결되거나, 직접 융합하는 방식에 의해 제조된 면역글로불린 Fc 영역 및 뇌 표적 펩타이드가 결합된 융합 단백질을 제조하였다. 합성된 면역글로불린 Fc 영역과 융합된 뇌 표적 펩타이드를 코딩하는 유전자는 양쪽 말단에 NdeI과 BamHI를 포함하고 있어 NdeI과 BamHI로 절단한 pET22b 발현 벡터에 삽입하였다. 상기 면역글로불린 Fc 영역과 융합된 뇌 표적 펩타이드를 코딩하는 유전자가 삽입된 발현벡터를 BL21(DE3)균주에 삽입하여 면역글로불린 Fc 영역과 융합된 뇌 표적 펩타이드 지속형 융합 단백질을 발현시켰다. 실시예 6: 면역글로불린 Fc영역과 두 개 이상의 뇌 표적 펩타이드가 연결되어 있는 융합단백질의 발현벡터 제조 수용체 결합력을 증가시키기 위한 추가적인 융합단백질을 발현하기 위해 발현벡터를 제조하였다. 결합된 생리활성 폴리펩타이드의 반감기를 증가시킬 수 있는, 생체 적합성 물질로 힌지 영역이 포함된 IgG4 Fc 영역을 선택하였으며, 상기 구축된 발현벡터에 링커와 뇌표적펩타이드를 유전자 수준에서 부위 특이적 변이 (site-directed mutagenesis) PCR 기법을 이용하여 삽입하였다. 구체적으로는, 서열번호 프라이머(표 5)를 이용하여 면역글로불린 Fc영역의 C-말단과 뇌 표적 펩타이드의 N-말단 사이 또는 뇌표적 펩타이드의 C-말단과 벡터의 BamH I 이 포함된 부위 사이에 링커와 뇌 표적 펩타이드를 삽입하였다. 상기의 PCR기법으로 두개 이상으로 복제된 뇌 표적 펩타이드를 포함하는 융합 단백질 (표 6)을 발현하는 발현벡터를 구축하였다. 이 융합 단백질들은 표 6에 나타낸 서열을 지니는데, 예를 들어 Fc-BTP22 결합체는 상기 표 2의 BTP5 펩타이드 두 단위가 링커를 개재하여 Fc 절편의 CH3 영역의 C-말단 방향에 펩타이드 결합하고 있다. 구체적으로 하기 표 6에서 확인할 수 있듯이, 면역글로불린 Fc 영역의 C-말단과 뇌 표적 펩타이드의 N-말단이 펩타이드 링커로 연결되거나, 직접 융합하는 방식에 의해 제조되었다. 이 경우 뇌 표적 펩타이드는 종렬(tandem)로 연결되는 2개 이상의 뇌 표적 펩타이드는 1 단위의 뇌 표적 펩타이드들이 링커로 연결되는 형태이다. 실시예 7: 면역글로불린 Fc영역 및 뇌 표적 펩타이드가 융합된 융합 단백질의 발현 pET22b 벡터 (노바젠사)의 T7 프로모터 조절하의 면역글로불린 Fc영역 및 뇌 표적 펩타이드가 융합된 융합 단백질의 발현을 수행 하였다. 각각의 구축된 발현벡터로 E.coli BL21-DE3(E. coli B F-dcm ompT hsdS(rB-mB-) gal λDE3); 노바젠)을 형질전환하였다. 형질 전환 방법은 노바젠사에서 추천하는 방법을 따랐다. 각 재조합 발현 벡터가 형질 전환된 각각의 단일 콜로니를 취하여 암피실린(50㎍/ml)이 포함된 2X 루리아 브로스(Luria Broth, LB) 배지에 접종하고, 37℃에서 15시간 배양하였다. 재조합 균주 배양액과 30% 글리세롤이 포함된 2X LB 배지를 1:1(v/v)의 비율로 혼합하여 각 1ml씩 크라이오-튜브에 분주하고, -140℃에 보관하였다. 이를 재조합 융합 단백질의 생산을 위한 세포 스톡(cell stock)으로 사용하였다. 면역글로불린 Fc 영역 및 뇌 표적 펩타이드가 융합된 결합체의 발현을 위하여, 각 세포 스톡(stock) 1 바이알(vial)을 녹여 500 ml의 2X 루리아 브로스(LB)에 접종하고 37℃에서 14~16시간 동안 진탕 배양하였다. OD600의 값이 4.0 이상을 나타내면 배양을 종료하고, 이를 종 배양액으로 사용하였다. 5 L 발효기(Ependorf, 미국)를 이용하여 종 배양액을 1.6 L의 발효 배지에 접종하고 초기 배치(bacth) 발효를 시작하였다. 배양조건은 온도 37℃, 공기량 2 L/분(1 vvm), 교반 속도 650 rpm 그리고 20% 암모니아수를 사용하여 pH 6.70으로 유지시켰다. 발효 진행은 배양액 내의 영양소가 제한되었을 때, 추가배지(feeding solution)를 첨가하여 유가배양을 진행하였다. 균주의 성장은 OD 값에 의해 모니터링하며, OD 값이 120이상에서 최종 농도 0.5mM의 IPTG로 도입하였다. 배양은 도입 후 약 23~25시간까지 더 진행하며, 배양 종료 후, 원심 분리기를 사용하여 재조합 균주를 수획하여 사용 시까지 -80℃에 보관하였다. 실시예 8: 면역글로불린 Fc영역 및 뇌 표적 펩타이드가 융합된 융합 단백질의 회수 및 재접힘 (refolding) 상기 실시예 7에서 발현시킨 면역글로불린 Fc영역 및 뇌 표적 펩타이드가 융합된 융합 단백질들을 가용성 형태로 바꾸기 위해 세포를 파쇄하고 리폴딩하였다. 각 배양액 200 ml에 해당하는 세포 펠렛을 200 ml 용해 완충액(50 mM 트리스(pH 9.0), 1 mM EDTA(pH 8.0), 0.2 M 소디움 클로라이드 및 0.5% 트리톤 X-100)에 재부유하였다. 미세용액화(microfluidizer) 프로세서 M-110EH(AC Technology Corp. Model M1475C)를 이용하여 15,000 psi 압력으로 수행하여 세포를 파쇄하였다. 파쇄된 세포 용해물을 12,200 g으로 4℃에서 30분 원심분리하여 상층액을 버리고, 200 mL 세척완충액(0.5% 트리톤 X-100 및 20 mM 트리스(pH 8.0))에 재부유하였다. 12,200g으로 4℃에서 30분 동안 원심분리하여 펠렛을 200 mL 세척완충액 (20mM 트리스(pH 8.0))에 재부유한 후, 동일한 방법으로 원심분리하였다. 펠렛을 취하여 100 mL의 완충액(8 M Guanidine-HCl, 50mM 트리스(pH 8.0))에 재부유하여 상온에서 2시간 동안 교반하였다. 2시간 후 12,200g으로 23℃에서 30분 동안 원심분리한 후 상층액을 취한 뒤 2.5 mM Dithiothreitol을 첨가한 후 37℃에서 30분동안 교반하였다. 가용화된 면역글로불린 Fc영역 및 뇌 표적 펩타이드가 융합된 융합 단백질의 재접힘(refolding)을 위하여 여기에 3.5 L의 완충액(3 M 우레아, 1 mM 시스테인, 0.160 M 알지닌, 50mM 트리스 (pH 9.2), 20% 글리세롤)를 연동펌프(peristaltic pump)를 이용하여 1 ml/min의 유속으로 넣어주면서 4℃에서 36시간 교반한다. 면역글로불린 Fc 영역 및 뇌 표적 펩타이드가 융합된 융합 단백질 내의 면역글로불린 Fc 영역은 이량체 (dimer)로 발현한다. 실시예 9: 친화성 결합 크로마토그래피 (affinity chromatography) 정제 재접힘이 끝난 시료를 12,200g으로 4℃에서 30분 동안 원심분리한 후 상층액을 취하여 0.22㎛의 필터 (satorius)로 필터링한 후 시료의 pH를 50% HCl을 이용하여 pH7.5로 조정하였다. 10mM 트리스 (pH 7.0)을 완충액으로 평형화된 ProteinA-sepharose (GE healthcare사) 컬럼에 시료를 결합시킨 후, 100 mM 소디움 시트레이트 (pH 3.3)과 10% 글리세롤 완충액을 사용하여 면역글로불린 Fc영역 및 뇌 표적 펩타이드가 융합된 결합체 단백질을 용출하였다. 실시예 10: 소수성 결합 크로마토그래피 정제 용출된 시료에 0.6M 암모늄 설페이트를 삽입한뒤, 10mM 트리스 (pH 7.5)과 0.6M 암모늄 설페이트을 완충액으로 평형화된 Phenyl HP (GE healthcare사) 컬럼에 0.6M 암모늄 설페이트를 삽입한 시료를 결합시킨 후, 10 mM 트리스 (pH 7.5) 완충액을 사용하여 농도가 0% 에서 100% 가 되도록 6 컬럼 용량의 선형 농도구배로 면역글로불린 Fc영역 및 뇌 표적 펩타이드가 융합된 융합 단백질을 용출하였다. 실시예 11: 면역글로불린 Fc 영역과 뇌 표적 펩타이드가 연결되어 있는 융합 단백질의 뇌 분포 (brain distribution) 확인 면역글로불린 Fc영역과 뇌 표적 펩타이드가 연결되어있는 융합단백질들의 뇌 혈관 장벽 (blood brain barrier) 통과 정도를 확인하기 위해 마우스에서 뇌 분포 실험 (brain distribution test)을 진행 하였다. 마우스의 정맥내 주사 (intravenous)를 통해 10 mg/kg로 투여한 뒤 2시간 후 마우스의 뇌를 분리한 후 면역글로불린 Fc영역과 뇌 표적 펩타이드가 연결되어있는 융합단백질들의 농도를 측정하여 뇌 혈관 장벽 통과 정도를 확인하였다 (도 3). 그 결과, 면역글로불린 Fc영역과 뇌 표적 펩타이드들의 뇌 혈관 장벽 통과 정도는 면역글로불린 Fc영역보다 혈청 대비 뇌에서 높은 농도로 측정되어 높은 통과정도를 보였다. 면역글로불린 Fc영역에 동일한 종류의 뇌 표적 펩타이드가 두개이상 연결되어있는 융합단백질의 경우 한 개만 연결되어있을 때보다 뇌에서 높은 농도로 측정되었고, 높은 T/S ratio를 확인 할 수 있었다. 이와 같은 결과들은 본 발명의 면역글로불린 Fc영역과 뇌 표적 펩타이드가 융합된 융합 단백질들이 실제 생체 내에서도 효과적으로 BBB를 통과하여 뇌로의 전달이 가능함을 시사하는 것이다. 더욱이, 지속형 결합체 형태인 본 발명의 융합 단백질은 생체 내 지속성이 증가하며 이와 같은 지속성이 증가할수록 뇌로의 표적화가 더욱더 효율적으로 수행될 수 있음을 시사하는 것이다. 이하에서는, 본 발명의 면역글로불린 Fc 영역과 뇌 표적 펩타이드가 융합된 지속형 융합 단백질에 생리활성 물질들이 연결된 경우에도 효과적으로 BBB를 통과하여 뇌로 전달되고, 뇌에서 생리활성을 나타내는 지 확인하는 실험을 추가로 수행하였다. 실시예 12: 이두설파제 (Idursulfase) 와 PEG 결합체 제조 전형적 크기의 단백질을 생리활성 물질로 포함하는 뇌 표적 지속형 결합체의 예로서, 이두설파제(약 72kDa)를 포함하는 뇌 표적 지속형 결합체를 제조하였다. 이 뇌 표적 지속형 결합체의 전구체로서 먼저 이두설파제에 링커로서 폴리에틸렌글리콜이 연결된 모노페길화 결합체를 다음과 같이 제조하였다. 이두설파제(아일랜드 Shire사)를 적정 농도까지 농축시킨후, 10K butyl-ALD(2) PEG(양 말단의 수소가 각각 부틸 알데하이드기로 개질되어 있는 10 kDa 폴리에틸렌글리콜, 일본 NOF사)를 이두설파제 N-말단에 페길화시키기 위하여, 이두설파제:10K butyl-ALD(2) PEG의 몰 비를 1:10으로, 이두설파제 농도를 10 mg/mL 로 하여 4°C에서 약 2시간 반응시켰다. 이때 0.1 M 인산칼륨(pH 6.0) 완충용액에 20 mM 농도의 NaBH3CN (sodium cyanoborohydirde) 환원제를 첨가하여 반응시켰다. 반응액은 인산나트륨(pH 6.0)과 NaCl 농도 구배를 이용한 Source 15Q(GE,미국) 컬럼을 사용하여 모노페길화 결합체인 이두설파제-10 K PEG를 정제하였다. 실시예 13: 뇌 표적 지속형 결합체인 이두설파제-10 kDa PEG-Fc-BTP22 결합체의 제조 다음으로, 이두설파제-10 kDa PEG 결합체를 뇌 표적 펩타이드를 포함하는 Fc 절편에 연결시켜 뇌 표적 지속형 결합체를 제조하였다. 실시예 12에서 정제한 이두설파제-10 K PEG와 뇌 표적 융합 단백질의 대표예인 Fc-BTP22의 몰비가 1 : 10이 되도록 하고, 이두설파제 농도를 10 mg/mL로 하여 25°C에서 15시간 반응시켰다. 이때 반응액은 둘베코 인산 완충액(DPBS)과 환원제로서 10 mM NaBH3CN를 첨가하였다. 반응이 종결된 후 반응액을 인산나트륨 완충액(pH 6.0)과 NaCl 농도 구배를 이용하여 Source 15Q(GE, 미국) 컬럼에 적용하고, 황산암모늄과 인산나트륨(pH 6.0)의 농도 구배를 이용하여, Source 15ISO(GE, 미국)에 적용하여, 목적하는 뇌 표적 지속형 결합체인 이두설파제-10K PEG-Fc-BTP22를 정제하여 내었다. 이는 이두설파제-Fc-BTP22와 혼용된다. 실시예 14: GIP 유도체와 PEG의결합체 제조 전형적 크기의 펩타이드를 생리 활성 물질로 포함하는 뇌표적 지속형 결합체의 예로서 40개 아미노산 잔기로 이루어진, GIP(glucose-dependent insulinotropic polypeptide) 수용체 자극 활성이 있는 인공 GIP 유도체의 뇌표적 지속형 결합체를 제조하였다. 이 지속형 결합체의 전구체로서 먼저 이 인공 GIP 유도체에 링커로서 폴리에틸렌글리콜이 연결된 모노페길화 결합체를 다음과 같이 제조하였다. 10k MAL-PEG-ALD(한 말단의 수소 원자가 3-[ 실시예 15: GIP 유도체-10K PEG-Fc-BTP22결합체 제조 다음으로, GIP 유도체-10K PEG 결합체를 뇌 표적 펩타이드를 포함하는 Fc 절편에 연결시켜 뇌 표적 지속형 결합체를 제조하였다. 실시예 14에서 정제한 GIP 유도체-10 K PEG 와 Fc-BTP22의 몰비가 1 : 2가 되도록 하고, 전체 반응 농도를 4.55 mg/mL로 하여 4°C에서 16시간 반응시켰다. 이때 반응액은 DPBS와 환원제로서 20 mM NaBH3CN를 첨가하였다. 반응이 종결된 후 반응액은 인산나트륨 완충액(pH 7.5)과 황산암모늄 농도 구배를 이용하여 Source 15ISO(GE, 미국) 컬럼에 적용하고, 동일한 완충액과 동일한 컬럼에 다시 한 번 적용하여, 목적하는 뇌 표적 지속형 결합체인 GIP 유도체-10K PEG-Fc-BTP22를 정제하였다. 이는 GIP 유도체-Fc BTP22와 혼용된다. 실시예 16: 뇌 표적 지속형 결합체의 통과세포외배출 분석 실시예에서 얻은 뇌 표적 지속형 결합체의 뇌 혈관 장벽 통과 정도를 확인하기 위해 통과세포외배출(transcytosis) 실험을 진행 하였다. 인간 뇌 내피세포 (Human cerebral endothelial cells)인 hCMEC/D3세포를 미세공성의 막 (microporous membrane)위에서 5 X 104 cells/cm2로 10일 동안 배양하였다. BBB 형성이 되었는지 확인하기 위해 FITC-덱스트란(70 kDa)으로 침투 실험(penetration test)을 진행하여 밀착연접(tight junction)이 형성되는 것을 확인한 뒤, 25 mM의 뇌 표적 지속형 결합체를 hCMEC/D3위에 놓고 2시간, 4시간 후에 ELISA kit를 이용하여 단백질의 농도를 측정하였다. 그 결과, GIP 유도체-10K PEG-Fc-BTP22는 대조군과 비교하여 뇌 혈관 장벽 통과 효과를 나타내었고, 시간이 지남에 따라 통과율도 높아지는 것을 확인 할 수 있었다(도 4). 이두설파제-10K PEG-Fc-BTP22에 대해서도 유사한 뇌 혈관 장벽 투과성을 볼 수 있었다(미도시). 상기와 같은 결과는, 본 발명에서 확인한 뇌 표적 지속성 결합체가 효과적으로 BBB를 통과할 수 있음을 시사하는 것이다. 실시예 17: 이두설파제-10 kDa PEG-Fc-BTP22 결합체의 활성 측정 이두설파제-10K PEG-Fc-BTP22 결합체 제조에 따른 이두설파제의 효소 활성 (specific activity) 변화가 있는지를 측정하고자 시험관내 효소 활성 실험을 진행하였다. 이두설파제 의 효소 기질로 알려진 4-Methylumbelliferyl α-L-Idopyranosiduronic Acid-2-sulfate Sodium Salt(4MU-α-IdopyraA-2) 를 Idursulfase beta 및 IDS-Fc-BTP22와 37 ℃에서 4시간 반응 후, 이차반응 효소인 α-Iduronidase 와 다시 37 ℃에서 24시간 반응하였다. 최종적으로 생성되는 4-Methylumbelliferone(4MU)에 대한 형광을 측정함으로써 해당물질에 대한 효소 활성을 측정하였다(도 5). 그 결과, 결합체를 형성하지 않은 유리 이두설파제와 이두설파제-10K PEG-Fc-BTP22의 효소 활성이 각각 23.4 ± 1.94, 10.8 ± 1.39 nmol/min/μg로 나타났다. 여기서 효소 활성의 값은 이두설파제의 환산 중량(μg) 당의 특이적 활성으로 계산하였는데, 즉 시간당 효소 반응의 수를 유리 이두설파제의 경우는 중량으로, 이두설파제-10K PEG-Fc-BTP22의 경우는 이 결합체 내에서 이두설파제 부분이 차지하는 환산 중량으로 나눈 값이다. 결론적으로 이두설파제 대비, 이두설파제-10K PEG-Fc-BTP22 의 효소 활성이 46.6 % 로서, 일부가 감소하긴 하였지만 효소를 본 발명의 뇌 표적 지속형 결합체로 제조하였을 때에도 그 결합체에서 유의미한 효소 활성이 나타남을 확인하였다. 상기에서 제조된 지속성 결합체는 Fc 영역에 결합된 뇌 표적 펩타이드에 의해 뇌혈관 장벽의 통과가 가능하고, 결합된 생리활성 물질의 생리활성이 유지되어 지속성과 안정성이 향상된 지속성 결합체를 제공하여, 새로운 BBB 통과가 가능한 치료제의 개발 플랫폼을 제공할 수 있다. 이상의 설명으로부터, 본 발명이 속하는 기술분야의 당업자는 본 발명이 그 기술적 사상이나 필수적 특징을 변경하지 않고서 다른 구체적인 형태로 실시될 수 있다는 것을 이해할 수 있을 것이다. 이와 관련하여, 이상에서 기술한 실시 예들은 모든 면에서 예시적인 것이며 한정적인 것이 아닌 것으로서 이해해야만 한다. 본 발명의 범위는 상기 상세한 설명보다는 후술하는 특허 청구범위의 의미 및 범위 그리고 그 등가 개념으로부터 도출되는 모든 변경 또는 변형된 형태가 본 발명의 범위에 포함되는 것으로 해석되어야 한다. The present invention relates to a brain targeting long-acting conjugate comprising a brain targeting peptide and a physiologically active substance, the long-acting conjugate passing through the blood-brain barrier and comprising a physiologically active substance with enhanced persistence and stability, and a method for producing the same. The brain targeting long-acting conjugate comprising a brain targeting peptide and a physiologically active substance of the present invention can pass through the blood-brain barrier to treat a disorder related to brain diseases, and provided is also a brain targeting long-acting conjugate comprising a brain targeting peptide and a physiologically active substance in which activity of the physiologically active substance is maintained 하기 화학식 1로 표시되는 뇌 표적 지속형 결합체: [화학식 1] X-L1-F-L2-Y 여기에서, X는 생리 활성 물질이며, Y는 뇌 표적 펩타이드이고, L1 및 L2는 펩타이드성 또는 비펩타이드성 링커이고, L1 및 L2가 펩타이드성 링커일 때, 상기 펩타이드성 링커는 0부터 1000개의 아미노산을 포함하며, F는 FcRn 결합 부위를 포함하는 면역글로불린 불변 영역임. 제1항에 있어서, 상기 지속형 결합체는 뇌 혈관 장벽을 통과하여, 뇌 조직 내로 생리 활성 물질이 전달되는 것을 특징으로 하는, 뇌 표적 지속형 결합체. 제1항에 있어서, 상기 뇌 표적 펩타이드는 뇌 혈관 장벽을 통과 가능한 아미노산 서열을 가지는, 펩타이드, 단백질 또는 항체를 포함하는 것인, 뇌 표적 지속형 결합체. 제3항에 있어서, 상기 뇌 표적 펩타이드는 수동전달(passive transport)에 의한 경로 또는 수용체 매개 전달(receptor-mediated transport)에 의한 경로를 통해 뇌 혈관 장벽을 통과하는 것인, 뇌 표적 지속형 결합체. 제1항에 있어서, 상기 생리 활성 물질은 톡신; 또는 GLP-1(Glucagon like peptide-1) 수용체 아고니스트; 글루카곤 수용체 아고니스트; GIP(Gastric inhibitory polypeptide) 수용체 아고니스트; FGF(Fibroblast growth factor) 수용체 아고니스트; 콜레키스토키닌 (Cholecystokinin) 수용체 아고니스트; 가스트린(gastrin) 수용체 아고니스트; 멜라노코르틴(melanocortin) 수용체 아고니스트; 인간 성장호르몬; 성장호르몬 방출 호르몬; 성장호르몬 방출 펩타이드; 인터페론; 인터페론 수용체; 콜로니 자극인자; 인터루킨; 인터루킨 수용체; 효소; 인터루킨 결합 단백질; 사이토카인 결합 단백질; 마크로파지 활성인자; 마크로파지 펩타이드; B 세포인자; T 세포인자; 단백질 A; 알러지 억제인자; 세포 괴사 당단백질; 면역독소; 림포독소; 종양 괴사인자; 종양 억제인자; 전이 성장인자; 알파-1 안티트립신; 알부민; 알파-락트알부민(alpha-lactalbumin); 아포리포 단백질-E; 적혈구 생성 인자; 고 당쇄화 적혈구 생성인자; 안지오포이에틴(angiopoietin); 헤모글로빈; 트롬빈(thrombin); 트롬빈 수용체 활성 펩타이드; 트롬보모듈린(thrombomodulin); 혈액인자 VII; 혈액인자 VIIa; 혈액인자 VIII; 혈액인자 IX; 혈액인자 XIII; 플라즈미노겐 활성인자; 피브린-결합 펩타이드; 유로키나제; 스트렙토키나제; 히루딘(hirudin); 단백질 C; C-반응성 단백질; 레닌 억제제; 콜라게나제 억제제; 수퍼옥사이드 디스뮤타제; 렙틴; 혈소판 유래 성장인자; 상피세포 성장인자; 표피세포 성장인자; 안지오스타틴(angiostatin); 안지오텐신(angiotensin); 골 형성 성장인자; 골 형성 촉진 단백질; 칼시토닌; 인슐린; 아트리오펩틴; 연골 유도인자; 엘카토닌(elcatonin); 결합조직 활성인자; 조직인자 경로 억제제(tissue factor pathway inhibitor); 여포 자극 호르몬; 황체 형성 호르몬; 황체 형성 호르몬 방출 호르몬; 신경 성장인자류; 악소제네시스 인자-1(axogenesis factor-1); 뇌-나트륨 이뇨 펩타이드(brain-natriuretic peptide); 신경교 유래 신경영양인자(glial derived neurotrophic factor); 네트린(netrin); 중성구 억제인자(neurophil inhibitor factor); 신경영양인자; 뉴트린(neuturin); 부갑상선 호르몬; 릴랙신; 시크레틴; 소마토메딘; 인슐린 유사 성장인자; 부신피질 호르몬; 글루카곤; 콜레시스토키닌; 췌장 폴리펩타이드; 가스트린 방출 펩타이드; 코티코트로핀 방출인자; 갑상선 자극호르몬; 오토탁신(autotaxin); 락토페린(lactoferrin); 미오스타틴(myostatin); ADNP(activity-dependent neuroprotective protein), BACE1(beta-secretase1), APP(Amyloid Precursor Protein), NCAM(Neural cell adhesion molecule), 아밀로이드 베타(Amyloid beta), 타우(Tau), RAGE(receptor for advanced glycation endproducts), 알파-시누클레인(alpha-synuclein), 또는 이들의 아고니스트 또는 안타고니스트; 수용체류, 수용체 아고니스트; 세포표면항원; 단일클론 항체; 다중클론 항체; 항체 단편; 바이러스 유래 백신 항원; 하나 이상의 수용체 아고니스트를 활성화 시키는 하이브리드 폴리펩타이드 또는 키메릭 (chimeric) 폴리펩타이드; 및 이들의 아날로그를 포함하는 군으로 이루어진 군에서 선택된 생리활성 물질인, 뇌 표적 지속형 결합체. 제5항에 있어서, 상기 톡신은 메이탄신(Maytansine) 또는 이의 유도체, 오리스타틴 (Auristatin) 또는 이의 유도체, 듀오카마이신(Duocarmycin) 또는 이의 유도체, 및 PBD(Pyrrolobenzodiazepine) 또는 이의 유도체로 이루어진 군에서 선택되고, GLP-1(Glucagon like peptide-1) 수용체 아고니스트는 천연형 엑센딘-3 또는 천연형 엑센딘-4, 및 이들의 아날로그로 이루어진 군에서 선택된 것이며, FGF 수용체 아고니스트는 FGF1 또는 이의 아날로그, FGF19 또는 이의 아날로그, FGF21 또는 이의 아날로그, 및 FGF23 또는 이의 아날로그로 이루어진 군에서 선택되고, 인터페론은 인터페론-알파, 인터페론-베타 및 인터페론-감마로 이루어진 군에서 선택되고, 인터페론 수용체는 인터페론-알파 수용체, 인터페론-베타 수용체, 인터페론-감마 수용체, 및 수용성 타입 I 인터페론 수용체로 이루어진 군에서 선택되고, 인터루킨은 인터루킨-1, 인터루킨-2, 인터루킨-3, 인터루킨-4, 인터루킨-5, 인터루킨-6, 인터루킨-7, 인터루킨-8, 인터루킨-9, 인터루킨-10, 인터루킨-11, 인터루킨-12, 인터루킨-13, 인터루킨-14, 인터루킨-15, 인터루킨-16, 인터루킨-17, 인터루킨-18, 인터루킨-19, 인터루킨-20, 인터루킨-21, 인터루킨-22, 인터루킨-23, 인터루킨-24, 인터루킨-25, 인터루킨-26, 인터루킨-27, 인터루킨-28, 인터루킨-29, 및 인터루킨-30으로 이루어진 군에서 선택되고, 인터루킨 수용체는 인터루킨- 1 수용체 또는 인터루킨-4 수용체이고, 효소는 베타글루코시다제(beta-glucosidase), 알파갈락토시다제(alpha-galactosidase), 베타갈락토시다제(beta-galactosidase), 이두로니다제(iduronidase), 이두로네이트 2-설파타제(iduronate-2-sulfatase), 갈락토스-6-설파타제(Galactose-6-sulfatase), 산성 알파-글루코시다제(acid alpha-glucosidase), 산성 세라미다제(acid ceramidase), 산성 스핑고미엘리나제(acid sphingomyelinsase), 갈락토세레브로시다제(galactocerebrosidsase), 아릴설파타제(arylsulfatase) A, 아릴설파타제 B, 베타-헥소사미니다제 (beta-hexosaminidase) A, 베타-헥소사미니다제 B, 헤파린-N-설파타제(heparin N-sulfatase), 알파-D-마노시다제(alpha-D-mannosidase), 베타-글루쿠로니다제(beta-glucuronidase), N-아세틸갈락토사민-6-설파타제(N-acetylgalactosamine-6 sulfatase), 리소좀 산성 리파제(lysosomal acid lipase), 알파-N-아세틸-글루코사미니다제(alpha-N-acetyl-glucosaminidase), 글루코세레브로시다제(glucocerebrosidase), 부티릴콜린에스터라제(butyrylcholinesterase), 키티나제(Chitinase), 글루타메이트 디카르복실라제(glutamate decarboxylase), 이미글루세라제(imiglucerase), 리파아제(lipase), 우리카제(Uricase), 혈소판활성인자 아세틸하이드로라제(Platelet-Activating Factor Acetylhydrolase), 뉴트럴 엔도펩티다제(neutral endopeptidase), 미엘로퍼옥시다제(myeloperoxidase), 알파-갈락토시다제-A, 아갈시다제 알파(agalsidase alpha), 아갈시다제 베타, 알파-L-이두로니다제(alpha-L-iduronidase), 뷰티릴콜린에스터라제(butyrylcholinesterase), 키티나제(chitinase), 글루타메이트 디카르복실라제(glutamate decarboxylase), 및 이미글루세라제(imiglucerase)로 이루어진 군에서 선택되고, 인터루킨 결합 단백질은 IL-18bp이고, 사이토카인 결합 단백질은 TNF (Tumor necrosis factor) 결합 단백질이고, 신경 성장인자류는 신경 성장인자, 모양체 신경영양인자(cilliary neurotrophic factor), 악소제네시스 인자-1(axogenesis factor-1), 뇌-나트륨 이뇨 펩타이드(brain-natriuretic peptide), 신경교 유래 신경영양인자(glial derived neurotrophic factor), 네트린(netrin), 중성구 억제인자(neurophil inhibitor factor), 신경영양인자, 및 뉴트린(neuturin)으로 이루어진 군에서 선택되고, 미오스타틴 수용체는 TNFR(P75), TNFR(P55), IL-1 수용체, VEGF 수용체, 및 B 세포 활성인자 수용체로 이루어진 군에서 선택되고, 미오스타틴 수용체 안타고니스트는 IL1-Ra이고, 세포표면 항원은 CD2, CD3, CD4, CD5, CD7, CD11a, CD11b, CD18, CD19, CD20, CD23, CD25, CD33, CD38, CD40, CD45 및 CD69로 이루어진 군에서 선택되고, 항체 단편류는 scFv, Fab, Fab', F(ab')2 및 Fd로 이루어진 군에서 선택되는, 뇌 표적 지속형 결합체. 제6항에 있어서, 상기 GLP-1 수용체 아고니스트는 천연형 엑센딘-4, 천연형 엑센딘-4의 N-말단 아민 그룹이 제거된 엑센딘-4, 천연형 엑센딘-4의 N-말단 아민 그룹이 하이드록실 그룹으로 치환된 엑센딘-4, 천연형 엑센딘-4의 N-말단 아민 그룹이 디메틸기로 수식된 엑센딘-4, 천연형 엑센딘-4의 N-말단 아민기가 카르복실기로 치환된 엑센딘-4, 천연형 엑센딘-4의 첫 번째 아미노산(히스티딘)의 알파 탄소가 제거된 엑센딘-4; 및 상기 엑센딘-4의 열두 번째 아미노산(라이신)이 세린으로 치환된 엑센딘-4 및 상기 엑센딘-4의 열두 번째 아미노산(라이신)이 알지닌으로 치환된 엑센딘-4로 이루어진 군에서 선택되는, 뇌 표적 지속형 결합체. 제4항에 있어서, 상기 수용체 매개 전달에 의한 경로는 인슐린 수용체(insulin receptor), 트랜스페린 수용체(transferrin receptor), 저밀도 지질단백질 수용체(low density lipoprotein receptor), 저밀도 지질단백질 수용체 관련 단백질(Low density lipoprotein receptor-related protein), 렙틴 수용체(leptin receptor), 니코틴성 아세틸콜린 수용체(nicotinic acetylcholine receptor), 글루타티온 수송체(Glutathione transporter), 칼슘의존성 칼륨통로(calcium-activated potassium channel), 및 RAGE (receptor for advanced glycation endproducts), 및 상기 수용체들의 리간드 및 상기 수용체 또는 리간드에 결합하는 항체로 이루어진 군으로부터 선택된 어느 하나를 통하여 수용체 매개 전달 경로에 의해 뇌 혈관 장벽을 통과하는, 뇌 표적 지속형 결합체. 제1항에 있어서, 상기 L1은 F의 N-말단 영역에 연결되고, L2는 F의 C-말단 영역에 연결된 것인, 뇌 표적 지속형 결합체. 제1항에 있어서, 상기 화학식 1의 F-L2-Y는 하기 화학식 2로 표시되는 구조인 것인, 뇌 표적 지속형 결합체: [화학식 2] 여기에서, Fa 및 Fb는 각각 힌지 영역, CH2 도메인, 및 CH3 도메인을 포함하는 면역글로불린 Fc 영역을 포함하는 한 가닥의 폴리펩타이드 사슬로서, Fa와 Fb는 힌지 영역에서 이황화 결합으로 서로 연결되고, 이로써 상기 결합체는 Fc 절편을 포함하며, Fa는 L1과 공유결합으로 연결되고, 각각의 BTPa1, ······, BTPan은 서로 같거나 다른 뇌 표적 펩타이드이고, 각각의 BTPb1, ······, BTPbn'은 서로 같거나 다른 뇌 표적 펩타이드이며, 각각의 L2a1, ······, L2an은 서로 같거나 다른 펩타이드성 링커이고, 각각의 L2b1, ······, L2bn'은 서로 같거나 다른 펩타이드성 링커이며, 이 때, n 및 n'은 각각 독립적으로 자연수이다. 제10항에 있어서, 상기 L1은 Fa의 N-말단에 연결된 것이고, L2a1 및 L2b1는 각각 Fa 및 Fb의 C-말단에 연결된 것인, 뇌 표적 지속형 결합체. 제11항에 있어서, n=n'이고, 각각 L2a1 = L2b1, ······, L2an= L2bn'과 BTPa1 = BTPb1, ······, BTPan= BTPbn'의 조건을 만족하는 뇌 표적 지속형 결합체. 제10항에 있어서, 상기 L1은 X의 N-말단 아민기, 라이신의 측쇄에 위치한 아민기, 또는 시스테인의 측쇄에 위치한 -SH 기 (티올기)에 연결된 것인, 뇌 표적 지속형 결합체. 제10항에 있어서, 상기 생리활성 물질인 X는 2개 내지 1000개의 아미노산으로 이루어진 폴리펩타이드인, 뇌 표적 지속형 결합체. 제10항에 있어서, 상기 n 및 n'은 1 내지 5인, 뇌 표적 지속형 결합체. 제10항에 있어서, 상기 L1은 0.5 내지 100 kDa 크기인 비펩타이드성 링커인, 뇌 표적 지속형 결합체. 제16항에 있어서, 상기 비펩타이드성 링커는 폴리에틸렌글리콜인, 뇌 표적 지속형 결합체. 제1항에 있어서, 상기 L2는 펩타이드성 링커이며, (GS)m, (GGS)m, (GGGS)m, 또는 (GGGGS)m이며, m은 1 내지 10인, 뇌 표적 지속형 결합체. 제1항에 있어서, 상기 L1 및 L2 중 하나는 펩타이드성 링커이고, 또 다른 하나는 비펩타이드성 링커인 것인, 뇌 표적 지속형 결합체. 제1항에 있어서, 상기 L1은 비펩타이드성 링커이고, L2는 펩타이드성 링커일 때, 펩타이드성 링커는 0부터 1000개의 아미노산을 포함하는 것인, 뇌 표적 지속형 결합체. 제1항 또는 제10항에 있어서, 상기 L1 및 L2 중 어느 하나 또는 둘 다 비펩타이드성 링커일 때, 비펩타이드성 링커는 폴리에틸렌글리콜, 폴리프로필렌 글리콜, 에틸렌 글리콜-프로필렌 글리콜 공중합체, 폴리옥시에틸화폴리올, 폴리비닐알콜, 다당류, 덱스트란, 폴리비닐에틸에테르, 생분해성 고분자, 지질 중합체, 키틴류, 히알루론산, 지방산, 고분자 중합체, 저분자 화합물, 뉴클레오타이드 및 이들의 조합으로 이루어진 군으로부터 선택된 것인, 뇌 표적 지속형 결합체. 제1항에 있어서, 상기 L1 및 L2 중 어느 하나 또는 둘 다 펩타이드성 링커일 때, 상기 X와 F, 또는 F와 Y는 공유 화학결합, 비공유 화학결합 또는 이들의 조합으로 L1 및 L2 에 의해 서로 결합되고, L1 및 L2 가 0부터 1000개의 아미노산을 포함하는 것인, 뇌 표적 지속형 결합체. 제1항에 있어서, L1 및 L2 중 어느 하나 또는 둘 다 펩타이드성 링커일 때, L1 및 L2 는 0개의 아미노산으로 이루어진 것으로, (i) X와 F, 또는 F와 Y는 펩타이드 결합에 의해 결합된 것이고; 또는 (ii) X와 F, 및 F와 Y는 펩타이드 결합에 의해 결합된 것인, 뇌 표적 지속형 결합체. 제1항에 있어서, L1 및 L2 중 어느 하나는 펩타이드성 링커이고, 이 중 다른 하나는 비펩타이드성 링커일 때, 펩타이드성 링커는 0부터 1000개의 아미노산을 포함하는 링커이며, 비펩타이드성 링커는 폴리에틸렌 글리콜인 것인, 뇌 표적 지속형 결합체. 제1항에 있어서, F는 면역글로불린 Fc 영역을 포함하는 것인, 뇌 표적 지속형 결합체. 제25항에 있어서, 상기 면역글로불린 Fc 영역이 CH1, CH2, CH3 및 CH4 도메인으로 이루어진 군으로부터 선택된 1개 내지 4개의 도메인을 포함하는, 뇌 표적 지속형 결합체. 제25항에 있어서, 상기 면역글로불린 Fc 영역이 힌지 영역을 추가로 포함하는 것인, 뇌 표적 지속형 결합체. 제25항 또는 제10항에 있어서, 상기 면역글로불린 Fc 영역은 IgG의 Fc 영역인 것인, 뇌 표적 지속형 결합체. 제28항에 있어서, 상기 면역글로불린 Fc 영역은 IgG4 Fc 영역인, 뇌 표적 지속형 결합체. 제29항에 있어서, 상기 면역글로불린 Fc 영역이 인간 서열의 비당쇄화 IgG4 Fc 영역인, 뇌 표적 지속형 결합체. 제1항에 있어서, L1에 의해 X의 N-말단 및 F의 N-말단이 연결된 것이고, L2에 의해 Y의 N-말단 및 F의 C-말단이 연결된, 뇌 표적 지속형 결합체. 제1항에 있어서, L1의 일 말단은 X의 라이신 잔기 또는 시스테인 잔기에, L1의 다른 말단은 F의 N-말단에 연결된 것이고, L2에 의해 Y의 N-말단 및 F의 C-말단이 연결된, 뇌 표적 지속형 결합체. 하기 단계를 포함하는, 제1항의 뇌 표적 지속형 결합체를 제조하는 방법: (i) (a) 생리 활성 물질인 X, 펩타이드성 또는 비펩타이드성 링커인 L1,및 면역글로불린 Fc 영역을 포함하는 F가 결합된, X-L1-F, 및 (b) 뇌 표적 펩타이드인 Y, 펩타이드성 또는 비펩타이드성 링커인 L2가 결합된 L2-Y를 제조하는 단계; 및 (ii) 상기 (a) X-L1-F 및 (b) L2-Y를 연결하는 단계. 하기 단계를 포함하는, 제1항의 뇌 표적 지속형 결합체를 제조하는 방법: (i) (a) 생리 활성 물질인 X, 및 펩타이드성 또는 비펩타이드성 링커인 L1이 결합된, X-L1 및 (b) 뇌 표적 펩타이드인 Y, 펩타이드성 또는 비펩타이드성 링커인 L2,및 면역글로불린 Fc 영역을 포함하는 F가 결합된 F-L2-Y를 제조하는 단계; 및 (ii) 상기 (a) X-L1 및 (b) F-L2-Y를 연결하는 단계. 하기 단계를 포함하는, 제1항의 뇌 표적 지속형 결합체를 제조하는 방법: (i) 뇌 표적 펩타이드인 Y, 펩타이드성 또는 비펩타이드성 링커인 L2,및 면역글로불린 Fc 영역을 포함하는 F가 결합된 F-L2-Y를 제조하는 단계; 및 (ii) 상기 F-L2-Y와 X를 펩타이드성 또는 비펩타이드성 링커인 L1으로 연결하는 단계. 제33항 내지 제35항 중 어느 한 항에 있어서, (a)의 L1은 펩타이드성 링커이고, (b)의 L2는 비펩타이드성 링커인 것인, 방법. 제33항 내지 제35항 중 어느 한 항에 있어서, (a)의 L1은 비펩타이드성 링커이고, (b)의 L2는 펩타이드성 링커인 것인, 방법. 제1항에 있어서, 상기 L1은 양 말단 작용기를 가지는 비펩타이드성 중합체이고, 상기 양 말단 작용기는 각각 아민 반응기 (amine-reactive group) 또는 티올 반응기 (thiol-reactive group)이고, 상기 양 말단 작용기는 서로 같은 종류이거나, 다른 종류인, 방법. 제33항 내지 제35항 중 어느 한 항에 있어서, 비펩타이드성 링커 및 X 및 Y는 각각의 작용기에 의해 연결되고, 이때 비펩타이드성 링커의 작용기가 알데히드 기, 말레이미드(maleimide) 기 및 석시니미드 유도체(succinimide derivative)로 이루어진 군에서 선택되는 것인, 방법. 서열번호 2, 4, 6, 8, 10, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38 및 40으로 표시되는 아미노산 서열 중 선택된 어느 하나의 아미노산 서열로 이루어진, 뇌 표적 펩타이드. 제40항의 뇌 표적 펩타이드를 코딩하는 분리된 폴리뉴클레오티드. 제41항에 따른 폴리뉴클레오티드를 포함하는 재조합 발현 벡터. 제42항에 따른 재조합 발현 벡터를 포함하는, 형질전환체.뇌 표적 펩타이드 서열 서열번호 HAIYPRH(BTP1) DNA CATGCAATTTATCCGCGTCATTGA 1 단백질 HAIYPRH 2 THR(BTP2) DNA ACCCATCGTCCGCCGATGTGGAGCCCGGTTTGGCCGTGA 3 단백질 THRPPMWSP VWP 4 Angiopep-2(BTP3) DNA ACCTTTTTTTATGGTGGCAGCCGTGGTAAACGCAATAACTTTAAAACCGAAGAATATTAA 5 단백질 TFFYGGSRG KRNNFKTEEY 6 ApoB(BTP4) DNA AGCGTTATTGATGCACTGCAGTATAAACTGGAAGGTACCACACGTCTGACCCGCAAACGTGGTCTGAAACTGGCCACCGCACTGTCACTGAGCAATAAATTTGTTGAAGGTAGCTAA 7 단백질 SVIDALQYK LEGTTRLTRK RGLKLATALS LSNKFVEGS 8 ApoE(BTP5) DNA CTGCGTAAACTGCGCAAACGTCTGTTACTGCGTAAACTGCGCAAACGTCTGTTATAA 9 단백질 LRKLRKRLL LRKLRKRLL 10 서열 서열번호 BTP1 DNA CATGCAATTTATCCGCGTCAT 1 단백질 HAIYPRH 2 BTP2 DNA ACCCATCGTCCGCCGATGTGGAGCCCGGTTTGGCCG 3 단백질 THRPPMWSPVWP 4 BTP3 DNA ACCTTTTTTTATGGTGGCAGCCGTGGTAAACGCAATAACTTTAAAACCGAAGAATAT 5 단백질 TFFYGGSRGKRNNFKTEEY 6 BTP4 DNA AGCGTTATTGATGCACTGCAGTATAAACTGGAAGGTACCACACGTCTGACCCGCAAACGTGGTCTGAAACTGGCCACCGCACTGTCACTGAGCAATAAATTTGTTGAAGGTAGC 7 단백질 SVIDALQYKLEGTTRLTRKRGLKLATALSLSNKFVEGS 8 BTP5 DNA CTGCGTAAACTGCGCAAACGTCTGTTACTGCGTAAACTGCGCAAACGTCTGTTA 9 단백질 LRKLRKRLLLRKLRKRLL 10 BTP6 DNA taccaacagatcctcaccagtatgccttccagaaacgtgatccaaatatccaacgacctggagaacctccgggatcttcttcacgtgctg 19 단백질 YQQILTSMPSRNVIQISNDLENLRDLLHVL 20 BTP7 DNA tacaccatttggatgcccgagaatccgagacctgggacaccttgtgacatttttaccaatagtagagggaagagagcatccaatggg 21 단백질 YTIWMPENPRPGTPCDIFTNSRGKRASNG 22 BTP8 DNA aagtcagtcagaacttggaatgagatcAtAccttcaaaagggtgtttaagagttggggggaggtgtcatcctcatgtgaacggg 23 단백질 KSVRTWNEIIPSKGCLRVGGRCHPHVNG 24 BTP9 DNA CATCTGAATATTCTGAGCACCCTGTGGAAATATCGT 25 단백질 HLNILSTLWKYR 26 BTP10 DNA CTGCGCAAGCTGCGTAAGCGGCTCCTCCGCGATGCCGATGACCTGTTACGTAAACTTCGCAAACGTCTGCTTCGTGACGCAGACGATCTG 27 단백질 LRKLRKRLLRDADDLLRKLRKRLLRDADDL 28 BTP11 DNA ACCGAGGAGCTGCGGGTGCGCCTCGCCTCCCACCTGCGCAAGCTGCGTAAGCGGCTCCTC 29 단백질 TEELRVRLASHLRKLRKRLL 30 BTP12 DNA CTGCGGGTGCGCCTCGCCTCCCACCTGCGCAAGCTGCGTAAGCGGCTCCTCTTACGTGTTCGTCTGGCAAGCCATCTTCGTAAACTTCGCAAACGTCTGCTT 31 단백질 LRVRLASHLRKLRKRLLLRVRLASHLRKLRKRLL 32 BTP13 DNA GGTAAAGGCCCGAAATGGATGCGTTGA 33 단백질 GKGPKWMR 34 BTP14 DNA GGTCATAAAGCAAAAGGCCCGCGTAAATGA 35 단백질 GHKAKGPRK 36 BTP15 DNA GTTATTGCAAAAATTAAGAAACCGAAATGA 37 단백질 VIAKIKKPK 38 BTP16 DNA AAGTGGAAAACCCCGAAAGTTCGTGTGTGA 39 단백질 KWKTPKVRV 40 서열 서열번호 Fc-BTP22-F 5'-TCTCCCTGTCTCTGGGTAAAGGTGGAGGCGGTTCACTTCGCAAGTTACGTAAACGCTTACTGTTACGTAAACTTCGGAAGCGCTTACTGGGCGGAGGTGGCTCTCTGCGTAAACTGCGCAAACG-3' 62 Fc-BTP22-R 5'-CGTTTGCGCAGTTTACGCAGAGAGCCACCTCCGCCCAGTAAGCGCTTCCGAAGTTTACGTAACAGTAAGCGTTTACGTAACTTGCGAAGTGAACCGCCTCCACCTTTACCCAGAGACAGGGAGA-3' 63 Fc-BTP23-F 5'-AACTGCGCAAACGTCTGTTAGGCGGTGGCGGATCGCTGCGTAAACTGCGCAAACGTCTGTTACTTCGGAAGCTGAGAAAACGCTTACTTTAAGGATCCgaattcgagctccG-3' 64 Fc-BTP23-R 5'-CGGAGCTCGAATTCGGATCCTTAAAGTAAGCGTTTTCTCAGCTTCCGAAGTAACAGACGTTTGCGCAGTTTACGCAGCGATCCGCCACCGCCTAACAGACGTTTGCGCAGTT-3' 65 Fc-BTP24-F 5'-TCTCCCTGTCTCTGGGTAAAGGTGGAGGCGGTTCAACAGAAGAGTTACGTGTTCGTCTGGCAAGCCATTTACGTAAACTTCGCAAACGTCTGTTAGGCGGAGGTGGCTCTACCGAGGAGCTGCGGGTGCG-3' 66 Fc-BTP24-R 5'-CGCACCCGCAGCTCCTCGGTAGAGCCACCTCCGCCTAACAGACGTTTGCGAAGTTTACGTAAATGGCTTGCCAGACGAACACGTAACTCTTCTGTTGAACCGCCTCCACCTTTACCCAGAGACAGGGAGA-3' 67 Fc-BTP25-F 5'-AGCTGCGTAAGCGGCTCCTCGGCGGTGGCGGATCGACGGAAGAACTTCGCGTCCGGTTAGCGTCACATCTTCGGAAATTACGGAAGCGCTTGCTGTGAGGATCCgaattcgagctccG-3' 68 Fc-BTP25-R 5'-CGGAGCTCGAATTCGGATCCTCACAGCAAGCGCTTCCGTAATTTCCGAAGATGTGACGCTAACCGGACGCGAAGTTCTTCCGTCGATCCGCCACCGCCGAGGAGCCGCTTACGCAGCT-3' 69 Fc-BTP26-F 5'-TCTCCCTGTCTCTGGGTAAAGGTGGAGGCGGTTCAAAATGGAAGACACCAAAGGTGCGCGTTGGCGGAGGTGGCTCTAAGTGGAAAACCCCGAAAGT-3' 70 Fc-BTP26-R 5'-ACTTTCGGGGTTTTCCACTTAGAGCCACCTCCGCCAACGCGCACCTTTGGTGTCTTCCATTTTGAACCGCCTCCACCTTTACCCAGAGACAGGGAGA-3' 71 Fc-BTP27-F 5'-AAACCCCGAAAGTTCGTGTGGGCGGTGGCGGATCGAAATGGAAAACTCCTAAAGTACGGGTCTGAGGATCCgaattcgagctccG-3' 72 Fc-BTP27-R 5'-CGGAGCTCGAATTCGGATCCTCAGACCCGTACTTTAGGAGTTTTCCATTTCGATCCGCCACCGCCCACACGAACTTTCGGGGTTT-3' 73