БАКТЕРИАЛЬНАЯ ВАКЦИНА И СПОСОБЫ ЕЕ ПОЛУЧЕНИЯ
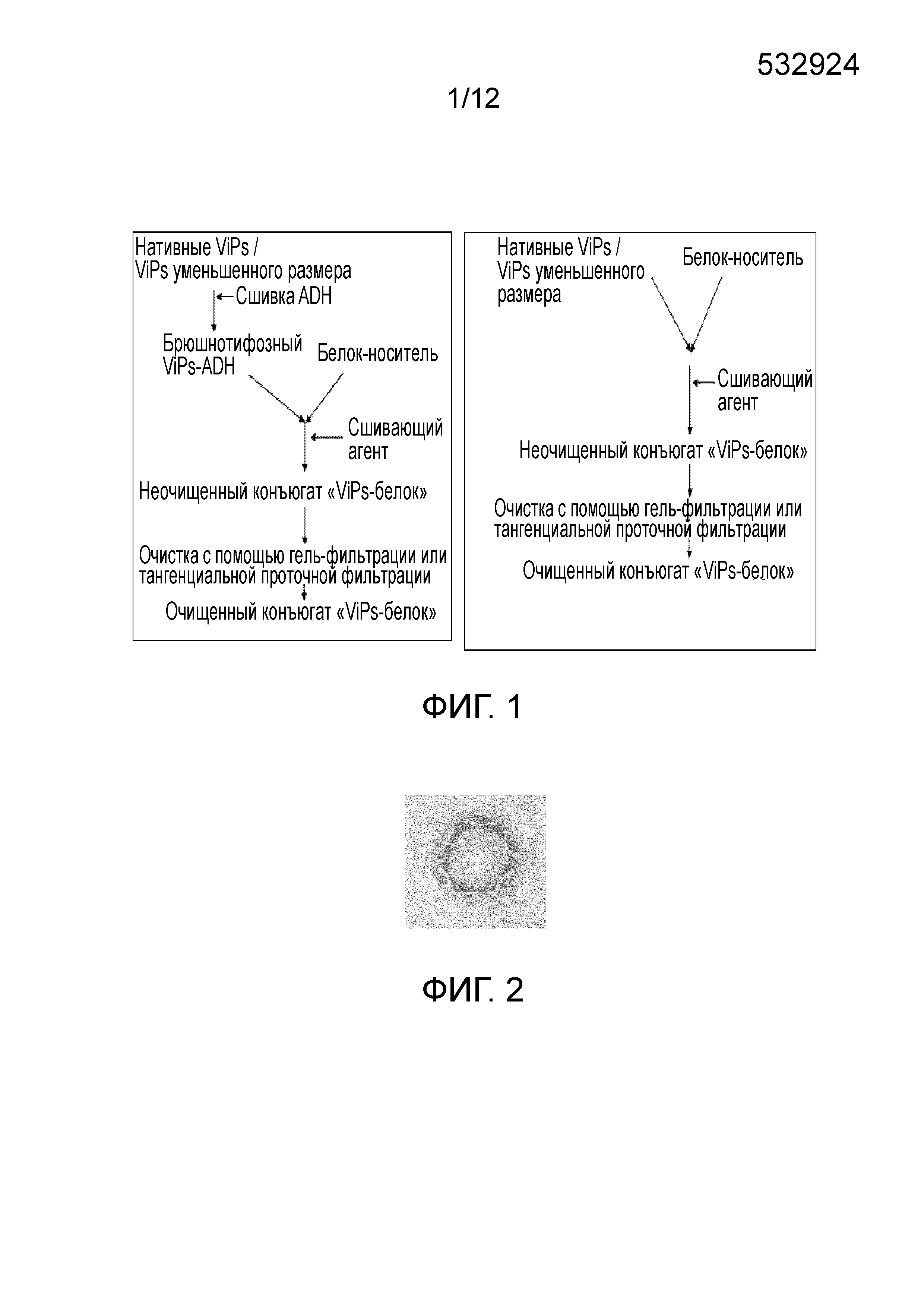
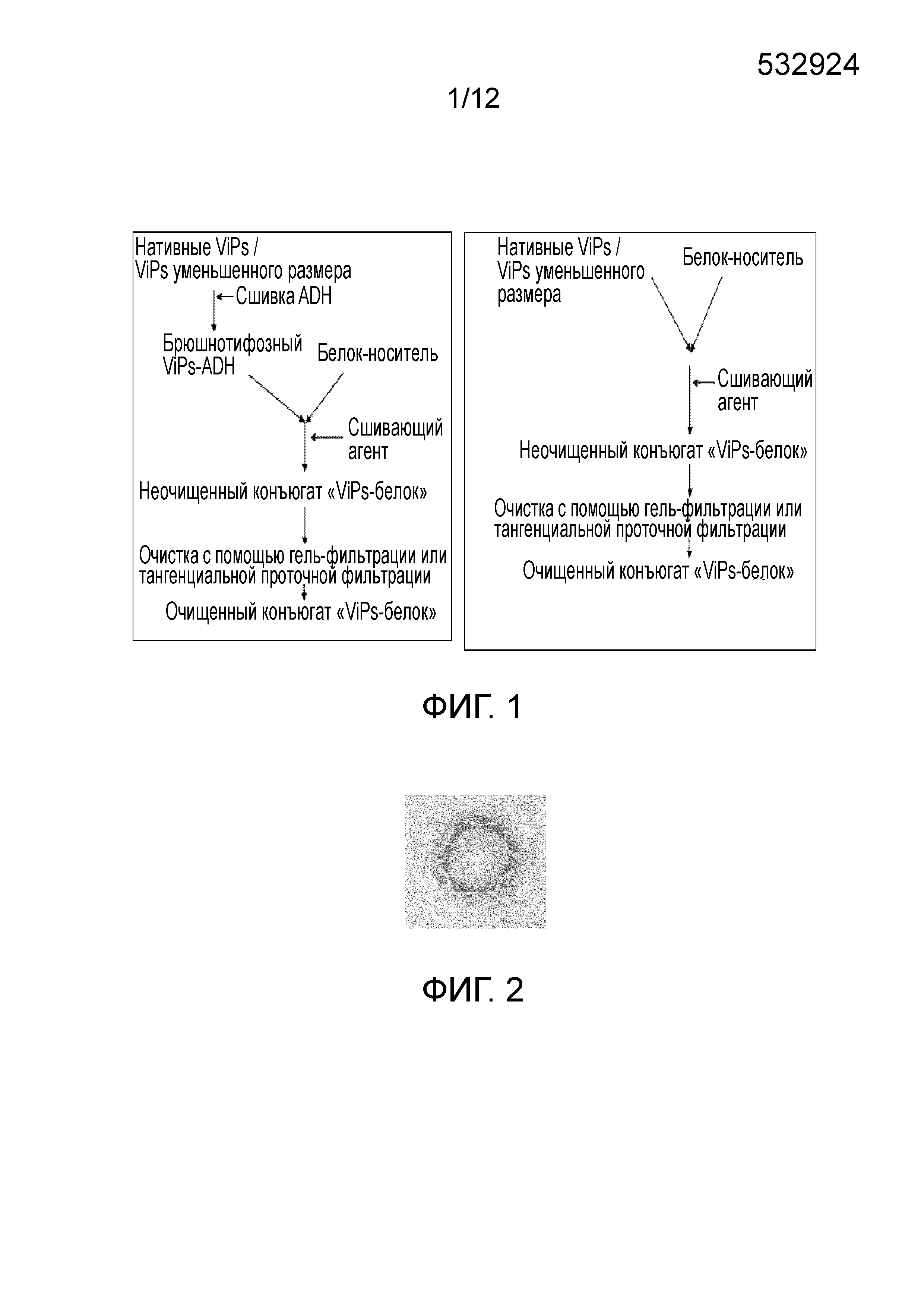
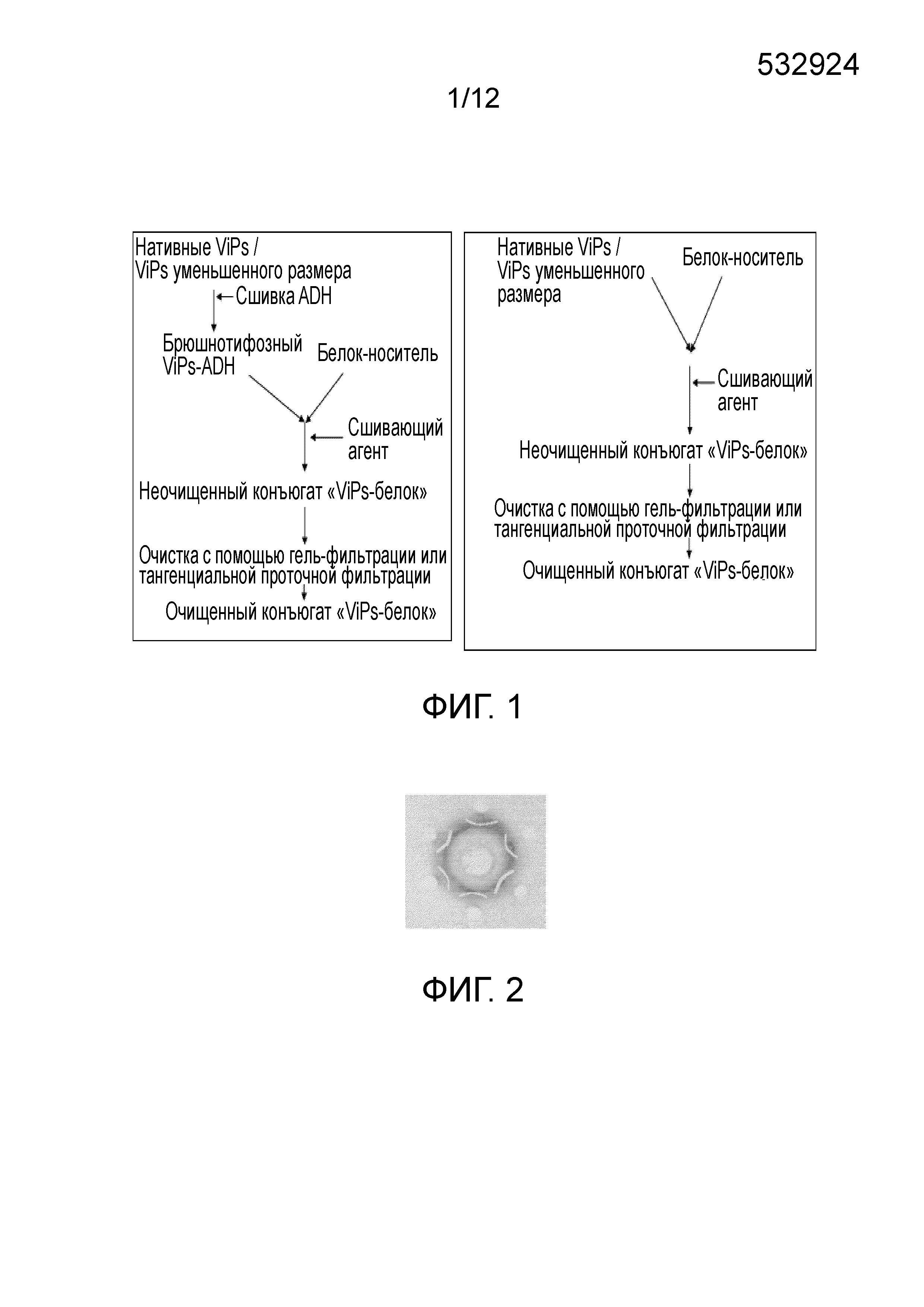
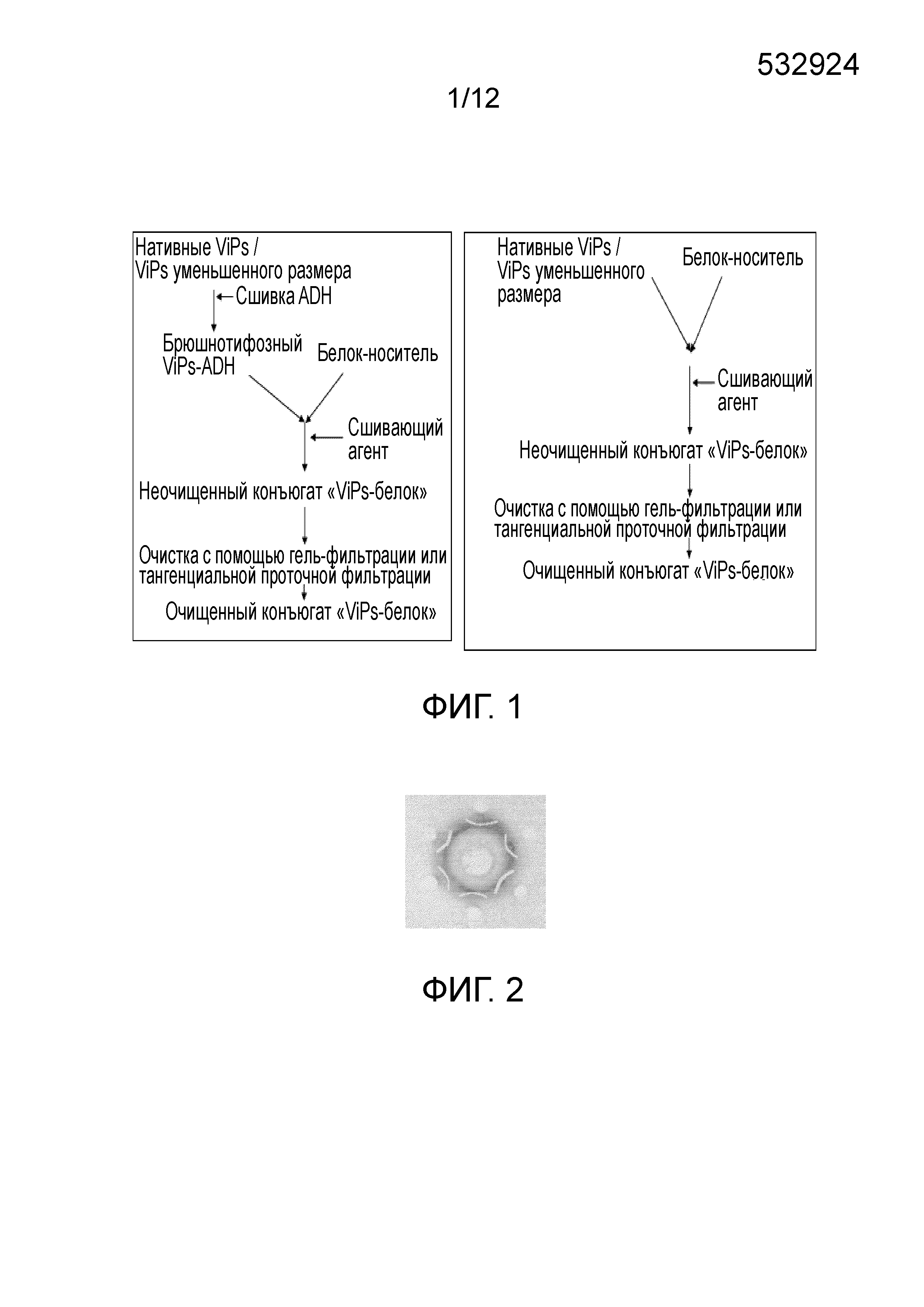
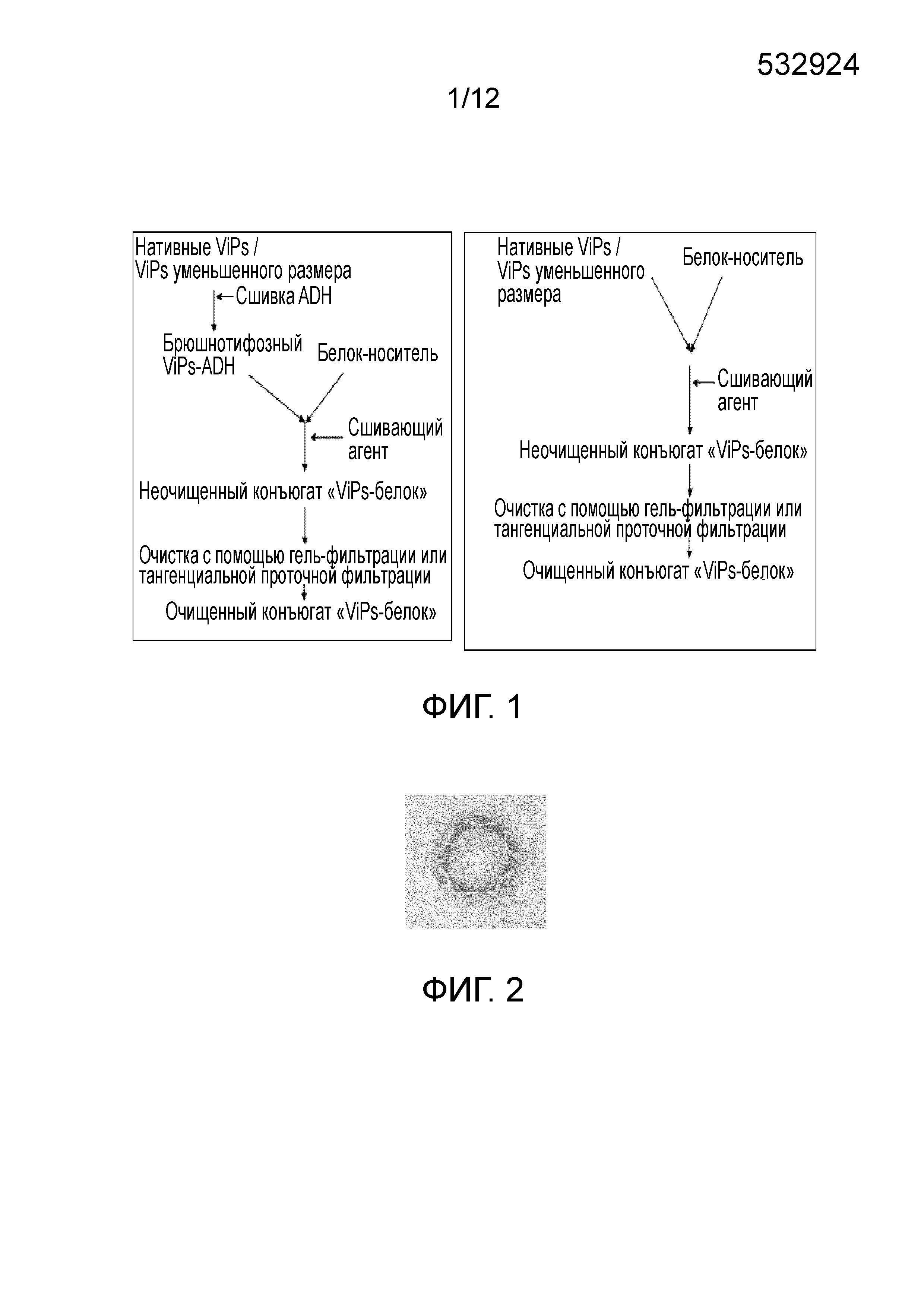
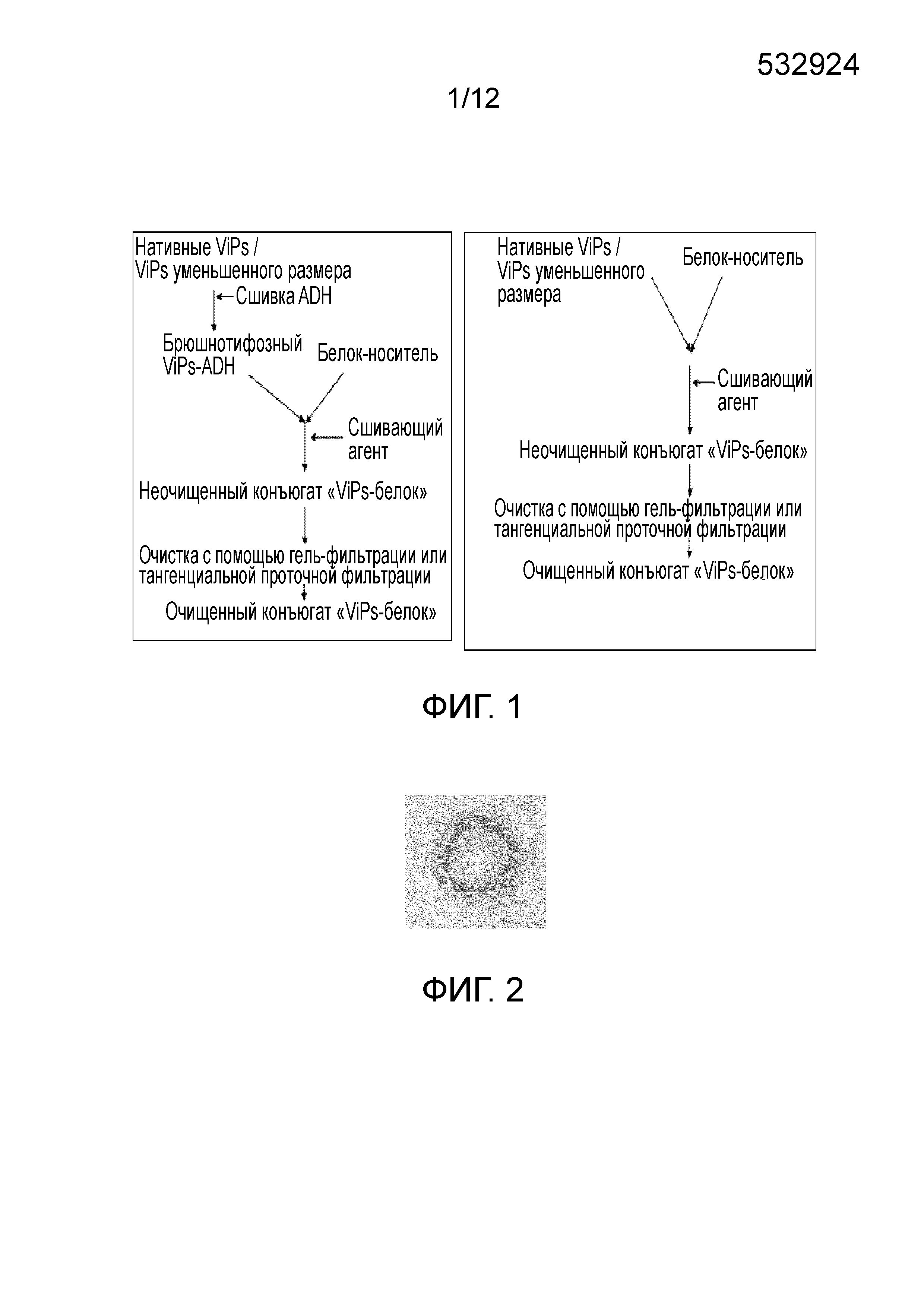
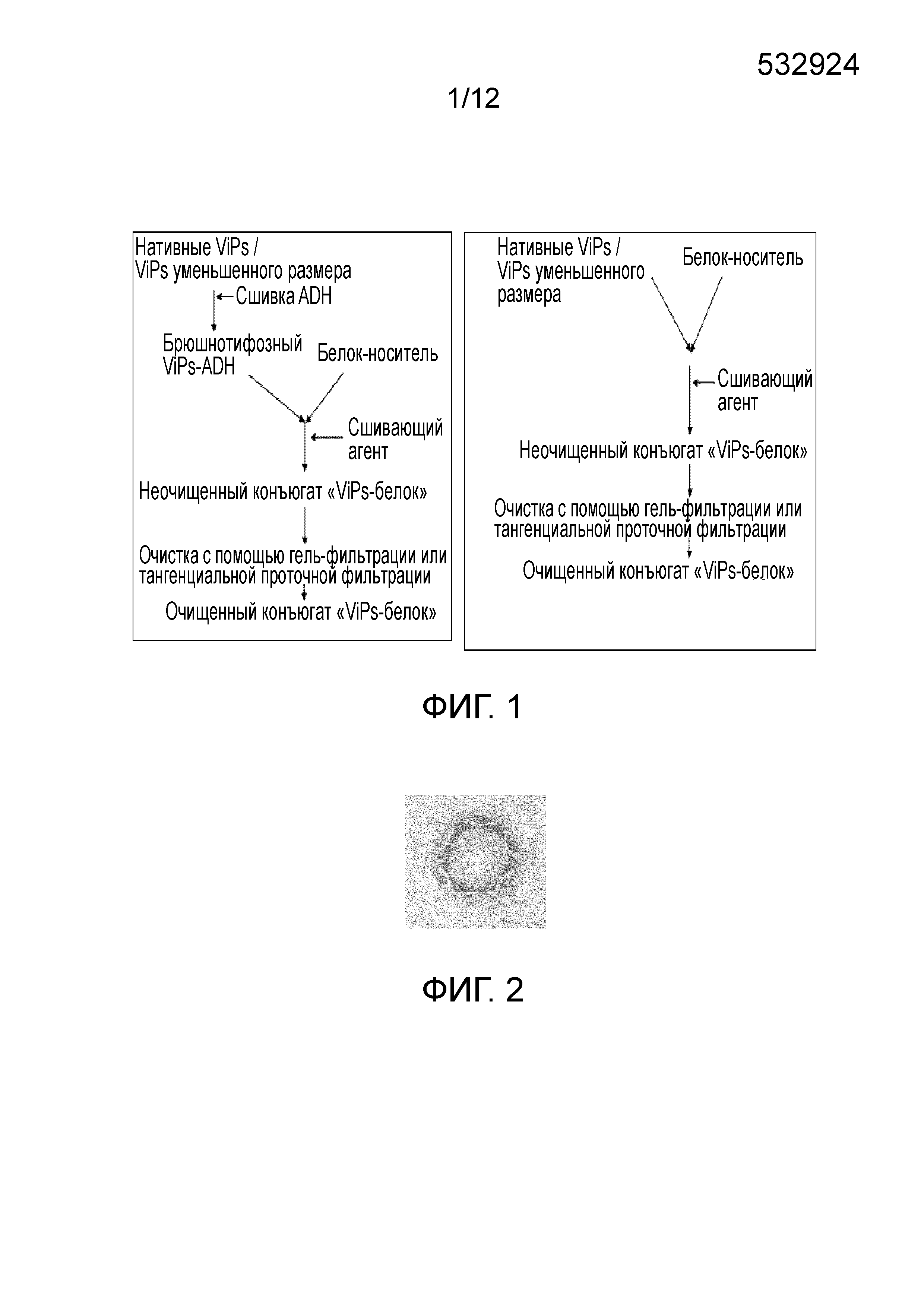
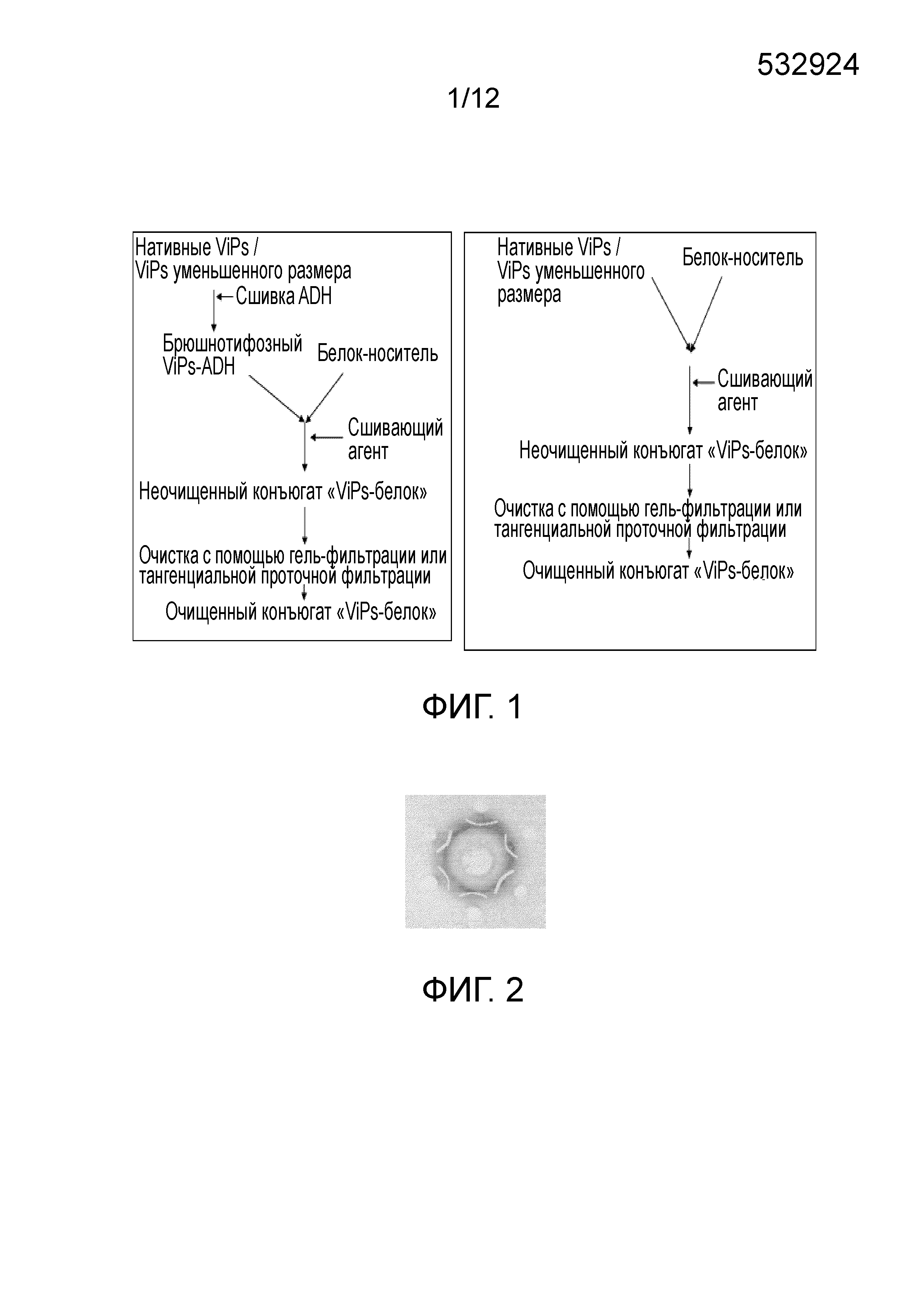
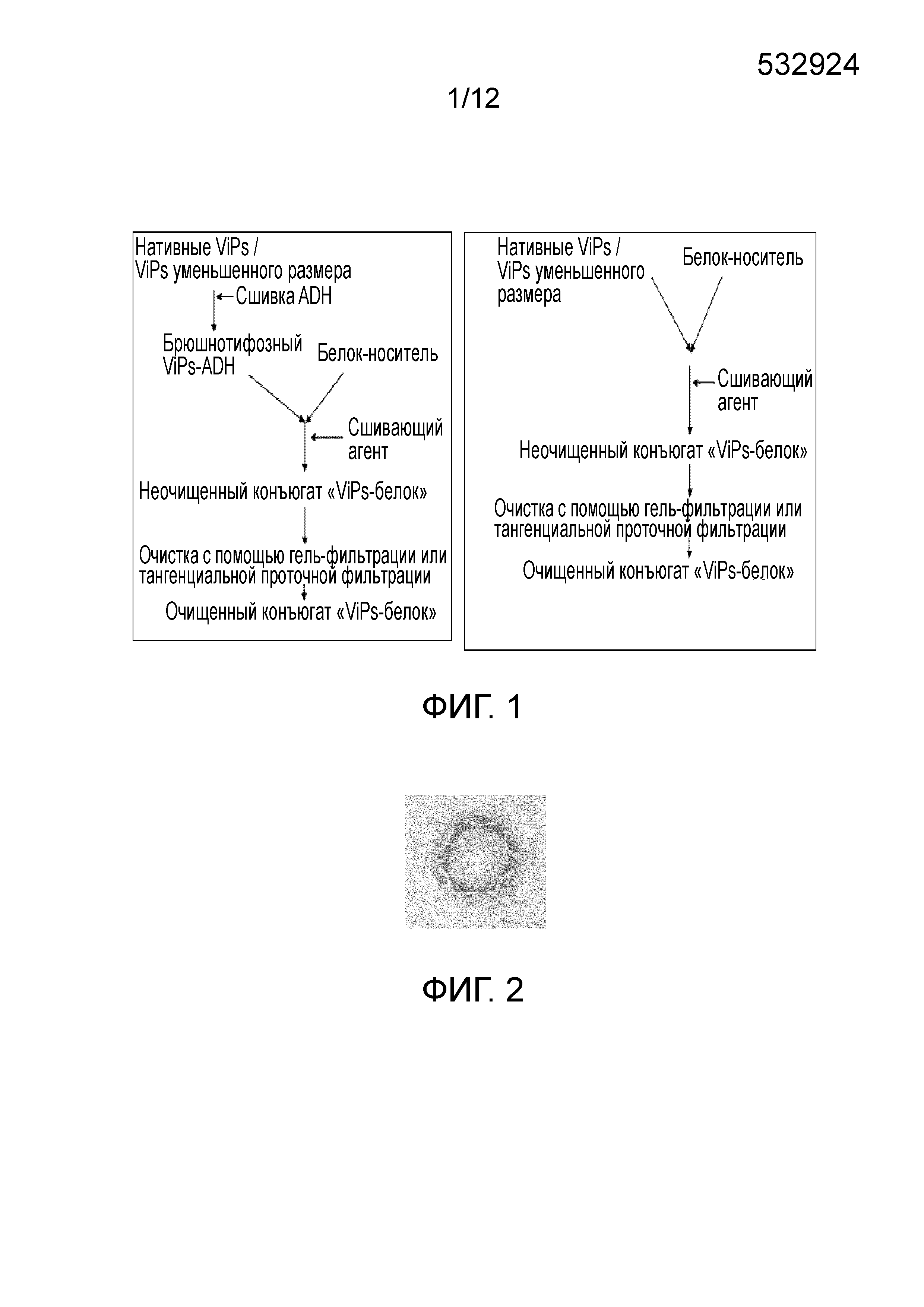
ОБЛАСТЬ ИЗОБРЕТЕНИЯ Настоящее изобретение относится к области бактериальных вакцин, которые характеризуются способностью вызывать соответствующий иммунный ответ против брюшного тифа у младенцев (до 2 лет), детей и взрослых. В частности, настоящее изобретение относится к конъюгированным вакцинам и способам их получения, в которых нативные полисахариды УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ Сальмонелла (лат. Вакцинация против брюшного тифа, вызванного Salmonella Typhi, необходима для защиты от этого заболевания, угрожающего жизни в связи с нарастающей устойчивостью к антибиотикам. Она также является важным защитным средством для людей, путешествующих в регионы, где брюшной тиф является эндемичным заболеванием. Так как бактерия может приобретать множественную лекарственную устойчивость, антибиотики не могут обеспечить полной защиты от заболевания. На данный момент для использования доступны три типа брюшнотифозных вакцин: (1) парентеральная инактивированная цельноклеточная вакцина; (2) пероральная живая аттенуированная вакцина и (3) вакцина, содержащая брюшнотифозный капсулярный Vi-полисахарид для парентерального применения. Вакцины против брюшного тифа создавали в те далекие времена, когда сложное устройство организма на клеточном и молекулярном уровнях было четко изучено. Изначально в качестве вакцины использовали вводимые парентерально цельноклеточные В WO1996/011709 раскрыт O-ацетилированный олигонуклеотид или полигалактоуронатпектин, в основном идентичный структуре субъединицы Vi-полисахарида, конъюгированный с белком-носителем столбнячным токсином, где белок-носитель модифицирован цистамином. В этой конкретной заявке на патент описано конъюгирование идентичного полисахарида, но не Vi-полисахарида, с белком-носителем и отличным от цистамина модифицирующим веществом. Впоследствии в WO1998/026799 раскрыт изолированный липополисахарид из В WO2009/150543 описан конъюгированный Vi-полисахарид для применения в качестве вакцинальной композиции против отмывают избыток линкера. Безопасность и иммуногенность вакцин, содержащих конъюгат ViPs, у взрослых, подростков и детей от 2 до 4 лет из Вьетнама оценивали Zuzana Kossaczka et al в 1999. В этом исследовании уровень среднего геометрического анти-Vi-rEPA (конъюгированная вакцина) у детей от 2 до 4 лет был выше, того, что удавалось получить с помощью Vi-капсулярной полисахаридной вакцины у детей в возрасте от 5 до 14 лет. Повторная инъекция конъюгированной вакцины вызывала повышение титров антител у детей от 2 до 4 лет (зависимое от Т-клеток). Konadu et al. (2000) получили O-специфичный полисахарид Несмотря на то, что современный уровень техники включает конъюгированные вакцины, содержащие Vi-полисахарид и белок-носитель, существующие вакцины, содержащие нативный Vi-полисахаридный конъюгат, при исследовании в рамках многочисленных клинических исследований человека демонстрируют безопасность и иммуногенность у взрослых, но не способны вызвать какой-либо защитный иммунный ответ у детей младше 2 лет. Таким образом, эта вакцина, содержащая нативный полисахарид Следовательно, существует потребность в изменении методологий конъюгацииконъюгации, которое позволит уменьшить затраты и количество инъекций до всего одной инъекции, способной вызвать достаточный иммунный ответ, и других связанных с этим технических вопросов в области химической конъюгации, которая стала бы более простой, менее времязатратной, более рентабельной и безопасной. Эффективная вакцина должна обладать способностью вызывать хороший иммунный ответ и иметь возможность применения у детей младше 2 лет. Раскрытие, как изложено в настоящем изобретении, относится к новым альтернативным способам конъюгации ЦЕЛИ ИЗОБРЕТЕНИЯ Первичной целью изобретения является разработка состава вакцины для профилактики и лечения инфекций человека вызываемых Другой целью изобретения является получение композиции вакцины против брюшного тифа, вызываемого Первой задачей изобретения является разработка способа периодического культивирования с подпиткой для получения капсулярного Vi-полисахарида. Еще одной задачей настоящего изобретения является разработка способов конъюгации капсулярного Vi-полисахарида с белком-носителем с уменьшением размера или без уменьшения размера. Еще одной задачей настоящего изобретения является разработка альтернативных способов методологии эффективной конъюгации за меньшее время посредством уменьшения размера ViPs Еще одной задачей настоящего изобретения является разработка способа конъюгации капсулярного Vi-полисахарида Следующей задачей настоящего изобретения является получение составов иммуногенной вакцины, содержащих связанные полисахарид-белковые конъюгаты «Vi-полисахарид-белки» в соответствующих флаконах, содержащих однократную дозу или несколько доз, для введения детям и взрослым в соответствующих концентрациях, эффективно обеспечивающих профилактику СУЩНОСТЬ ИЗОБРЕТЕНИЯ В соответствии с одним вариантом осуществления настоящего изобретения раскрывается культивация и обработка Vi-полисахарида В соответствии с еще одним вариантом осуществления настоящего изобретения раскрывается способ конъюгации чистого Vi-полисахарида с образованием конъюгата с белком столбнячного токсина в присутствии линкерной молекулы дигидразида адипиновой кислоты (ADH, Adipic Acid Dihydrazide). Выход образующегося очищенного ViPs-TT конъюгата достигает 70%-80%. В соответствии с другим альтернативным вариантом осуществления настоящего изобретения раскрывается способ конъюгации Vi-полисахарида с образованием конъюгата с белком столбнячного токсина в отсутствие какой-либо линкерной молекулы. Выход образующегося очищенного ViPs-TT конъюгата без линкера достигает 70%-80%. Следующий вариант осуществления настоящего изобретения раскрывает стабильные составы вакцины, содержащей ViPs-TT конъюгат, с подходящими концентрациями ViPs-TT с или без 2-феноксиэтанола в качестве консерванта для ViPs-TT, обеспечивающие проведение полного курса вакцинации посредством всего одной инъекции. Еще один вариант осуществления настоящего изобретения представляет клинически обоснованные экспериментальные данные, подтверждающие, что стабильный состав вакцины, содержащей ViPs-TT конъюгат, обладает выраженной серопротекцией и вызывает желаемую иммуногенность в отношении инфекции КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ Фигура 1: Общая схема получения ViPs и конъюгации с линкером ADH (слева) и без линкера (справа). Фигура 2: Тест на серологическое определение Vi-полисахарида. Фигура 3: ВЭЖХ (рефрактометрический детектор) нативного брюшнотифозного Vi-полисахарида; на колонке для высокоэффективной гель-фильтрационной хроматографии анализировали профиль очищенного Vi-полисахарида с помощью рефрактометрического детектора. Пик на 13,185 минутах представляет собой нативный Vi-полисахарид, молекулярный вес которого составляет ~900 кДа. Фигура 4: Уменьшение размера ViPs с помощью гомогенизотора приблизительно за 45 пропусканий. На колонке для высокоэффективной гель-фильтрационной хроматографии с помощью рефрактометрического детектора анализировали профиль Vi-полисахарида уменьшенного размера. Пик на 16,04 минутах представляет собой Vi-полисахарид уменьшенного размера, молекулярный вес которого составляет ~200кДа. Фигура 5: Уменьшение размера ViPs с применением микроволновой печи. На колонке для высокоэффективной гель-фильтрационной хроматографии с помощью рефрактометрического детектора анализировали профиль Vi-полисахарида уменьшенного размера. Пик на 15,18 минутах представляет собой Vi-полисахарид уменьшенного размера, молекулярный вес которого составляет ~250кДа. Фигура 6: ВЭЖХ (рефрактометрический детектор) массы ViPs-TT конъюгата. ВЭЖХ профиль конъюгата «Vi-полисахарид-столбнячный токсин» регистрировали с помощью рефрактометрического детектора с помощью колонки для высокоэффективной гель-фильтрационной хроматографии. Пик на 12,83 минутах представляет собой конъюгат ViPs-TT без линкерной молекулы. Фигура 7: ВЭЖХ (УФ) массы ViPs-TT. ВЭЖХ профиль конъюгата «Vi-полисахарид-столбнячный токсин» регистрировали с помощью УФ детектора с помощью колонки для высокоэффективной гель-фильтрационной хроматографии. Пик на 12,66 минутах представляет собой конъюгат ViPs-TT без линкерной молекулы. Фигура 8: ВЭЖХ (рефрактометрический детектор) массы ViPs-TT конъюгата без линкера. ВЭЖХ профиль вакцины, содержащей конъюгат «Vi-полисахарид-столбнячный токсин», регистрировали с помощью рефрактометрического детектора с помощью колонки для высокоэффективной гель-фильтрационной хроматографии. Пик на 12,98 минутах представляет собой ViPs-TT конъюгат без линкера. Фигура 9: ВЭЖХ (УФ) массы ViPs-TT конъюгата без линкера. ВЭЖХ профиль вакцины, содержащей конъюгат «Vi-полисахарид-столбнячный токсин» регистрировали с помощью УФ детектора с помощью колонки для высокоэффективной гель-фильтрационной хроматографии. Пик на 12,662 минутах представляет собой ViPs-TT конъюгат без линкера. Фигура 10: ВЭЖХ (рефрактометрический детектор) ViPs-TT конъюгированной вакцины. ВЭЖХ профиль вакцины, содержащей конъюгат «Vi-полисахарид-столбнячный токсин», регистрировали с помощью рефрактометрического детектора с помощью колонки для высокоэффективной гель-фильтрационной хроматографии. Пик на 12,82 минутах представляет собой ViPs-TT конъюгат. Фигура 11: ВЭЖХ (УФ) ViPs-TT конъюгированной вакцины. ВЭЖХ профиль вакцины, содержащей конъюгат «Vi-полисахарид-столбнячный токсин», регистрировали с помощью УФ-детектора с помощью колонки для высокоэффективной гель-фильтрационной хроматографии. Пик на 12,72 минутах представляет собой ViPs-TT конъюгат. Фигура 12: Сравнение среднего геометрического титров в различных возрастных группах после однократной инъекции одной 25 мкг дозы вакцины, содержащей ViPs-TT конъюгат. Фигура 13: Сравнение % сероконверсии в различных возрастных группах после однократной инъекции одной 25 мкг дозы вакцины, содержащей ViPs-TT конъюгат. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ Факторы, влияющие на связывание полисахаридов и белков, зависят от молекулярного веса и активации функциональных групп. Низкий молекулярный вес полисахаридов может способствовать эффективному связыванию. Различные белки, такие как столбнячный токсин, белок дифтерийного токсина CRM 197, B-субъединица термолабильного токсина (B subunit heat-labile toxin (LT-B)) Podda et al (2010) сообщили об эпидемиологии заболевания и важности вакцинации детей младше двух лет. Доступные в настоящее время вакцины имеют ряд существенных недостатков, по причине которых не могут применяться у детей младше 2 лет, то есть в возрастной группе, в значительной мере подверженной брюшному тифу. Ожидают, что внедрение конъюгированных вакцин станет эффективным средством эффективной иммунизации всех возрастных групп, хотя в настоящее время нет доступных экспериментальных данных о возможности вакцинации брюшнотифозной конъюгированной вакциной детей младше 2 лет. Настоящее изобретение основано на уникальной методологии конъюгации вакцины, содержащей ViPs-TT конъюгат, обладающей преимуществом, дающим возможность вакцинировать детей или младенцев младше двух лет для защиты от заражения Пример 1: Культивирование и обработка Vi-полисахарида Штамм 1.1. Процесс ферментации: Развитие инокулята: Содержимое одной криопробирки с рабочей культурой извлекали из морозильного шкафа и размораживали при комнатной температуре на водяной бане. Содержимое одной криопробирки из рабочего банка клеток Ферментация в периодическом режиме: Исходно готовили 85 л SCDM в 100 л сосуде из нержавеющей стали и переносили в ферментер. Среду стерилизовали Периодическая ферментация с подпиткой: Процесс периодической ферментации с подпиткой Процесс проводили на протяжении 24 часов, после чего бактериальную культуру инактивировали 0,5% формальдегидом и держали в охлажденном виде (ниже 15°C), осторожно помешивая. Рост проверяли, измеряя оптическую плотность при 600 нм в час 0 и далее каждые 2 часа до 24 часов. Эта стратегия культивирования обеспечила увеличение биомассы до уровня от 120 до 130 в единицах оптической плотности. Увеличение биомассы привело к увеличению образования Vi-полисахарида, которое в периодически подпитываемой культуре достигло конечного выхода Vi-полисахарида равного примерно 1000 мг на литр в рамках настоящего процесса, из которых после завершения последующей обработки получали 400 мг на литр очищенного ViPs. Таким образом, в результате процесса периодического культивирования с подпиткой конечный выход составил по меньшей мере 40%. 1.2. Дальнейшая обработка массы очищенного Vi-полисахарида (ViPs): Супернатант культивированных клеток проводили через различные стадии очистки с целью выделения очищенного Vi-полисахарида. Vi-полисахарид состоит из частично 3-O-ацетилированных повторяющихся единиц 2-ацетиламино-2-дезокси-d-галактопирануроновой кислоты с α-(1→4) связями. Таким образом, определение содержания O-ацетила может коррелировать с количеством Vi-полисахарида. Конечная фракция очищенного Vi-полисахарида Отделение клеток: собранную культуру центрифугировали в роторной центрифуге при 9000 оборотах в минуту (8000 g) в течение 30 минут при 4°C. Супернатант собирали в стерильные сосуды. Образец супернатанта отбирали для анализа содержания O-ацетила. Концентрирование и диафильтрация: супернатант подвергали диафильтрации с помощью системы тангенциальной проточной фильтрации, применяя 100 кДа мембрану. Супернатант концентрировали до 1/10й исходного объема и далее диафильтровали с применением воды для инъекций до достижения необходимой концентрации. Анализировали содержание O-ацетила в концентрате. Преципитация цетримидом: к концентрату добавляли 0,4 М цетримида и инкубировали при (5°±1°C) в течение 3±1 часов. Содержимое центрифугировали при 9000 оборотах в минуту в течение 30 минут при 4°C. Осадок собирали и суспендировали в необходимом объеме 1 M NaCl. Определяли содержание O-ацетила в суспензии осадка. Преципитация этанолом: Один объем этанола и 2% ацетата натрия добавляли к ресуспендированному цетримидному преципитату, содержимое перемешивали в течение 20±5 минут с помощью магнитной мешалки. Содержимое центрифугировали при 4200 оборотах в минуту (8000 g) в течение 30 минут при 4°C. Супернатант собирали в стерильную бутыль, а осадок удаляли. К супернатанту добавляли два объема этанола (100%) при постоянном помешивании в течение 60±10 минут. К описанному выше содержимому добавляли 2% ацетат натрия при постоянном помешивании. После 1 часа инкубации содержимое центрифугировали при 4200 оборотах в минуту (8000 g) в течение 30 минут при 4°C. Супернатант удаляли; осадок суспендировали в стерильной охлажденной воде для инъекций и переносили в стерильную бутыль. Определяли содержание O-ацетила в образце. Фильтрация: концентрированную массу Vi-полисахарида пропускали через 0,22 мкм капсульный фильтр (Sartopore, Sartorius). В этой стерильной фильтрованной очищенной массе Vi-полисахарида определяли содержание O-ацетила. Полученную таким образом массу Vi-полисахарида повторно экстрагировали цетримидом и преципитировали этанолом. В конце массу концентрировали и подвергали диафильтрации с применением 300 кДа кассеты (и называли концентрированной массой), как упоминали ранее. Содержание O-ацетила определяли после каждого этапа. Определяли содержание O-ацетила на различных стадиях последующей обработки, как показано в Таблице 1.2 ниже. Содержание O-ацетила определяли по способу Хестрина (Hestrin), описанному ниже. Анализ содержания O-ацетила: Определение содержания O-ацетила выполняли по способу Хестрина (Hestrin, 1949). Количество O-ацетила в образце было пропорционально количеству Vi-содержимого, выраженному в мг/мл. К исследуемым образцам добавляли 0,5 мл 3,6 N HCl и 1 мл раствора щелочного гидроксиламина и тщательно перемешивали. Смесь держали при комнатной температуре в течение 2 минут, затем добавляли 0,5 мл раствора хлорида железа и тщательно перемешивали. Поглощение измеряли при 540 нм. Содержание O-ацетила рассчитывали следующим образом: Коэффициент перевода для O-ацетила в Vi-содержимое=O-ацетил (мкмоль/мл) × 0,294 (25/0,085/1000) = Vi-содержимое (мг/мл) Конечную стерильную фильтрованную (0,22 мкм) Vi-полисахаридную массу лиофилизировали в низкотемпературной вакуумной сушильной установке (лиофилизатор – FTS system). Лиофилизированный порошок исследовали на предмет серологической идентификации по методу Оухтерлони, влажности, содержания белка, содержания нуклеиновых кислот, распределения по размеру молекул и содержания бактериального эндотоксина. В настоящем исследовании очищенный Vi-полисахарид Распределение по размеру молекул Vi-полисахарида проводили с помощью гель-фильтрационной колонки с Сефарозой CL-4B в качестве неподвижной фазы. Фракции, соответствующие 0,25 кДа, собирали после выхода свободного объема колонки (Vo) и объединяли вместе. 75% полисахарида элюировали при 0,25 кДа. Распределение по размеру молекул Vi-полисахарида Результаты исследований, полученные для одной партии высушенной массы ViPs, приведены в Таблице 1.2 ниже: Результаты, представленные выше, соответствовали всем требованиям Серии технических докладов ВОЗ 840 (WHO TRS 840) и стандартам фармакопеи Великобритании (2010) и Фaрмакопеи Индии (2010). Требования Серии технических докладов ВОЗ 840 (WHO TRS 840) (1994) в настоящем исследовании приняты в качестве стандартных технических условий. В соответствии со стандартными требованиями ВОЗ содержание белков равно 10 мг/г, нуклеиновых кислот - 20 мг/г, содержание O-ацетила составляет не менее 2 ммоль/г Vi-полисахарида, в соответствии с размером молекул 50% полисахарида должны элюироваться раньше 0,25 кДа, идентификация по способу иммунопреципитации и тест на стерильность пройдены. В соответствии с Фармакопеей Великобритании и Европейской Фармакопеей (2007), технические требования к высушенному Vi-полисахариду Пример 2: МЕТОДОЛОГИЯ КОНЪЮГАЦИИ Эффективные способы конъюгации очищенного Vi-полисахарида с белком-носителем, выбранным из любых бактериальных белков или вирусных белков, таких как дифтерийный токсин, столбнячный токсин, токсин Новизна настоящего изобретения состоит в модификации Vi-полисахарида и его активации в присутствии линкера или без молекулы линкера в присутствие сшивающих агентов. В соответствии с настоящим изобретением не требуется активация конъюгированных белков. Конъюгация активированных полисахаридов с белками-носителями происходит в присутствии сшивающих агентов, таких как EDAC. WO2009/150543 обучает получению производных белков для конъюгации, где Vi-полисахарид выделяли из 2.1. Уменьшение размера ViPs с использованием гомогенизации под высоким давлением: ViPs представляет собой большую молекулу весом около 1000 кДа. Поэтому желательно уменьшить размер молекулы до приблизительно одной четвертой размера большой молекулы с целью облегчения реакции конъюгации с белками-носителями, в том числе со столбнячным токсином, при низких концентрациях. Таким образом, ViPs в концентрации 5-7,5 мг/мл подвергали гомогенизации под высоким давлением 1500 бар при 2-8°C и воздействие повторяли на протяжении по меньшей мере 45 пропусканий. Размер молекул уменьшенных ViPs затем проверяли с помощью эксклюзионной хроматографии/гель-фильтрации, как показано на соответствующих Фигурах. Время удерживания ViPs до проведения эксклюзионной хроматографии составляло 13,185 минут (Фигура 3), в то время как, после проведения эксклюзионной хроматографии элюция ViPs происходила на 16,04 минутах (Фигура 4), что означает, что размер ViPs уменьшился до соответствующей молекулярной массы равной приблизительно 200 кДа. Содержание O-ацетила в уменьшенном ViPs остается прежним после процедуры гомогенизации, что подтверждают по способу Хестрина. После этого ViPs уменьшенного размера проводят через последующие стадии конъюгации, как обсуждают в следующих разделах. 2.2. Уменьшение размера ViPs с помощью микроволновой печи: В другом способе уменьшения размера ViPs перед конъюгацией применяли микроволновую печь. ViPs в концентрации 5-7,5 мг/мл в стеклянной бутыли помещали в микроволновую печь при 50%-100% мощности на 5-10 минут. Микроволны, генерируемые внутри печи, вызывают расщепление гликозильных связей в длинных цепях Vi-полисахарида, уменьшая их до более коротких молекул, необходимых для конъюгации с белком-носителем. Размер молекул уменьшенных ViPs затем проверяли с помощью эксклюзионной хроматографии/гель-фильтрации, как показано на соответствующих фигурах. Время удерживания ViPs до проведения эксклюзионной хроматографии составляло 13,185 минут (Фигура 3), в то время как, после проведения эксклюзионной хроматографии элюция ViPs происходила на 15,18 минутах (Фигура 5), что означает, что размер ViPs уменьшился до соответствующей молекулярной массы равной приблизительно 250 кДа. Содержание O-ацетила в уменьшенном ViPs остается прежним после обработки в микроволновой печи, что подтверждают по способу Хестрина. После этого ViPs уменьшенного размера проводят через последующие стадии конъюгации, как обсуждают в следующих разделах. 2.3. Конъюгация Vi-полисахарида со столбнячным токсином в присутствии линкера Очищенные Vi-полисахариды (уменьшенного размера или неуменьшенного размера) подвергали частичному O-деацетилированию в присутствии бикарбоната натрия, и связывали с ADH с помощью EDAC-опосредованной реакции при pH в пределах 6,0-7,5. Реакцию проводили при 2-8°C и мягком перемешивании. После инкубации реакцию останавливали, доводя pH до 8,0 с помощью фосфатного буфера-ЭДТА буфера, и далее диализовали с помощью мембран, отсекающих низкомолекулярные соединения, сначала в фосфатном буфере, а затем в буфере MES. Получившуюся в результате смесь концентрировали и проверяли на предмет содержания O-ацетила, отношения ViPs-ADH, свободного ADH. Столбнячный токсин концентрировали и диафильтровали в буфере MES с помощью мембран, отсекающих низкомолекулярные соединения. Конечный концентрированный столбнячный токсин исследовали на предмет содержания белка. Для конъюгации модифицированные Vi-полисахариды и белки связывают при конденсации карбодиимида с применением EDAC. Образующиеся связанные молекулы концентрируют и диафильтруют с помощью мембраны, отсекающей 1000 кДа, предпочтительно, полиэфирсульфоновой мембраны, с последующей постоянной сменой буфера с применением 20 диаобъемов фосфатно-солевого буфера. В диализате, содержащем очищенный ViPs-TT, оценивают отношение полисахарид-белок, которое должно находиться в пределах от 0,5% до 1,5%, содержание Vi, содержание белка и распределение молекул по размеру. Конечную массу конъюгата стерильно фильтровали с помощью 0,22 мкм мембраны и хранили при 2-8°C. При желании, образованные связанные молекулы концентрируют и диафильтруют с помощью мембраны, отсекающей 1000 кДа, предпочтительно, полиэфирсульфоновой мембраны, с помощью фосфатно-солевого буфера, а затем наносят на гель-фильтрационную колонку (шарики из перекрестно сшитой Сефарозы). Собранные фракции с соотношением от 0,5% до 1,5% соединяли вместе, концентрировали и исследовали на предмет соотношения полисахарид-белок, содержания Vi, содержания белка и распределение молекул по размеру. Конечную массу конъюгата стерильно фильтровали с помощью 0,22 мкм мембраны и хранили при 2-8°C. Распределение по размеру молекул массы конъюгированного Vi-полисахарида настоящего изобретения представлено в Таблице 2.1. Молекулярный размер ViPs-TT конъюгата, полученного в настоящем исследовании, составляет 0,3 кДа; при сравнении с результатами, полученными в рамках более ранних исследований ViPs-TT конъюгата, распределение по размеру молекул заданного конъюгата <0,1 кДа. Это означает, что распределение по размеру молекул 0,3 кДа, указывает на оптимальный фильтруемый размер, позволяющий осуществлять надлежащую фильтрацию ViPs-TT, и в тоже время обеспечивающий лучшую иммуногенность конъюгированной вакцины по сравнению с другими распределениями по размеру молекул меньшего размера, представленных в известном уровне техники. Больший молекулярный размер означает лучшую иммуногенность, хотя при этом важно также ограничивать размер молекулы на соответствующем уровне, чтобы обеспечить фильтрацию ViPs-TT. Таким образом, благодаря такому распределению по размеру молекул 0,3 кДа всего ОДНОЙ инъекции конъюгированной брюшнотифозной вакцины, как изложено в настоящем изобретении, достаточно для проведения полного курса вакцинации против брюшного тифа, вызываемого Определение общего и свободного (несвязанного) Vi-полисахарида проводили с помощью высокоэффективной анионообменной хроматографии с импульсной амперометрической детекцией (HPAEC-PAD, High-pH anion exchange chromatography with pulsed amperometric detection). В настоящей методологии выход Vi-конъюгата составлял 75% конъюгата Vi-полисахарида, элюированного при 0,30 кДа, обеспечивая таким образом лучшую полидисперсность и содержание Vi равное 0,56 мг/мл, свободного ViPs - 5%, содержание белка - 0,25 мг/мл, отношение Vi-полисахарид-белок - 1,05, пик, соответствующий свободному белку, не определялся, и стерильность считали приемлемой (см. Таблицу 2.1). Настоящую методологию применяли при размере исходной партии ViPs равном 10 грамм, из которого получили 8 литров массы конъюгированного ViPs с концентрацией Vi конъюгата равной 0,9 мг/мл – 1,0 мг/мл, что соответствует 7-8 граммам конъюгата ViPs-TT и, таким образом, выходу в 70%-80%. На фигурах с 6 по 7 представлены ВЭЖХ хроматограммы Vi-полисахарида и массы конъюгата ViPs-TT на различных стадиях с линкером. Все представленные ВЭЖХ профили четко демонстрируют эффективность конъюгации по настоящей методологии. Методологию конъюгации в присутствии линкерной молекулы ADH с целью получения очищенного вакцинального антигена конъюгата ViPs-TT для получения состава конъюгированной вакцины против брюшного тифа, вызываемого a. периодическое культивирование с подпиткой для получения очищенного ViPs в питательной среде, при этом указанная питательная среда содержит питательный раствор, содержащий глюкозу в концентрации от 1 до 2 мг/мл, с pH в интервале от 6,90 до 7,20, и с растворенным кислородом, уровень которого поддерживают между 40% и 60%, где раствор аммиака (50%) поставляли в качестве источника азота вместе с питательной средой; b. необязательное уменьшение размера ViPs, при котором ViPs в концентрации 5-7,5 мг/мл подвергают гомогенизации под высоким давлением 1500 бар при 2-8°C и повторяют такое воздействие на протяжении по меньшей мере 45 пропусканий, или помещают в микроволновую печь так, чтобы в результате получить очищенный ViPs с соответствующим молекулярным размером приблизительно равным 250 кДа; c. обработка очищенного ViPs со стадии (a) или стадии (b) сшивающим агентом EDAC; d. активация ViPs со стадии (c) линкерной молекулой ADH в присутствии EDAC; e. обработка активированного ViPs, связанного с линкерной молекулой ADH, со стадии (d) при концентрации от 1 мг/мл до 5 мг/мл очищенного ViPs ~900 кДа или при концентрации от 5 мг/мл до 7,5 мг/мл очищенного ViPs ~250 кДа белком-носителем в присутствии EDAC для образования конъюгата «Vi-полисахарид-белок-носитель»; f. диафильтрация конъюгата «Vi-полисахарид-белок-носитель» со стадии (f) с непрерывной сменой буфера с помощью фосфатно-солевого буфера, с применением 1000 кДа мембраны для получения очищенного вакцинального антигена «ViPs-белок-носитель». 2.4. Конъюгация Vi-полисахарида со столбнячным токсином без линкера: Очищенные Vi-полисахариды (уменьшенного размера или неуменьшенного размера) помещали в MES-буфер (2-морфолиноэтансульфоновую кислоту) или в фосфатно-солевой буфер, или в физиологический раствор при pH в пределах от 5,0 до 9,0 (точное значение pH 6-7,5), при этом концентрация полисахарида составляла в пределах от 1,0 мг до 20 мг/мл (5 мг/мл). Белок помещали в такой буфер, как MES, или в фосфатно-солевой буфер, или в физиологический раствор при pH в пределах от 6,0 до 9,0 (точное значение pH 6-7,5) при различных концентрациях от 2,0 мг/мл до 20 мг/мл (10 мг/мл). Отношение ViPs к белку должно находиться в пределах от 1:1 до 1:3, что означает, что для конъюгации на общее количество ViPs равное 1 г необходимо взять эквивалент белка от 1 г до 3 г белка. Конъюгацию проводили при 2°C-8°C, что позволяло обеспечить лучший контроль за скоростью реакции по сравнению с комнатной температурой. При более высоких температурах скорость реакции конъюгации слишком высокая. Не желательно подвергать полисахариды действию более высоких температур, так как после образования конъюгатов при более высоких температурах существует вероятность агрегации конъюгированных полисахарид-белковых молекул. Это увеличит размер молекул, что осложнит дальнейшую очистку конъюгированных белков на последующих стадиях. Таким образом предпочтительно проводить конъюгацию при 2-8°C. ViPs и TT смешивали друг с другом в различных концентрациях и в любом из буферов, описанных выше, при различных значениях pH и инкубировали для проведения конъюгации. Время инкубации варьировало от 15 до 45 минут при комнатной температуре (25°C), и от 1 часа до 2 часов при 2-8°C, в то время как в соответствии с методологией конъюгации с использованием ADH (с линкером), время инкубации, необходимое для конъюгации, составляет минимум 2-4 часа при 2°C-8°C. Таким образом общее время реакции также сокращается при применении данного способа конъюгации без линкера по сравнению с конъюгацией с линкером. Образовавшиеся в результате связанные молекулы концентрируют и диафильтруют с помощью мембраны, отсекающей 1000 кДа, предпочтительно, полиэфирсульфоновой мембраны, с последующей постоянной сменой буфера с применением 20 диаобъемов фосфатно-солевого буфера. В диализате, содержащем очищенный ViPs-TT, оценивают отношение полисахарид-белок, которое должно находиться в пределах от 0,5% до 1,5%, содержание Vi, содержание белка и распределение молекул по размеру. Конечную массу конъюгата стерильно фильтровали с помощью 0,22 мкм мембраны и хранили при 2-8°. При желании, образованные связанные молекулы концентрируют и диафильтруют с помощью мембраны, отсекающей 1000 кДа, предпочтительно, полиэфирсульфоновой мембраны, с помощью фосфатно-солевого буфера, а затем наносят на гель-фильтрационную колонку (шарики из перекрестно сшитой Сефарозы). Собранные фракции с соотношением от 0,5% до 1,5% объединяли вместе, концентрировали и исследовали на предмет соотношения полисахарид-белок, содержания Vi, содержания белка и распределение молекул по размеру. Конечную массу конъюгата стерильно фильтровали с помощью 0,22 мкм мембраны и хранили при 2-8°C. Настоящую методологию конъюгации без какой-либо линкерной молекулы применяли при размере исходной партии ViPs равном 10 г, из которого получили 8 литров массы конъюгированного ViPs с концентрацией Vi конъюгата равной 0,9 мг/мл – 1,0 мг/мл, что соответствует 7-8 г конъюгата ViPs-TT и, таким образом, выходу в 70%-80%. Полученный таким образом неочищенный конъюгат очищают с помощью гель-фильтрационной хроматографии, тангенциальной проточной фильтрации (TFF), ионообменной хроматографии или хроматографии гидрофобных взаимодействий (HIC). Конъюгат соответствует всем необходимым требованиям фармакопеи; далее конъюгат стерильно фильтруют. На Фигурах с 8 по 9 представлены ВЭЖХ хроматограммы Vi-полисахарида и массы ViPs-TT конъюгата на различных стадиях без линкера. Все представленные ВЭЖХ профили четко демонстрируют эффективность конъюгации в соответствии с настоящими методологиями. Методологию конъюгации без какой-либо линкерной молекулы ADH с целью получения очищенного вакцинального антигена конъюгата ViPs-TT для получения состава конъюгированной вакцины против брюшного тифа, вызываемого a. периодическое культивирование с подпиткой для получения очищенного ViPs в питательной среде, при этом указанная питательная среда содержит питательный раствор, содержащий глюкозу в концентрации от 1 до 2 мг/мл, с pH поддерживаемым в интервале от 6,90 до 7,20, и с растворенным кислородом, уровень которого поддерживают между 40% и 60%, где раствор аммиака (50%) поставляли в качестве источника азота вместе с питательной средой; b. необязательное уменьшение размера ViPs, при котором ViPs в концентрации 5-7,5 мг/мл подвергают гомогенизации под высоким давлением 1500 бар при 2-8°C и повторяют такое воздействие на протяжении по меньшей мере 45 пропусканий, или помещают в микроволновую печь так, чтобы в результате получить очищенный ViPs с соответствующим молекулярным размером приблизительно равным 250 кДа; c. обработка очищенного ViPs со стадии (a) или стадии (b) сшивающим агентом EDAC; d. обработка белка-носителя ViPs со стадии (с) при концентрации от 1 мг/мл до 5 мг/мл очищенного ViPs ~900 кДа или при концентрации от 5мг/мл до 7,5 мг/мл очищенного ViPs ~250 кДа в присутствии EDAC для образования конъюгата «Vi-полисахарид-белок-носитель»; e. диафильтрация конъюгата «Vi-полисахарид-белок-носитель» со стадии (d) с непрерывной сменой буфера с помощью фосфатно-солевого буфера, с применением 1000 кДа мембраны для получения очищенного вакцинального антигена «ViPs-белок-носитель». Линкерная молекула, например ADH, имеет концевые аминогруппы на обоих концах. Нативный Vi-полисахарид, размер которого в дальнейшем уменьшают перед конъюгацией, от природы содержит избыток функциональных карбоксильных групп (-COOH). Белки-носители, например, столбнячный токсин, содержат как амино- (-NH2), так и карбоксильные группы (-COOH). В случае конъюгации ViPs с белком-носителем с помощью линкерной молекулы ADH, конъюгацию проводят в присутствии сшивающих агентов, таких как EDAC, при этом -COOH группа ViPs должна связываться с –NH2группой линкера ADH на одном из его концов. Активированный ViPs связывает линкер ADH, присоединяясь через –CONH связь к одному концу молекулы ADH. Другой конец молекулы ADH остается свободным для последующего связывания с -COOH группой белка-носителя при соответствующих диапазонах концентраций и температуры. Активированный ViPs-ADH, таким образом, снова реагирует с белком-носителем в присутствии сшивающего агента EDAC, который позволяет –NH2группе на другом конце молекулы ADH связаться с –COOH группой на молекуле белка-носителя, таким образом формируя эффективный мостик между Vi-полисахаридом В то же время, в процессе применения методологии конъюгации ViPs с белками-носителями без какой-либо линкерной молекулы, благодаря наличию –COOH групп у Vi-полисахарида и свободных –NH2групп у белков-носителей, существует возможность прямого связывания –COOH групп ViPs с –NH2группами белков-носителей при обработке в присутствии сшивающих агентов, таких как EDAC. Вся реакция протекает в одну стадию, что минимизирует необходимость лишнего применения EDAC, а также сокращает время проведения конъюгации ViPs с белком-носителем. Так как все белки-носители содержат свободные –NH2группы и ViPs также содержат свободные –COOH, можно конъюгировать любой белок-носитель, например дифтерийный токсин, столбнячный токсин или CRM197 и т.п., с Vi-полисахаридом Общее время, необходимое для проведения полного эксперимента по конъюгации: Пример 3: Состав вакцины и ее стабильность. Типичная единичная доза состава брюшнотифозной конъюгированной вакцины, заявленная в настоящем изобретении, содержит в качестве антигена Vi-TT конъюгат в количестве от 15 микрограмм (мкг) до 25 мкг, растворенный в физиологическом растворе, доведенный до конечного объема 0,5 мл для одной инъекции для проведения полного курса вакцинации. Состав вакцины, заявленный в настоящем изобретении, также доступен в форме многодозовых флаконов. Многодозовые флаконы могут содержать либо 5 доз (для 5 разных вакцинируемых/субъектов/предполагаемых реципиентов вакцины), либо 10 доз (для 10 разных вакцинируемых/субъектов/предполагаемых реципиентов вакцины). В случае многодозовых флаконов в состав вакцины добавляют консервант для предотвращения контаминации состава вакцины в процессе многократных отборов вакцины из флакона с целью вакцинации 5-10 разных детей из одного многодозового флакона вакцины. Многодозовые флаконы с составом брюшнотифозной конъюгированной ViPs-TT вакцины настоящего изобретения содержат уникальный консервант 2-феноксиэтанол, который не содержит хлорид ртути и тиомерсал. В области техники, к которой относится настоящее изобретение, сообщают о недостатках применения стандартных консервантов, таких как хлорид ртути и тиомерсал, способствующих канцерогенности. Поэтому применение данного уникального консерванта 2-феноксиэтанола позволяет преодолеть недостатки стандартных консервантов хлорида ртути и тиомерсала. Подробная информация о многодозовых флаконах и их составе представлена в таблице ниже: Стабильность ViPs-TT конъюгированной вакцины компании BBIL подробно исследовали и подтверждали на протяжении 3 лет. Стабильность ViPs конъюгированной брюшнотифозной ViPs-TT вакцины исследовали как в условиях ускоренного хранения (25°C±2°C) в течение 6 месяцев, так и в условиях реального времени хранения (от 2°C до 8°C) в течение 36 месяцев, и обнаружили, что полученные результаты исследования находятся в допустимых пределах и соответствуют необходимым техническим требованиям (Таблицы с 3.2 по 3.5). Пример 4: Клинические исследования Готовую массу конъюгата «Vi-полисахарид-столбнячный токсин» выпускали в виде лекарственной формы и исследовали на предмет иммуногенности на мышах Balb/c, сравнивая с вакциной, содержащей нативный полисахарид. Исследование с нагрузкой проводили для оценки защитной эффективности вакцины, а доклиническое исследование проводили для оценки абдоминальной, острой и системной токсичности у лабораторных животных. Далее эффективность исследуемой вакцины, содержащей конъюгат «капсулярный Vi-полисахарид-столбнячный токсин» (Vi-TT), исследовали в двух различных концентрационных дозах (15 мкг и 25 мкг в дозе) и показали, что обе концентрации вызывают выработку защитных антител у младенцев (до 2 лет), детей и взрослых. Оценивали иммуногенность и безопасность конъюгата брюшнотифозного капсулярного Vi-полисахарида со столбнячным токсином в составе Vi-TT конъюгированной вакцины компании BBIL по сравнению с вакциной сравнения (вакцина Typbar®, содержащая Vi-полисахарид В рамках II фазы: всего 100 участников включили в исследование для оценки безопасности и иммуногенности брюшнотифозной вакцины, содержащей конъюгат капсулярного Vi-полисахарида со столбнячным токсином, по сравнению с брюшнотифозной вакциной Typbar®, содержащей капсулярный Vi-полисахарид, у здоровых подростков в возрасте от 13 до 17 лет, у детей в возрасте 6-12 лет и 2-5 лет. Исследование показало, что исследуемая вакцина, содержащая конъюгат капсулярного V- полисахарида со столбнячным токсином (Vi-TT), превосходила вакцину сравнения Typbar®, содержащую брюшнотифозной капсулярный Vi-полисахарид, в отношении иммуногенности и реактогенности во всех возрастных группaх. Среднее геометрическое титров IgG к Vi в единицах ELISA (enzyme-linked immunosorbent assay, твердофазный иммуноферментный анализ) на миллилитр (ед. ELISA/мл) увеличилось более чем в 4 раза, до 80%, 100% и 70%, соответственно, по сравнению со значениями до вакцинации только вакциной Typbar®. Исследуемую вакцину, содержащую конъюгат брюшнотифозного капсулярного Vi-полисахарида со столбнячным токсином (Vi-TT), вводили в дозе 25 мкг/доза в виде одной инъекции подросткам 13-17 лет и детям 2-6 лет. Среднее геометрическое IgG к Vi (ед. ELISA/мл) увеличивалось более чем в 4 раза, соответственно, до 100% в обеих возрастных группах по сравнению со значениями в сыворотке до вакцинации. Соответственно, в возрастной группе 2- 5 лет делали инъекции по 25 мкг/доза в виде двух инъекций. Временной интервал перед второй инъекцией составлял 6 недель, соответственно. Среднее геометрическое IgG к Vi (ед. ELISA/мл) увеличивалось более чем в четыре раза, соответственно до 100% в этой возрастной группе по сравнению со значениями в сыворотке до вакцинации. В другой группе детям в возрасте 2-5 лет вводили по 15 мкг/доза в виде двух инъекций. Временной интервал перед второй инъекцией составлял 6 недель, соответственно. Среднее геометрическое IgG к Vi (ед. ELISA/мл) увеличивалось более чем в 4 раза, соответственно до 100% в этой возрастной группе по сравнению со значениями в сыворотке до вакцинации. Во всех исследуемых группах, получивших 25 мкг в виде одной инъекции, 25 мкг в дозе в виде двух инъекций и 15 мкг в дозе в виде двух инъекций, отмечали 100% сероконверсию. Гуморальный иммунный ответ на вакцину, содержащую конъюгат «Vi-полисахарид-столбнячный токсин» (Vi-TT), превосходит ответ на вакцину сравнения, содержащую нативный полисахарид, во всех возрастных группах. Таким образом, можно заключить, что исследуемая брюшнотифозная вакцина компании BBIL, содержащая конъюгат капсулярного Vi-полисахарида со столбнячным токсином (Vi-TT), была иммуногенной по сравнению с коммерчески доступной вакциной сравнения Typbar®компании BBIL. Данные о количестве участников исследования III фазы: всего 981 участника распределили в группы для получения брюшнотифозной вакцины, содержащей конъюгат ViPs-TT, и вакцины сравнения Typbar®для оценки иммуногенности и безопасности брюшнотифозной вакцины, содержащей конъюгат «Vi-полисахарид-ТТ» (Typbar-TCVTM) по сравнению с простой брюшнотифозной Vi-полисахаридной BBIL, содержащую конъюгат ViPs-TT, среднее геометрическое титров и % 4-кратной сероконверсии анализировали в трех возрастных группах (от 6 месяцев до 2 лет, >2 до <15 лет и от 15 до 45 лет) для исследуемой брюшнотифозной ViPs-TT конъюгированной вакцины (Typbar-TCVTM). Значения среднего геометрического титров у участников в возрастных группах от 6 месяцев до 2 лет, >2 до <15 лет и от 15 до 45 лет, получавших брюшнотифозную-ТТ конъюгированную вакцину, в день 42 составляло 1952,03 ед. ELISA/мл, 1555,51 ед. ELISA/мл и 812,97 ед. ELISA/мл, соответственно, для IgG антител к брюшнотифозному Vi, по данным ELISA. Процент сероконверсии (4-кратное повышение титра) у субъектов возрастных групп от 6 месяцев до 2 лет, >2 до <15 лет и от 15 до 45 лет, получавших брюшнотифозную-ТТ конъюгированную вакцину, в день 42 составил 98,05%, 99,17% и 92,13%, соответственно (Фигура 12). В группе от 2 до <15 лет среднее геометрическое титров в группе получавших брюшнотифозную-ТТ конъюгированную вакцину Typbar-TCVTM и брюшнотифозную вакцину Typbar® в день 42 составляло 1555,51 ед. ELISA/мл и 426,63 ед. ELISA/мл, соответственно, для IgG антител к брюшнотифозному Vi, по данным ELISA (p=0,00001). Процент сероконверсии (4-кратное повышение титра) в день 42 в группах получавших вакцину Typbar-TCVTM и брюшнотифозную вакцину Typbar® составлял 99,17% и 94,86%, соответственно (p=0,0086). В группе от 15 до 45 лет среднее геометрическое титров в группе получавших вакцину Typbar-TCVTM и брюшнотифозную вакцину Typbar® в день 42 составляло 812,97 ед. ELISA/мл и 376,81 ед. ELISA/мл, соответственно, для IgG антител к брюшнотифозному Vi, по данным ELISA (p=0,0001). Процент сероконверсии (4-кратное повышение титра) в день 42 в группах получавших вакцину Typbar-TCVTM и брюшнотифозную вакцину Typbar® составлял 92,13% и 89,01%, соответственно (p=0,4737). Брюшнотифозная-ТТ конъюгированная вакцина (ViPs-TT) превосходит обычную полисахаридную вакцину в 3,16 раза по среднему геометрическому титров после вакцинации. Оцененное отношение среднего геометрического поствакцинальных титров к превакцинальным для брюшнотифозной конъюгированной вакцины (исследуемой) в 3,53 раза выше, чем у простой полисахаридной вакцины (вакцины сравнения). В отношении сероконверсии брюшнотифозная конъюгированная вакцина в значительной степени превосходит обычную полисахаридную вакцину с коэффициентом 0,016%. Резюмированные данные клинического исследования III фазы ViPs-TT конъюгированной вакцины компании BBIL Typbar-TCVTMподробно представлены в таблицах ниже по сравнению с вакциной сравнения Typbar® (Фигуры 12 и 13), а также с вакциной Peda TyphTM: Пример 5: Исследование интерференции TCV и противокоревой вакцины Typbar-TCVTM представляет собой препарат Vi-полисахаридной Проведенное исследование: определение содержания O-ацетила по способу Хестрина Vi-полисахарид Результаты: Противокоревую вакцину, разведенную в Typbar-TCVTM (ViPs-TT конъюгированную вакцину) инкубировали при 25°C, после чего анализировали содержание O-ацетила по способу Хестрина. В качестве контроля также одновременно анализировали Typbar-TCVTM (ViPs-TT конъюгированную вакцину), которую держали в начальной временной точке при 2-8°C, и Typbar-TCVTM (ViPs-TT конъюгированную вакцину), которую держали в начальной временной точке при 25°C. Как и ожидали, содержание O-ацетила в контрольных образцах при 2-8°C и 25°C было близко к исходному значению. Содержание O-ацетила в комбинированной вакцине (противокоревая+TCV) превышало допустимой нормы в час 0 (0,151 мкмоль/доза). Оно снижалось со временем к часу 4 и часу 8 (0,086 и 0,058 мкмоль/доза), находясь в пределах допустимой нормы, однако отличалось от соответствующих значений при сравнении с применением только вакцины Typbar-TCVTM при 2-8°C и 25°C. Проведенное исследование: исследование потенциала вакцины с помощью оценки цитопатического эффекта. Противокоревая вакцина представляет собой живую аттенуированную вакцину. Для титрования противокоревой вакцины готовили логарифмическое разведение, каждой порцией, полученной в результате логарифмического разведения, инокулировали клетки линии Vero в 8 повторах и инкубировали в течение 7-8 дней, после чего анализировали наличие или отсутствие цитопатического эффекта. Титр вируса вычисляли по формуле Спирмана-Карбера. Результаты представлены ниже: Результаты: По результатам исследования видно, что противокоревая вакцина при разведении собственным растворителем остается стабильной в течение 12 часов, а при разведении Typbar-TCVTM (ViPs-TT конъюгированной вакциной) стабильна в течение 4 часов, а далее между 4 и 8 часами ее активность падает. Группа изобретений касается стабильных составов вакцин. Предложены: вакцина для предотвращения брюшного тифа, вызыванного Salmonella typhi, включающая частично де-О-ацетилированный капсулярный Vi-полисахарид (ViPs) Salmonella typhi, конъюгированный с белком-носителем с формированием конъюгированного вакцинального антигена, причем ViPs дериватизированы с линекером, представляющим собой дигидразид адипиновой кислоты (ADH), или без него, причем указанный антиген присутствует в концентрации от 5 до 25 мкг на дозу, предпочтительно 25 мкг на дозу; предложены способы её получения (варианты), способ профилактики брюшного тифа и комбинированный состав вакцины, содержащий антиген, представляющей собой конъюгат Vi-полисахарида S. typhi со столбнячным токсином (ViPs-TT) и антиген кори, где отсутствует антигенная интерференция между ViPs-TT и антигеном кори. Технический результат: вакцины изобретения способны индуцировать развитие иммунитета против брюшного тифа, включая детей младше 2 лет посредством всего одной инъекции для проведения полного курса вакцинации. 5 н. и 10 з.п. ф-лы, 13 ил., 15 табл. 1. Состав вакцины для предотвращения брюшного тифа, вызываемого Salmonella typhi, включающий частично де-О-ацетилированный капсулярный Vi-полисахарид (ViPs) Salmonella typhi, конъюгированный с белком-носителем с формированием конъюгированного вакцинального антигена, причем ViPs дериватизированы с линекером, представляющим собой дигидразид адипиновой кислоты (ADH), или без него перед конъюгацией с формированием активированных ViPs так, что конъюгация происходит между активированными ViPs и белком-носителем, который не дериватизирован с ADH, и ни один свободный ADH не связан с белком-носителем; состав вакцины вызывает Т-зависимый иммунный ответ против S.typhi; причем конъюгированный вакцинальный антиген присутствует в концентрации от 5 до 25 мкг на дозу, предпочтительно 25 мкг на дозу; причем выход конъюгированного вакцинального антигена составляет от 70 до 80%. 2. Состав вакцины по п.1, где белок-носитель выбран из столбнячного анатоксина, дифтерийного анатоксина, CRM197, предпочтительно столбнячного анатоксина. 3. Состав вакцины по п.1, где конъюгированный вакцинальный антиген получен способом, включающим: a) периодическое культивирование с подпиткой для получения очищенного ViPs в питательной среде, при этом указанная питательная среда содержит питательный раствор, содержащий глюкозу в интервале концентраций от 1 до 2 мг/мл, при pH, поддерживаемым в интервале от 6,90 до 7,20, и с растворенным кислородом, уровень которого поддерживают между 40 и 60%, где раствор аммиака (50%) поставляли в качестве источника азота вместе с питательной средой; b) гомогенизацию ViPs со стадии (а) в концентрации 5-7,5 мг/мл под высоким давлением 1500 бар при 2-8°C и повтор стадии гомогенизации на протяжении по меньшей мере 45 пропусканий, или помещение в микроволновую печь с получением очищенного ViPs с молекулярной массой 250-300 кДа, который подвергают частичному де-О-ацетилированию в присутствии бикарбоната натрия; c) обработку очищенного ViPs со стадии (a) или стадии (b) сшивающим агентом EDAC; d) активацию ViPs со стадии (c) линкерной молекулой ADH в присутствии EDAC; e) обработку активированного ViPs, связанного с линкерной молекулой ADH, со стадии (d) в концентрации от 5 до 7,5 мг/мл очищенного частично де-О-ацетилированного ViPs с молекулярной массой 250-300 кДа белком-носителем в присутствии EDAC для образования конъюгата «Vi-полисахарид-белок-носитель»; и f) диафильтрацию конъюгата «Vi-полисахарид-белок-носитель» со стадии (е) с непрерывной сменой буфера с помощью фосфатно-солевого буфера, с использованием 1000 кДа мембраны для получения очищенного частично де-О-ацетилированного вакцинального антигена «ViPs-белок-носитель», причем молекулярная масса молекулы конъюгата «Vi-полисахарид-белок-носитель» составляет от 0,25 до 0,35 кДа. 4. Состав вакцины по п.1, где конъюгированный вакцинальный антиген получен способом, включающим: a) периодическое культивирование с подпиткой для получения очищенного ViPs в питательной среде, при этом указанная питательная среда содержит питательный раствор, содержащий глюкозу в интервале концентраций от 1 до 2 мг/мл, при pH, поддерживаемым в интервале от 6,90 до 7,20, и с растворенным кислородом, уровень которого поддерживают между 40 и 60%, где раствор аммиака (50%) поставляли в качестве источника азота вместе с питательной средой; b) гомогенизацию ViPs со стадии (а) в концентрации 5-7,5 мг/мл под высоким давлением 1500 бар при 2-8°C и повтор стадии гомогенизации на протяжении по меньшей мере 45 пропусканий, или помещение в микроволновую печь с получением очищенного ViPs с молекулярной массой 250-300 кДа, который подвергают частичному де-О-ацетилированию в присутствии бикарбоната натрия; c) обработку очищенного ViPs со стадии (a) или стадии (b) сшивающим агентом EDAC; d) обработку белка-носителя ViPs со стадии (с) в концентрации от 5 до 7,5 мг/мл очищенного частично де-О-ацетилированного ViPs с молекулярной массой 250-300 кДа в присутствии сшивающего агента EDAC с целью образования конъюгата «Vi-полисахарид-белок-носитель»; и e) диафильтрацию конъюгата «Vi-полисахарид-белок-носитель» со стадии (d) с непрерывной сменой буфера с помощью фосфатно-солевого буфера, с использованием 1000 кДа мембраны для получения очищенного частично де-О-ацетилированного вакцинального антигена «ViPs-белок-носитель», причем молекулярная масса молекулы конъюгата «Vi-полисахарид-белок-носитель» составляет от 0,25 до 0,35 кДа. 5. Состав вакцины по п.3, где белок-носитель выбран из столбнячного анатоксина, дифтерийного анатоксина, CRM197, предпочтительно является столбнячным анатоксином. 6. Состав вакцины по п.4, где белок-носитель выбран из столбнячного анатоксина, дифтерийного анатоксина, CRM197, предпочтительно является столбнячным анатоксином. 7. Способ получения вакцинального антигена, представляющего собой конъюгат Vi-полисахарида Salmonella typhi с белком-носителем, включающий следующие стадии: a) периодическое культивирование с подпиткой для получения очищенного ViPs в питательной среде, при этом указанная питательная среда содержит питательный раствор, содержащий глюкозу в интервале концентраций от 1 до 2 мг/мл, при pH, поддерживаемым в интервале от 6,90 до 7,20, и с растворенным кислородом, уровень которого поддерживают между 40% и 60%, где раствор аммиака (50%) поставляли в качестве источника азота вместе с питательной средой; b) гомогенизации ViPs со стадии (а) в концентрации 5-7,5 мг/мл под высоким давлением 1500 бар при 2-8°C и повтор стадии гомогенизации на протяжении по меньшей мере 45 пропусканий, или помещение в микроволновую печь с получением очищенного ViPs с молекулярной массой 250-300 кДа, который подвергают частичному де-О-ацетилированию в присутствии бикарбоната натрия; c) обработку очищенного ViPs со стадии (a) или стадии (b) сшивающим агентом EDAC; d) активацию ViPs со стадии (c) линкерной молекулой ADH в присутствии EDAC; e) обработку активированного ViPs, связанного с линкерной молекулой ADH, со стадии (d) в концентрации от 5 до 7,5 мг/мл очищенного частично де-О-ацетилированного ViPs с молекулярной массой 250-300 кДа белком-носителем в присутствии EDAC для образования конъюгата «Vi-полисахарид-белок-носитель»; и f) диафильтрацию конъюгата «Vi-полисахарид-белок-носитель» со стадии (f) с непрерывной сменой буфера с помощью фосфатно-солевого буфера, с использованием 1000 кДа мембраны для получения очищенного частично де-О-ацетилированного вакцинального антигена «ViPs-белок-носитель», причем молекулярная масса молекулы конъюгата «Vi-полисахарид-белок-носитель» составляет от 0,25 до 0,35 кДа; причем выход конъюгированного вакцинального антигена составляет от 70% до 80%. 8. Способ получения вакцинального антигена, представляющего собой конъюгат Vi-полисахарида Salmonella typhi, включающий следующие стадии: a) периодическое культивирование с подпиткой для получения очищенного ViPs в питательной среде, при этом указанная питательная среда содержит питательный раствор, содержащий глюкозу в интервале концентраций от 1 до 2 мг/мл, при pH, поддерживаемым в интервале от 6,90 до 7,20, и с растворенным кислородом, уровень которого поддерживают между 40 и 60%, где раствор аммиака (50%) поставляли в качестве источника азота вместе с питательной средой; b) гомогенизацию ViPs со стадии (а) в концентрации 5-7,5 мг/мл под высоким давлением 1500 бар при 2-8°C и повтор стадии гомогенизации на протяжении по меньшей мере 45 пропусканий, или помещение в микроволновую печь с получением очищенного ViPs с молекулярной массой 250-300 кДа; c) обработку очищенного ViPs со стадии (a) или стадии (b) сшивающим агентом EDAC; d) обработку белка-носителя ViPs со стадии (с) в концентрации от 5 мг/мл до 7,5 мг/мл очищенного частично де-О-ацетилированного ViPs с молекулярной массой 250-300 кДа в присутствии сшивающего агента EDAC с целью образования конъюгата «Vi-полисахарид-белок-носитель»; и e) диафильтрацию конъюгата «Vi-полисахарид-белок-носитель» со стадии (f) с непрерывной сменой буфера с помощью фосфатно-солевого буфера, с использованием 1000 кДа мембраны для получения очищенного частично де-О-ацетилированного вакцинального антигена «ViPs-белок-носитель», причем молекулярная масса молекулы конъюгата «Vi-полисахарид-белок-носитель» составляет от 0,25 до 0,35 кДа; причем выход конъюгированного вакцинального антигена составляет от 70% до 80%. 9. Способ по п.7, где белок-носитель выбран из столбнячного анатоксина, дифтерийного анатоксина, CRM197, предпочтительно является столбнячным анатоксином. 10. Способ по п.8, где белок-носитель выбран из столбнячного анатоксина, дифтерийного анатоксина, CRM197, предпочтительно является столбнячным анатоксином. 11. Способ профилактики брюшного тифа, в том числе у детей в возрасте младше 2 лет, посредством всего одной инъекции для проведения полного курса вакцинации, вызываемого Salmonella typhi, посредством введения состава вакцины, где состав вакцины включает частично де-О-ацетилированный капсулярный Vi-полисахарид Salmonella typhi, конъюгированный с белком-носителем столбнячным токсином, причем конъюгированный вакцинальный антиген присутствует в концентрации от 5 до 25 мкг на дозу, предпочтительно 25 мкг на дозу, где указанный состав вакцины достаточен для индукции необходимого зависимого от Т-клеток иммунного ответа против S. typhi. 12. Состав вакцины по п.1, где состав вакцины стабилен в течение 3 лет при 2-8°C, и по меньшей мере 6 месяцев при 25°C. 13. Состав вакцины по п.1, который также содержит 2-феноксиэтанол в качестве стабилизатора для многодозовых составов. 14. Состав вакцины по п.1, где % сероконверсии состава вакцины составляет от 98 до 100% в случае возрастной группы от 6 до 24 месяцев, от 99 до 100% в случае возрастной группы от 2 до 15 лет, от 90 до 100% в случае возрастной группы 92,13%, таким образом обеспечивая четырехкратное повышение сероконверсии на 42й день после вакцинации. 15. Комбинированный состав вакцины, содержащий антигены: a) антиген, представляющей собой конъюгат Vi-полисахарида S. typhi со столбнячным токсином (ViPs-TT); b) антиген кори; где отсутствует антигенная интерференция между ViPs-TT и антигеном кори, для профилактики брюшного тифа, вызываемого Salmonella typhi, и вируса кори, где указанный состав вакцины достаточен для индукции необходимого зависимого от Т-клеток иммунного ответа против S. typhi, в том числе у детей в возрасте младше 2 лет посредством всего одной инъекции для проведения полного курса вакцинации, причем каждый из вакцинальных антигенов присутствует в концентрации от 5 до 25 мкг на дозу, предпочтительно 25 мкг на дозу.Таблица 1.1
Параметры ферментации и установленные пределыПараметры Интервалы pH 6,9±0,2 Растворенный кислород 70-90% Скорость перемешивания 250±10 оборотов в минуту Температура 37±2°C Подача воздуха 0,5±0,1 (объем на объем в минуту) Таблица 1.2
Результаты исследований массы высушенного Vi-полисахаридаИсследования Результаты Серологическая идентификация (по Оухтерлони) Наблюдали четкую дугу преципитации Влажность 1,80% Белок 2,5 мг/г Vi-полисахаридного порошка Нуклеиновые кислоты 5 мг/г Vi-полисахаридного порошка Содержание O-ацетила (по Hestrin) 2,1 ммоль/г Vi-полисахаридного порошка Распределение по размеру молекул 75% полисахарида элюировали при 0,25 кДа Эндотоксины Менее 150 ед. ELISA/мкг Vi-полисахаридного порошка Таблица 2.1
Результаты исследований массы конъюгированного ViPs-TT с линкеромИсследования Результаты (в интервалах) Распределение молекул по размеру 75,7% полисахарида элюировали при 0,3 кДа Содержание Vi-конъюгата 0,9 мг/мл – 1,0 мг/мл Свободный ViPs 3% - 6%. Содержание белка 0,78 мг/мл – 0,9 мг/мл Отношение ViPs/белок 1,1 Свободный белок Не детектировался пик на 17ой-18ой минутах на ВЭЖХ УФ (280 нм) хроматограмме. Свободный белок отсутствует Стерильность Рост микроорганизмов не наблюдали Таблица 2.2
Результаты исследований массы конъюгированного ViPs-TT без линкераИсследования Результаты (в интервалах) Распределение молекул по размеру 74,3% полисахарида элюировали при 0,3 кДа Содержание Vi конъюгата 0,9 мг/мл – 1,0 мг/мл Свободный Vi Ps 3%-6%. Содержание белка 0,75 мг/мл – 0,8 мг/мл Отношение Vi Ps/белок 1,2 Свободный белок Не детектировался пик на 17ой-18ой минутах на ВЭЖХ УФ (280 нм) хроматограмме. Свободный белок отсутствует Стерильность Рост микроорганизмов не наблюдался Таблица 2.3
Сравнение времени, необходимого для проведения конъюгации.Эксперимент с линкером ADH Эксперимент без линкера ADH Активность Затраченное время Активность Затраченное время Реакция ViPs с ADH 4 часа Не требуется Не применимо Удаление свободного ADH 12-15 часов Не требуется Не применимо Анализ % ADH, связанного с ViPs 2 часа Не требуется Не применимо Реакция ViPs с TT 2-4 часа
при 2°C-8°CРеакция ViPs с TT 1-2 часа
при 2°C-8°CОчистка ViPs-TT конъюгата 10 часов Очистка ViPs-TT конъюгата 10 часов Анализ фракций ViPs-TT 10 часов Анализ фракций ViPs-TT 10 часов Объединение и стерильная фильтрация on 3 часа Объединение и стерильная фильтрация 3 часа Конечный анализ конъюгата (ВЭЖХ, содержание Vi, содержание белка, отношение) 2 часа Конечный анализ конъюгата (ВЭЖХ, содержание Vi, содержание белка, отношение) 2 часа Общее затраченное время 45-50 часов Общее затраченное время 25-27 часов Таблица 3.1
Состав вакцины для однодозовых и многодозовых флаконовКомпонент вакцины Единичная доза 5-дозовый флакон 10-дозовый флакон Vi-TT конъюгат От 15 мкг до 25 мкг От 75 мкг до 125 мкг От 150 мкг до 250 мкг Консервант
2-феноксиэтанолНе требуется 25 мг (10% об./об.) 50 мг (10% об./об.) Физиологический раствор Достаточное количество Достаточное количество Достаточное количество Объем дозы 0,5 мл 2,5 мл 5,0 мл Таблица 3.2
Исследование стабильности Typbar-TCVTM(конъюгированной с линкерной молекулой) при 2ºC - 8ºC (25 мкг в дозе Vi-TT объемом 0,5 мл)Время Описание Идентификация (по Оухтерлони) pH Содержание O-ацетила (по Хестрину) Содержание Vi (исследование) Свободный ViPs Тест на пирогены Абдоминальная токсичность Стерильность Прозрачная, бесцветная жидкость без видимых частиц при визуальном осмотре Должна наблюдаться четкая дуга преципитации От 6,50 до 7,50 От 0,064 до 0,106 мкмоль /доза 20-30 мкг/доза Не более 20% Суммарный ответ у 3 кроликов не должен превышать 1,15°C Все животные должны прожить 7 дней без уменьшения массы тела Должна соответствовать тесту на стерильность День 0 Соответствует Соответствует 7,08 0,099 29,30 6,3 0,6 Соответствует Соответствует 3ймесяц Соответствует Соответствует 7,09 0,098 28,91 6,2 0,5 Соответствует Соответствует 6й месяц Соответствует Соответствует 7,15 0,093 28,45 5,9 0,6 Соответствует Соответствует 9ймесяц Соответствует Соответствует 7,13 0,094 28,31 6,3 0,6 Соответствует Соответствует 12й месяц Соответствует Соответствует 7,03 0,091 27,89 6,3 0,6 Соответствует Соответствует 18й месяц Соответствует Соответствует 7,06 0,087 27,45 6,1 0,5 Соответствует Соответствует 24ймесяц Соответствует Соответствует 7,15 0,089 27,16 5,7 0,6 Соответствует Соответствует 36ймесяц Соответствует Соответствует 7,02 0,080 26,56 6,0 0,5 Соответствует Соответствует Таблица 3.3
Исследование стабильности Typbar-TCVTM(конъюгированной с линкерной молекулой) при 25ºC±2ºC (25 мкг в дозе Vi-TT объемом 0,5 мл)Время Описание Идентификация (по Оухтерлони) pH Содержание O-ацетила (по Хестрину) Содержание Vi (исследование) Свободный ViPs Тест на пирогены Абдоминальная токсичность Стерильность Прозрачная, бесцветная жидкость без видимых частиц при визуальном осмотре Должна наблюдаться четкая дуга преципитации От 6,50 до 7,50 От 0,064 до 0,106 мкмоль/доза 20-30 мкг/доза Не более 20% Суммарный ответ у 3 кроликов не должен превышать 1,15°C Все животные должны прожить 7 дней без уменьшения массы тела Должна соответствовать тесту на стерильность День 0 Соответствует Соответствует 7,15 0,098 28,82 4,5 0,3 Соответствует Соответствует 1й месяц Соответствует Соответствует 7,13 0,097 28,52 4,1 0,4 Соответствует Соответствует 2ймесяц Соответствует Соответствует 7,16 0,095 27,94 4,4 0,5 Соответствует Соответствует 3й месяц Соответствует Соответствует 7,12 0,093 27,35 4,9 0,5 Соответствует Соответствует 6й месяц Соответствует Соответствует 7,10 0,092 26,8 5,3 0,4 Соответствует Соответствует Таблица 3.4
Исследование стабильности Typbar-TCVTM(конъюгированной без линкерной молекулы) при 2ºC - 8ºC (25 мкг в дозе Vi-TT объемом 0,5 мл)Время Описание Идентификация (по Оухтерлони) pH Содержание O-ацетила (по Хестрину) Содержание Vi (исследование) Свободный ViPs Тест на пирогены Абдоминальная токсичность Стерильность Прозрачная, бесцветная жидкость без видимых частиц при визуальном осмотре Должна наблюдаться четкая дуга преципитации От 6,50 до 7,50 От 0,064 до 0,106 мкмоль/доза 20-30 мкг/доза NMT 20% Суммарный ответ у 3 кроликов не должен превышать 1,15°C Все животные должны прожить 7 дней без уменьшения массы тела Должна соответствовать тесту на стерильность День 0 Соответствует Соответствует 7,03 0,101 29,60 6,0 0,5 Соответствует Соответствует 3й месяц Соответствует Соответствует 7,05 0,095 27,93 6,3 0,7 Соответствует Соответствует 6й месяц Соответствует Соответствует 7,15 0,093 27,34 5,8 0,5 Соответствует Соответствует 9ймесяц Соответствует Соответствует 7,10 0,094 27,63 6,0 0,5 Соответствует Соответствует 12й месяц Соответствует Соответствует 7,00 0,092 27,04 6,3 0,6 Соответствует Соответствует 18й месяц Соответствует Соответствует 7,02 0,086 25,28 6,2 0,6 Соответствует Соответствует 24й месяц Соответствует Соответствует 7,11 0,087 25,57 6,5 0,7 Соответствует Соответствует 36й месяц Соответствует Соответствует 7,04 0,086 25,28 6,7 0,5 Соответствует Соответствует Таблица 3.5
Исследование стабильности Typbar-TCVTM(конъюгированной без линкеной молекулы) при 25ºC±2ºC (25 мкг в дозе Vi-TT объемом 0,5 мл)Время Описание Идентификация (по Оухтерлони) pH Содержание O-ацетила (по Хестрину) Содержание Vi (исследование) Свободный ViPs Тест на пирогены Абдоминальная токсичность Стерильность Прозрачная, бесцветная жидкость без видимых частиц при визуальном осмотре Должна наблюдаться четкая дуга преципитации От 6,50 до 7,50 От 0,064 до 0,106 мкмоль/доза 20-30 мкг/доза Не более 20% Суммарный ответ у 3 кроликов не должен превышать 1,15°C Все животные должны прожить 7 дней без уменьшения массы тела Должна соответствовать тесту на стерильность День 0 Соответствует Соответствует 7,10 0,093 27,30 5,0 0,3 Соответствует Соответствует 1ймесяц Соответствует Соответствует 7,12 0,095 27,93 4,9 0,6 Соответствует Соответствует 2й месяц Соответствует Соответствует 7,15 0,098 28,80 5,1 0,4 Соответствует Соответствует 3й месяц Соответствует Соответствует 7,13 0,094 27,63 5,3 0,5 Соответствует Соответствует 6й месяц Соответствует Соответствует 7,11 0,095 27,93 5,7 0,6 Соответствует Соответствует Таблица 4.1
Данные исследования III фазы вакцины Typbar-TCVTMОтвет Период Возрастная группа 6 месяцев - 2 года (N=307) 2 года - 15 лет (N=242) 15 лет - 45 лет (N=90) Среднее геометрическое титров, ед. ELISA/мл (нижний предел ДИ, верхний предел ДИ) День 0 9,44 (8,66, 10,31) 9,61(8,92, 10,35) 13,01(10,60, 15,97) День 42 1952,03
(1795,48, 2122,23)1555,51 (1371,33, 1764,43) 812,97
(637,66, 1036,46)Сероконверсия (%) (4-кратная) День 0 - День 42 98,05% 99,17% 92,13% Таблица 4.2
Typbar-TCVTMпо сравнению с Typbar®Возрастная группа Однократная инъекция 25 мкг ViPs-TT конъюгированной вакцины Typbar-TCVTMкомпании BBIL для проведения полного курса вакцинации (единичная доза) Простая ViPs вакцина Typbar®компании BBIL Среднее геометрическое титров
в день 42
(ед. ELISA/мл)% сероконверсии в день 42 Среднее геометрическое титра
в день 42
(ед. ELISA/мл)% cероконверсии в день 42 6 месяцев - 24 месяца 1952,03 98,05% Не применимо Не применимо 2 года- 15 лет 1555,51 99,17% 426,03 94,86% 15 лет - 45 лет 812,97 92,13% 376,81 89,01% Таблица 5.1
Техническое описание брюшнотифозной конъюгированной и противокоревой вакцинБрюшнотифозная конъюгированная вакцина Противокоревая вакцина Typbar-TCVTM
(ViPs-TT конъюгированная вакцина)
Единичная доза- 0,5 млПротивокоревая вакцина (ЖИВАЯ), Фармакопея Индии
(лиофилизированная)
Единичная доза- 0,5млТаблица 5.2
Содержание O-ацетила по методу ХестринаНомер образца Описание образца 0 час 4й час 8й час 1. Typbar-TCVTM (ViPs-TT конъюгированная вакцина) в начальной временной точке при 2-8°C 0,098 мкмоль/доза 0,098 мкмоль/доза 0,098 мкмоль/доза 2. Typbar-TCVTM (ViPs-TT конъюгированная вакцина) при 25°C 0,100 мкмоль/доза 0,100 мкмоль/доза 0,096 мкмоль/доза 3. Противокоревая вакцина, разведенная в Typbar-TCVTM (ViPs-TT конъюгированная вакцина) при 25°C 0,151 мкмоль/доза 0,086 мкмоль/доза 0,058 мкмоль/доза Техническое описание 0,064-0,106 мкмоль/доза 0,064-0,106 мкмоль/доза 0,064-0,106 мкмоль/доза Таблица 5.3
Исследование потенциала вакцины с помощью оценки цитопатического эффектаРезультаты (log10 CCID50 (50% cell culture infective dose, средняя заражающая доза для клеточной культуры)/0,5мл) исследования интерференции противокоревой вакцины с TCV № Описание образца 0 часов 4 часа 8 часов 12 часов 1 Противокоревая вакцина, разведенная собственным растворителем в начале каждой временной точки 3,50 3,40 3,50 2 Противокоревая вакцина, разведенная собственным растворителем, которую держали при 25°C 3,50 3,45 3,50 3,40 3 Противокоревая вакцина, растворенная Typbar-TCVTM (ViPs-TT конъюгированная вакцина), которую держали при 25°C 3,30 3,15 3,00 2,80 Техническое описание Не менее 3,00

CPC - классификация
AA6A61A61KA61K2A61K20A61K203A61K2039A61K2039/A61K2039/5A61K2039/54A61K2039/545A61K2039/55A61K2039/6A61K2039/60A61K2039/603A61K2039/6037A61K2039/62A61K2039/627A61K2039/7A61K2039/70A61K3A61K31A61K31/A61K31/7A61K31/71A61K31/715A61K39A61K39/A61K39/0A61K39/00A61K39/001A61K39/0016A61K39/02A61K39/027A61K39/0275A61K39/08A61K39/1A61K39/11A61K39/114A61K39/12A61K39/16A61K39/165A61K39/2A61K39/29A61K39/295A61K39/3A61K39/38A61K39/385A61K4A61K47A61K47/A61K47/6A61K47/64A61K47/641A61K47/6415A61K47/646A61PA61P3A61P31A61P31/A61P31/0A61P31/04A61P31/1A61P31/12A61P31/14CC0C07C07KC07K1C07K14C07K14/C07K14/2C07K14/25C07K14/255C1C12C12NC12N2C12N27C12N276C12N2760C12N2760/C12N2760/1C12N2760/18C12N2760/184C12N2760/1843C12N2760/18434C12N7C12N7/C12N7/0C12N7/00YY0Y02Y02AY02A5Y02A50Y02A50/Y02A50/3Y02A50/30IPC - классификация
AA6A61A61KA61K3A61K31A61K31/A61K31/7A61K31/71A61K31/715A61K39A61K39/A61K39/1A61K39/11A61K39/112A61K39/12A61K39/16A61K39/165A61PA61P3A61P31A61P31/A61P31/0A61P31/04A61P31/1A61P31/12CC1C12C12NC12N1C12N1/C12N1/2C12N1/20C12N7C12N7/C12N7/0C12N7/00Цитирование НПИ
WO 00/33882 A1, 15.06.2000. JANG H. et al. Optimization of VI capsular polysaccharide production during growth of Salmonella enterica serotype Typhi Ty2 in a bioreactor. J.Biotechnol. 2008 May 20; 135(1): 71-7 [он лайн] [найдено 26.04.2018] (найдено из интернет: www:nabi.nlm.nih.gov/pubmed/18400326) реферат, разделы 3.2.-3.3. ALDER M.D. et al. Transport of antibiotica and metabolite analogs by systems under cyclic AMP control: positive selection of Salmonella typhimurium cya and crp mutants. Journal of Bacteriology Jan 1978 133(1): 149-152.WO 2012/164480 A1, 06.12.2012.