NEW APPROACH FOR SYNTHESIZING ACETYL COENZYME A AND DERIVATIVE PRODUCT THEREOF USING GLYCOLALDEHYDE
本发明涉及生物医药技术领域,具体涉及一种利用乙醇醛合成乙酰辅酶A及其衍生产品的方法。 乙酰辅酶A(AcCoA)是合成必要的生物化合物的关键中间体,该必要生物化合物包括聚酮化合物、脂肪酸、类异戊二烯、生物碱、维生素和氨基酸等。来源于AcCoA的代谢产物为初级和次级代谢物,其包括工业效用的化合物。AcCoA可以由乙酰磷酸(AcP)生成(如可通过磷酸乙酰转移酶Pta(EC 2.3.1.8)催化得到),继而生成一系列以AcCoA为平台的生物产品,广泛应用于生物催化等领域。AcP的合成方法有: 专利申请WO2015/144447A1公开了一种利用磷酸转酮酶(EC 4.1.2.9、果糖-6-磷酸磷酸转酮酶EC4.1.2.22)或磺基乙醛乙酰转移酶(EC 2.3.3.15)催化甲醛生产乙酰磷酸的方法,反应方程如下: 2*甲醛+磷酸→乙酰磷酸+H2O。 上述制备反应使用的磷酸转酮酶,与甲醛的亲和力差,催化效率不及转化其最适底物5-磷酸木酮糖时的百分之一,并且微生物细胞对于甲醛的耐受能力普遍较差,可应用拓展的空间较小。 专利申请WO2015/181074A1公开了利用磷酸转酮酶(EC 4.1.2.9、果糖-6-磷酸磷酸转酮酶EC4.1.2.22)催化D-果糖生产D-赤藓糖和乙酰磷酸的方法,该方法还包括将D-赤藓糖转化为乙醇醛,然后再进一步转化为乙酰磷酸,反应过程如下:
上述乙酰磷酸的制备方法的反应速率较低,磷酸转酮酶对于果糖的转化数kcat仅为0.1/s,效率很低,并且反应时间较长(18h)会对酶和产物的稳定性提出考验。另外,第三步D-erythrose裂解为乙醇醛的反应是可逆过程,其反应速率受到裂解后的乙醇醛浓度的影响,使体系中很难积累高浓度的乙醇醛,这会导致乙酰磷酸的生成速率难以保证。第二步酶促反应生成的乙酰磷酸很可能会由于产物抑制而影响最后一步酶促反应的收率,如果第二步酶促反应生成乙酰磷酸后即时除去,会使整个制备工艺操作复杂化。 发明内容 为克服现有技术的不足,本发明一方面提供一种5-磷酸阿拉伯糖
(Ara5P)的制备方法,所述方法包括在酶催化下乙醇醛和3-磷酸甘油醛反应生成Ara5P,所述的酶选自:醛缩酶、转醛醇酶、及其同工酶、突变酶。 优选的,所述的制备的反应是通过微生物来进行的。 优选的,所述的醛缩酶为果糖二磷酸醛缩酶(EC 4.1.2.13)。 优选的,所述的转醛醇酶为大肠杆菌Escherichia coli来源的转醛醇酶(EC 2.2.1.2)的突变酶TalBF178Y。 本发明另一方面还提供一种用于制备Ara5P的组合物,包括: (1)乙醇醛, (2)3-磷酸甘油醛, (3)醛缩酶、转醛醇酶、或其同工酶、突变酶; 或, (1)乙醇醛, (2)3-磷酸甘油醛, (3)表达醛缩酶、转醛醇酶、或其同工酶、突变酶的微生物; 优选的,所述的醛缩酶为果糖二磷酸醛缩酶(EC 4.1.2.13)。 优选的,所述的转醛醇酶为大肠杆菌Escherichia coli来源的转醛醇酶(EC 2.2.1.2)的突变酶TalBF178Y。 本发明另一方面提供一种乙酰磷酸(AcP)的制备方法,所述方法包括上述Ara5P的制备方法步骤;优选的,所述的AcP的制备方法还包括Ara5P转化为5-磷酸木酮糖(Xu5P)再进一步转化为AcP的步骤。 优选的,所述的Ara5P转化为Xu5P的步骤包括Ara5P转化为5-磷酸核酮糖(Ru5P)再进一步转化为Xu5P的步骤。 优选的,所述的Xu5P转化为AcP的反应包括Xu5P和磷酸在磷酸转酮酶催化下生成AcP的步骤。 更优选的,所述的磷酸转酮酶为磷酸转酮酶(EC 4.1.2.9)或果糖-6-磷酸磷酸转酮酶(EC 4.1.2.22)。
所述的磷酸转酮酶可来自各种种属的微生物表达、人工合成及纯化过程,特别是来源于微生物如优选来源于Pseudomonas stutzeri(如施氏假单胞菌Pseudomonas stutzeri A1501)和Bifidobacterium adolescentis菌株的磷酸转酮酶在上述反应中均可发挥良好的催化作用。 优选的,Xu5P转化为AcP的反应体系中还包括磷酸转酮酶的辅酶,如焦磷酸硫胺素(ThDP)。 优选的,所述的制备的反应是通过微生物来进行的。 本发明另一方面提供一种用于制备AcP的组合物,包括上述用于制备Ara5P的组合物。 优选的,上述用于制备AcP的组合物还包括磷酸、磷酸转酮酶。 更优选的,上述用于制备AcP的组合物还包括磷酸转酮酶辅酶。 优选的,上述用于制备AcP的组合物还包括可催化Ara5P生成Xu5P的酶,该酶可为一种酶,也可为两种以上的酶的组合,优选为核糖-5-磷酸异构酶和核酮糖-磷酸3-异构酶的组合,或,阿拉伯糖-5-磷酸异构酶和核酮糖-磷酸3-异构酶的组合。 在本发明的一个优选实施例中,上述用于制备AcP的组合物包括: (1)乙醇醛, (2)3-磷酸甘油醛, (3)醛缩酶、转醛醇酶、或其同工酶、突变酶, (4)核糖-5-磷酸异构酶或阿拉伯糖-5-磷酸异构酶, (5)核酮糖-磷酸3-异构酶, (6)磷酸、磷酸转酮酶、辅酶。 优选的,所述的醛缩酶为果糖二磷酸醛缩酶(EC 4.1.2.13)或脱氧核糖磷酸醛缩酶(4.1.2.4)。 优选的,所述的转醛醇酶为大肠杆菌Escherichia coli来源的转醛醇酶(EC 2.2.1.2)的突变酶TalBF178Y。
优选的,所述的磷酸转酮酶为磷酸转酮酶(EC 4.1.2.9)或果糖-6-磷酸磷酸转酮酶(EC 4.1.2.22)。 优选的,所述的磷酸转酮酶辅酶为焦磷酸硫胺素。 在本发明的一个更优选实施例中,上述用于制备AcP的组合物包括: (1)乙醇醛, (2)3-磷酸甘油醛, (3)果糖二磷酸醛缩酶(EC 4.1.2.13)或脱氧核糖磷酸醛缩酶(EC4.1.2.4)或大肠杆菌Escherichia coli来源的转醛醇酶(TalB)的突变酶TalBF178Y, (4)核糖-5-磷酸异构酶(EC 5.3.1.6)或阿拉伯糖-5-磷酸异构酶(EC5.3.1.13), (5)核酮糖-磷酸3-异构酶(EC 5.1.3.1), (6)磷酸、磷酸转酮酶(EC 4.1.2.9)或果糖-6-磷酸磷酸转酮酶(EC4.1.2.22)及焦磷酸硫胺素。 AcP的稳定性较差,在实际应用中常做成乙酰磷酸盐的形式,本发明另一方面提供一种乙酰磷酸盐的制备方法,所述方法包括上述Ara5P的制备方法步骤。 优选的,所述的乙酰磷酸盐的制备方法包括上述AcP的制备方法步骤。 优选的,所述的乙酰磷酸盐包括:乙酰磷酸二锂盐、乙酰磷酸二钠盐和乙酰磷酸二铵盐。 本发明另一方面提供一种乙酰辅酶A(AcCoA)的制备方法,所述方法包括上述Ara5P的制备方法步骤。 优选的,所述的AcCoA的制备方法包括上述AcP的制备方法步骤。 优选的,所述的AcCoA的制备方法还包括在乙酰磷酸转移酶(Pta)作用下AcP转化为AcCoA的步骤。 优选的,所述的制备的反应是通过微生物来进行的。
本发明另一方面提供一种AcCoA衍生化合物的制备方法,所述方法包括上述Ara5P的制备方法步骤,优选的,所述方法包括上述AcP的制备方法步骤,更优选的,所述方法包括上述AcCoA的制备方法步骤;在本发明的一个优选实施例中,所述的AcCoA衍生化合物选自:丙酮、异丙醇、乙酸、L-谷氨酸、L-谷氨酰胺、L-脯氨酸、L-精氨酸、L-亮氨酸、L-半胱氨酸、琥珀酸酯和聚羟基脂肪酸酯。 在本发明的另一个优选实施例中,所述的AcCoA衍生化合物为聚3-羟基丁酸酯(PHB)。 优选的,所述的制备的反应是通过微生物来进行的。 上述Ara5P、AcP、乙酰磷酸盐、AcCoA、AcCoA衍生化合物的制备方法中所述的3-磷酸甘油醛可采用商购,也可采用现有技术中已知的方法制备得到,如利用葡萄糖、甘油、磷酸二羟基丙酮等制备得到,例如磷酸二羟基丙酮可以在丙糖磷酸异构酶作用下转化为3-磷酸甘油醛;也可在上述制备方法的反应体系中加入3-磷酸甘油醛的制备反应物,实现在线制备;3-磷酸甘油醛的来源并不会限制本发明的保护范围。 上述Ara5P、AcP、乙酰磷酸盐、AcCoA、AcCoA衍生化合物的制备方法中所述的乙醇醛可由现有技术中已知的方法制备得到,如,乙醛的卤代反应、糖类的裂解反应等,其中,利用甲醛制备乙醇醛的成本较低,优选的,上述乙醇醛是利用甲醛按照现有技术优选如“甲醛合成乙醇醛研究及其应用进展”中记载的乙醇醛的制备方法和工艺(辛坤,李青松,贾冰,等.甲醛合成乙醇醛研究及其应用进展.天然气化工·C1化学与化工,2016(41):88-94)制备得到。 本发明另一方面提供一种上述醛缩酶、转醛醇酶或其同工酶、突变酶在制备Ara5P、AcP、乙酰磷酸盐、AcCoA和AcCoA衍生化合物中的应用。 本发明另一方面还提供一种表达上述醛缩酶、转醛醇酶或其同工酶、突变酶的微生物在制备Ara5P、AcP、乙酰磷酸盐、AcCoA和AcCoA衍生化
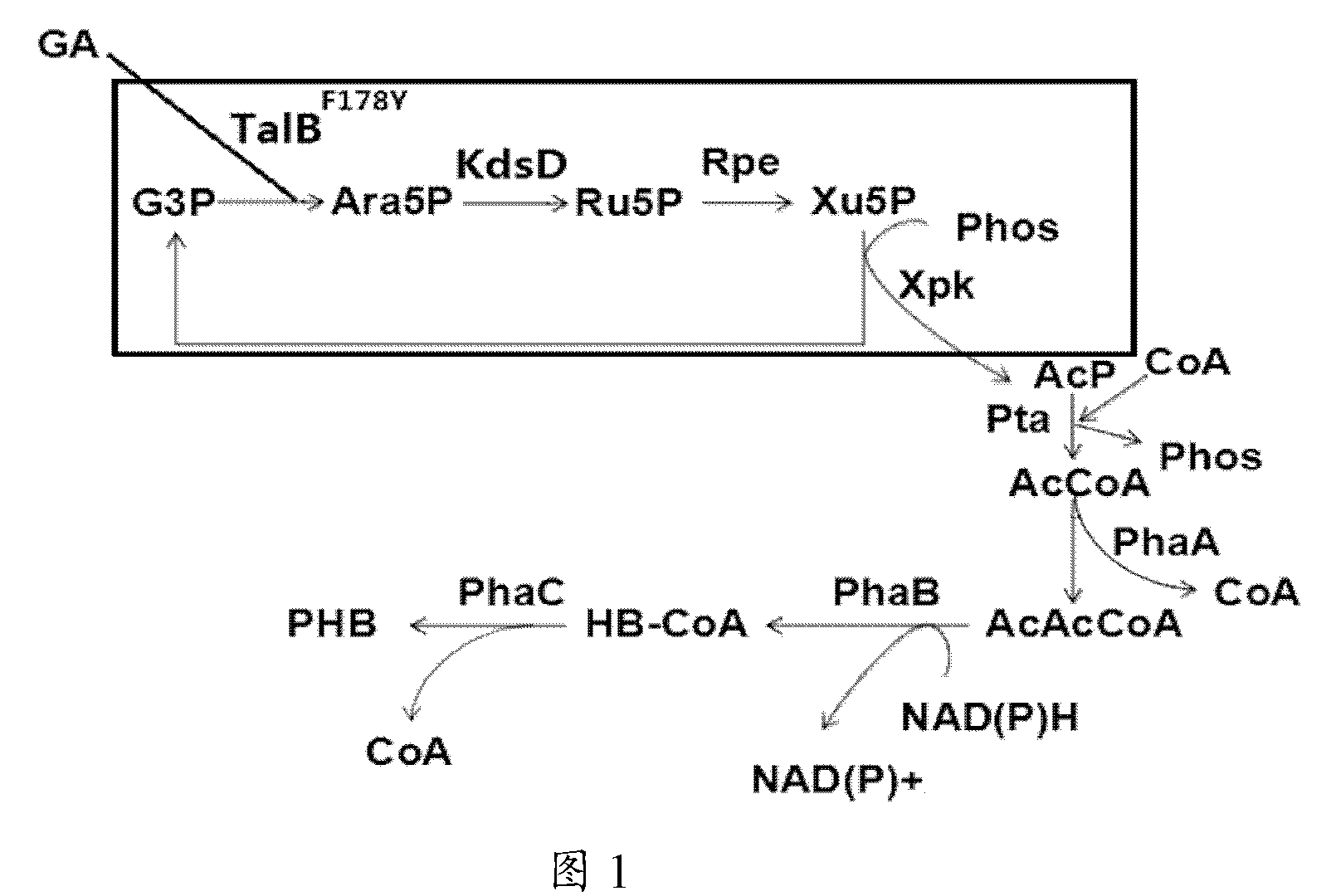
合物中的应用。 本发明涉及的酶可来自各种微生物来源及人工改造获得的同工酶、突变酶。 上述制备的反应通过微生物来进行,如反应中涉及的反应物中的一种或两种以上,和/或,酶的一种或两种以上可由微生物在线生产。 本发明提供的Ara5P的制备方法中醛缩酶或转醛醇酶不依赖于辅酶,催化效率较高(比酶活大于50U/mg),且醛缩酶及转醛醇酶的种类繁多,可优化空间很大。本发明中磷酸转酮酶的催化底物为5-磷酸木酮糖,是其最适底物,亲和力和比酶活很高(Km约为10-45mM,比酶活为90-800U/mg),并且作为最后一步反应,该催化过程不可逆,使体系不受反应平衡的限制,既可以拉动醛缩酶和转醛醇酶的速率,又可以最大限度地提高乙酰磷酸的收率及促进3-磷酸甘油醛的回补。提供的AcP的制备方法,催化速率较高,反应路线的碳理论得率为100%,没有碳损失,G3P和酶均可循环使用,反应效率较高,成本有所降低,另外,辅助酶RpiA(或KdsD)及Rpe,与底物亲和力强、稳定性好、催化活性高。上述制备方法的该方法在补料发酵、连续发酵等可控制底物水平的生产过程中会发挥更为明显的优势。 图1所示为本发明实施例1提供的生物合成途径示意图。 图2所示为本发明实施例6提供的GC-MS检测结果。 图3所示为本发明实施例7提供的GC-MS检测结果。 下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出
创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。 本发明的具体实施方式中涉及的利用乙醇醛生物合成乙酰磷酸的途径如图1所示,反应过程中涉及的反应物、中间体及酶的信息详见表1和2。 表1 本发明中涉及的代谢物信息表 表2 本发明中涉及的酶信息表 实施例1 乙醇醛为15mM的初始浓度下,在大肠杆菌Escherichia coli来源的Transaldolase TalB的突变酶TalBF178Y(在野生酶基础上第178位氨基酸残基由F突变为Y)作用下,添加5mM G3P,进行Ara5P的制备反应,反应1h后,将反应液冻干、衍生处理后,通过GC-MS定量检测到的Ara5P含量为2.5mM,Ara5P的平均合成速率为52.1μmol(Ara5P)/min/mg(酶蛋白)。 实施例2 乙醇醛在15mM的初始浓度下,ThDP浓度为1mM,PO43+浓度为2mM,加入Bifidobacterium adolescentis来源的Fpk(EC 4.1.2.22)、大肠杆菌来源的aldolase(Fsa,EC 4.1.2.13)、2mM G3P和微量的RpiA、Rpe,进行AcP的制备反应。经过检测,乙醇醛的转化速率为16.3μmol(乙醇醛)/min/mg(酶蛋白)。 以上数据为反应体系进行3h的平均速率。 实施例3 乙醇醛在15mM的初始浓度下,ThDP浓度为1mM,PO43+浓度为2mM,加入施氏假单胞菌Pseudomonas stutzeri A1501来源的Xpk(EC 4.1.2.9)、大肠杆菌Escherichia coli来源的Transaldolase(TalB,EC 2.2.1.2)的突变酶TalBF178Y、2mM G3P和微量的RpiA、Rpe,进行AcP的制备反应。经过检测,乙醇醛的转化速率为19.7μmol(乙醇醛)/min/mg(酶蛋白)。 以上数据为反应体系进行3h的平均速率。 实施例4
乙醇醛在20mM的初始浓度下,ThDP浓度为1mM,PO43+浓度为2mM,加入施氏假单胞菌Pseudomonas stutzeri A1501来源的Xpk、大肠杆菌Escherichia coli来源的Transaldolase(talB,EC 2.2.1.2)的突变酶TalBF178Y、4mM DHAP和微量的RpiA、Rpe、TpiA,进行AcP的制备反应。经过检测,乙醇醛的转化速率为26.5μmol(乙醇醛)/min/mg(酶蛋白)。 以上数据为反应体系进行3h的平均速率。 实施例5 将合成磷酸转酮酶的基因整合到大肠杆菌Escherichia coli K-12MG1655的基因组中,然后将含有用于合成聚3-羟基丁酸酯(PHB)的基因(PhaA、PhaB和PhaC)以及TalBF178Y的基因的质粒转入到上述菌株中,上述质粒选择IPTG诱导型启动子(其余需要的酶,在大肠杆菌中均已存在)。将上述菌株在LB培养基中进行培养,培养2.5h后,菌体OD600值达到0.8-1.0时,添加IPTG至终浓度0.5mM,诱导(22℃,6h)表达上述质粒上的目标酶蛋白。离心(4℃、8000r/min、5min)收集菌体后,用不添加碳源和氮源的M9培养基悬浮菌体后,重新离心收集菌体,此悬浮、离心过程重复三次,用于除去菌体中残留的碳源。将最终收集的菌体以上述M9培养基重新悬浮后,均分3份,分别添加0.02g、0.45g、0.9g乙醇醛(菌体中含有中间代谢物G3P,不需做额外添加),以上述M9培养基统一定容至30mL,发酵20h,观察发酵过程中细胞生长情况,发酵结束后收集菌体并检测发酵液中PHB含量。 PHB的检测:将发酵液离心获得菌体后,冻干称重。利用体积比1:1的氯仿及酯化液(主要成分为甲醇)混合液4mL在100℃下对菌体冻干粉衍生4h,然后添加2mL超纯水,静置分层后,除去甲醇及细胞碎片等,取下层的3-羟基丁酸甲酯氯仿溶液,利用气质联用仪GC-MS对氯仿中的3-羟基丁酸甲酯进行定量检测。 实验结果:在上述发酵过程中,菌体可以进行正常的生长、繁殖;发酵结束后,相应的菌体干重分别为0.025g、0.076g、0.131g;经与标准品比对,测
得样品中3-羟基丁酸的总含量分别为0.005g、0.066g、0.089g,碳源转化率在10%-20%之间。结果表明,菌体可以利用乙醇醛和自身含有的G3P、酶进行乙酰磷酸、乙酰辅酶A的合成,并继续生成乙酰辅酶A的衍生物PHB用于自身的碳源储备,乙醇醛在发酵过程中未表现出明显的细胞毒性,并可维持菌体正常的代谢消耗。 实施例6 采用不同途径制备乙酰磷酸和AcCoA,反应2h,反应结束后检测Ara5P和AcCoA的含量,AcCoA的含量也可间接表示乙酰磷酸的合成量,反应物、酶及其添加量如表3所示。 Ara5P的检测:取50μL反应液,将反应液冻干后,利用30μL甲氧胺盐酸盐和90μL三甲基硅基三氟乙酰胺分别衍生1h后,衍生温度为37℃,利用GC-MS检测Ara5P含量。 AcCoA的检测:取50μL反应液,经10%的硫酸溶液终止反应后,用0.22μm的滤膜除去杂质后,进行液相检测,流动相A为0.2M、pH=5的磷酸二氢钠溶液,流动相B为乙腈,AcCoA的最大吸收峰出现在254nm。 产物含量检测结果如表3所示。 表3结果表明,上述反应体系中不添加醛缩酶或转醛醇酶时,没有Ara5P生成,AcCoA的生成量也非常少,反应转化率非常低;上述反应体系中添加醛缩酶或转醛醇酶和G3P后,可生成Ara5P,且反应转化率较高;在同时添加RpiA和Rpe后,生成的Ara5P会在RpiA、Rpe和Fpk/Xpk作用下转化为乙酰磷酸,进一步被磷酸乙酰转移酶转化为AcCoA,且由Ara5P和AcCoA的检测结果可知,反应转化率非常高;在体系中同时添加DHAP和TpiA,替代G3P,也可获得与直接添加G3P相似的效果,达到较高的转化率。 表3 体系的物质添加和代谢物生成情况表 (反应物或产物浓度单位:mM;酶用量单位:μg) 备注:缓冲液中包含Tris、NaCl及MgCl2三种主要成分,pH 7.5,37℃,反应体系均为200μL。 另外,在含有反应物如GA、Phos、G3P、ThDP等的相同反应体系中,分别:A:不添加醛缩酶或转醛醇酶;B:添加TalBF178Y;C:添加TalBF178Y和F/Xpk;D:添加TalBF178Y、F/Xpk以及RpiA;E:添加TalBF178Y、F/Xpk以及RpiA和Rpe。GC-MS检测Ara5P含量,结果如图2中A-E图所示(Ara5P的出峰时间约为37min)。由图2中各图及其对应的反应条件可以看出,在仅添加醛缩酶时,Ara5P生成;在添加RpiA和Rpe时,生成的Ara5P被磷酸转酮酶较为彻底的分解。 实施例7 乙醇醛在15mM的初始浓度下,ThDP浓度为1mM,PO43+浓度为2mM,加入施氏假单胞菌Pseudomonas stutzeri A1501来源的Xpk(EC 4.1.2.9)、大肠杆菌Escherichia coli来源的Transaldolase(TalB,EC 2.2.1.2)的突变酶TalBF178Y、2mM G3P和微量的KdsD、Rpe,进行AcP的制备反应。反应2h后,检测到生成的AcP浓度为4.5mM。 另外,在含有反应物GA、Phos、G3P、ThDP等的相同反应体系中,分别:a:添加TalBF178Y;b:添加TalBF178Y、F/Xpk以及KdsD和Rpe。GC-MS检测Ara5P含量,结果如图3中a-b图所示。a图中,出峰时间为36.61min,36.89min和37.37min的三种物质分别为Ara5P,R5P和Ru5P,对应分子离子碎片依次如图3中的c-e所示。由图3中各图及其对应的反应条件可以看出,在添加KdsD
和Rpe时,生成的Ara5P被磷酸转酮酶完全分解。 以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换等,均应包含在本发明的保护范围之内。
Disclosed is a new approach for synthesizing an acetyl coenzyme A and a derivative product thereof (5-phosphoarabinose, acetyl phosphoric acid, acetyl phosphate, and an acetyl coenzyme A derivative compound) using glycolaldehyde. The approach comprises a reaction of glycolaldehyde and 3-phosphoglyceraldehyde under the catalysis of an enzyme to generate 5-phosphoarabinose, wherein the enzyme is selected from an aldolase, a transaldolase, an isoenzyme and a mutant enzyme thereof. 一种5-磷酸阿拉伯糖的制备方法,所述方法包括在酶催化下乙醇醛和3-磷酸甘油醛反应生成5-磷酸阿拉伯糖,所述的酶选自:醛缩酶、转醛醇酶、及其同工酶、突变酶; 优选的,所述的制备的反应是通过微生物来进行的。 如权利要求1所述的方法,其特征在于,所述的醛缩酶为果糖二磷酸醛缩酶(EC 4.1.2.13);和/或, 所述的转醛醇酶为大肠杆菌Escherichia coli来源的转醛醇酶(EC 2.2.1.2)的突变酶TalBF178Y。 如权利要求1或2所述的方法,其特征在于,所述乙醇醛是由甲醛制备得到的。 如权利要求1或2所述的方法,其特征在于,所述3-磷酸甘油醛由磷酸二羟基丙酮制备得到。 一种用于制备5-磷酸阿拉伯糖的组合物,包括: (1)乙醇醛, (2)3-磷酸甘油醛, (3)醛缩酶、转醛醇酶、或其同工酶、突变酶; 或, (1)乙醇醛, (2)3-磷酸甘油醛, (3)表达醛缩酶、转醛醇酶、或其同工酶、突变酶的微生物; 优选的,所述的醛缩酶为果糖二磷酸醛缩酶(EC 4.1.2.13);和/或, 所述的转醛醇酶为大肠杆菌Escherichia coli来源的转醛醇酶的突变酶TalBF178Y。 一种乙酰磷酸的制备方法,所述方法包括如权利要求1-4任一项所述的5-磷酸阿拉伯糖的制备方法;
优选的,所述的制备的反应是通过微生物来进行的。 如权利要求6所述的方法,其特征在于,所述的方法还包括5-磷酸阿拉伯糖转化为5-磷酸木酮糖再进一步转化为乙酰磷酸的步骤。 如权利要求7所述的方法,其特征在于,所述的5-磷酸阿拉伯糖转化为5-磷酸木酮糖的步骤包括5-磷酸阿拉伯糖转化为5-磷酸核酮糖再进一步转化为5-磷酸木酮糖的步骤;和/或, 所述的5-磷酸木酮糖转化为乙酰磷酸的反应包括5-磷酸木酮糖和磷酸在磷酸转酮酶催化下生成乙酰磷酸的步骤。 如权利要求8所述的方法,其特征在于,所述的磷酸转酮酶为磷酸转酮酶(EC 4.1.2.9)或果糖-6-磷酸磷酸转酮酶(EC 4.1.2.22)。 一种用于制备乙酰磷酸的组合物,包括如权利要求5所述的用于制备5-磷酸阿拉伯糖的组合物。 如权利要求10所述的组合物,其特征在于,所述组合物还包括磷酸、磷酸转酮酶,优选的,所述组合物还包括磷酸转酮酶辅酶;和/或, 所述组合物还包括可催化5-磷酸阿拉伯糖生成5-磷酸木酮糖的酶。 如权利要求11所述的组合物,其特征在于,所述组合物包括: (1)乙醇醛, (2)3-磷酸甘油醛, (3)醛缩酶、转醛醇酶、或其同工酶、突变酶, (4)核糖-5-磷酸异构酶或阿拉伯糖-5-磷酸异构酶, (5)核酮糖-磷酸3-异构酶, (6)磷酸、磷酸转酮酶、辅酶; 优选的,所述的醛缩酶为果糖二磷酸醛缩酶(EC 4.1.2.13);和/或, 所述的转醛醇酶为大肠杆菌Escherichia coli来源的转醛醇酶的突变酶TalBF178Y;和/或, 所述的磷酸转酮酶为磷酸转酮酶(EC 4.1.2.9)或果糖-6-磷酸磷酸转酮
酶(EC 4.1.2.22)。 一种乙酰磷酸盐的制备方法,所述方法包括如权利要求1-4任一项所述的5-磷酸阿拉伯糖的制备方法或如权利要求6-9任一项所述的乙酰磷酸的制备方法,优选的,所述的乙酰磷酸盐包括:乙酰磷酸二锂盐、乙酰磷酸二钠盐和乙酰磷酸二铵盐。 一种乙酰辅酶A的制备方法,所述方法包括如权利要求1-4任一项所述的5-磷酸阿拉伯糖的制备方法或如权利要求6-9任一项所述的乙酰磷酸的制备方法; 优选的,所述的制备的反应是通过微生物来进行的。 一种乙酰辅酶A衍生化合物的制备方法,所述方法包括如权利要求1-4任一项所述的5-磷酸阿拉伯糖的制备方法或如权利要求6-9任一项所述的乙酰磷酸的制备方法或如权利要求14所述的乙酰辅酶A的制备方法, 优选的,所述的乙酰辅酶A衍生化合物选自:丙酮、异丙醇、乙酸、L-谷氨酸、L-谷氨酰胺、L-脯氨酸、L-精氨酸、L-亮氨酸、L-半胱氨酸、琥珀酸酯和聚羟基脂肪酸酯; 更优选的,所述的乙酰辅酶A衍生化合物为聚3-羟基丁酸酯; 优选的,所述的制备的反应是通过微生物来进行的。 一种醛缩酶、转醛醇酶或其同工酶、突变酶,或,表达醛缩酶、转醛醇酶或其同工酶、突变酶的微生物在制备5-磷酸阿拉伯糖、乙酰磷酸、乙酰磷酸盐、乙酰辅酶A或乙酰辅酶A衍生化合物中的应用。
技术领域
背景技术
附图说明
具体实施方式