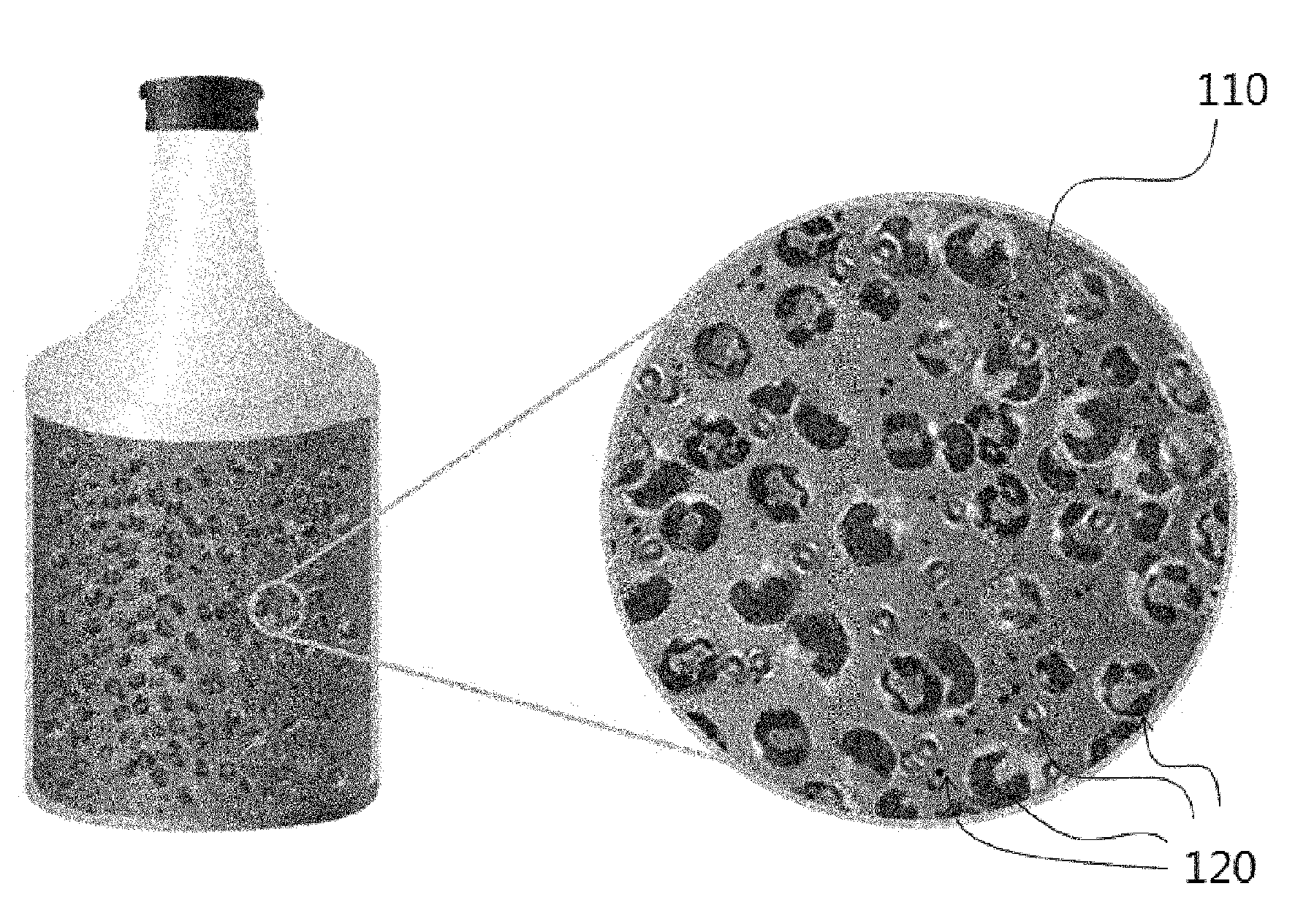METHOD FOR DISTINGUISHING PARTICULAR CELLS FROM MIXTURE OF HETEROGENEOUS CELLS
본 명세서에 개시된 기술은 이종 세포들의 혼합물로부터 특정 세포를 구별하는 방법에 관한 것이다. 자연 환경과 인체 내에는 여러 가지 세포가 혼합된 수계 액체(water-based liquid)가 존재한다. 예를 들어 강이나 바다와 같은 곳에서 채취할 수 있는 수계 액체 샘플의 경우 수많은 종류의 미생물들이 혼합되어 있다. 또한 인체 내에 존재하는 혈액의 경우 적혈구, 백혈구, 혈소판으로 이루어진 혈구 세포가 기본적으로 포함되며 특별한 경우에 순환 종양 세포(Circulating Tumor Cell)가 함께 존재하거나1, 말라리아와 같은 원충, 세균 또는 바이러스에 의해 감염된 적혈구가 함께 존재할 수 있다. 자연 환경 유래 샘플이나 인체 유래 샘플 내 존재하는 각종 이종 세포들로부터 순환 종양 세포나 세균 등의 특정 세포를 구별하는 것은 그 샘플의 상태를 진단하거나 환자의 병리학적 상태를 파악하는 데 필수적으로 필요하다. 이종 세포들의 혼합물을 함유한 샘플에서 특정 세포가 있는지 확인하는 방법에는 분자 유전학적인 방법이 있다. 이는 특정 세포만 가진 유전자를 증폭하는 프라이머(primer)를 제작하여서 중합효소 연쇄 반응(polymerase chain reaction, PCR)을 시켜서 세포의 유무를 확인하는 것이다2. 또는 이종 세포들의 혼합물을 함유한 샘플을 슬라이드 글라스에 도말한 뒤에 특정 세포만 염색을 한 뒤에 현미경으로 관찰하는 방식이 있다3. 기타 특정 세포의 표면에 특이적으로 붙는 형광 물질을 이용하여 유세포 분석기(flow cytometry)를 이용하는 방식이 있다4. 이와 다르게 미세 유체 상에서 세포 간의 크기나 밀도, 변형의 정도 차이를 이용해서 분리하는 방식도 존재한다5. 그러나 분자 유전학적인 방법과 도말을 하는 방법은 모두 세포를 사멸시킨 다음에 가능한 방식이고 고가의 PCR 장비와 고배율의 현미경 장비를 필요로 한다. 유세포 분석기를 이용한 방식의 경우도 고가의 장비가 필요하다. 미세 유체에서 세포의 크기나, 밀도, 변형의 정도 차이를 이용하는 방법은 그 차이가 미비한 경우 사용할 수가 없다는 결정적인 한계가 있다. 따라서 이종 세포들의 혼합물을 함유한 샘플에서 특정 세포가 있는지 확인하기 위한 좀 더 효율적인 방법이 요구된다. [관련 선행 논문] 1. V. Plaks, C. D. Koopman, Z. Werb, Circulating Tumor Cells, Science, Vol. 341, No. 6151, p. 1186-1188, 2013. 2. A. Moody, Rapid Diagnostic Tests for Malaria Parasites, Clinical Microbiology Reviews, Vol. 15, No. 1, p. 66-78, 2002. 3. M. A. Jensen, J. A. Webster, N. Straus, Rapid Identification of Bacteria on the Basis of Polymerase Chain Reaction-Amplified Ribosomal DNA Spacer Polymorphisms, Applied and Environmental Microbiology, Vol. 59, No. 4, p. 945-952, 1993. 4. K. Czechowska, D. R. Johnson, J. R. van der Meer, Use of Flow Cytometric Methods for Single-Cell Analysis in Environmental Microbiology, Current Opinion in Microbiology, Vol. 11, No. 3, p. 205-212, 2008. H. T. K. Tse, D. R. Gossett, Y. S. Moon, M. Masaeli, M. Sohsman, Y. Ying, K. Mislick, R. P. Adams, J. Rao, D. Di Carlo, Quantitative Diagnosis of Malignant Pleural Effusions by Single-Cell Mechanophenotyping, Science Translational Medicine, Vol. 5, No. 212, p. 212ra163, 2013. 본 발명의 일 측면에 의하면, (a) 이종 세포들의 혼합물을 함유한 수계 액체의 샘플을 제공하는 단계; (b) 상기 샘플 중 적어도 일부의 양을 채취하여 다공성 매질에 넣어 고정시키는 단계; (c) 상기 이종 세포들의 혼합물 중 특정 세포만 성장하게 하는 생리활성 자극을 상기 다공성 매질에 인가하여 상기 특정 세포를 배양하는 단계; 및 (d) 현미경 이미징을 통해서 상기 특정 세포를 다른 종류의 세포들과 구별하는 단계를 포함하는 이종 세포들의 혼합물로부터 특정 세포를 구별하는 방법이 제공된다. 도 1은 본 발명의 일 구현예에 따른 이종 세포들이 혼합되어 있는 샘플을 나타낸 것이다. 도 2는 본 발명의 일 구현예에 따른 다공성 매질에 고정된 이종 세포들을 나타낸 것이다. 도 3은 본 발명의 일 구현예에 따른 특정 세포만 반응하도록 선택적인 생리 활성 자극을 인가하는 단계를 나타낸 것이다. 도 4는 본 발명의 일 구현예에 따른 선택적 자극에 의해서 배양된 특정세포의 군집을 현미경으로 관찰하는 단계를 나타낸 것이다. 도 5는 본 발명자들은 자연 환경과 인체 내에서 유래된 다양한 세포가 혼합된 수계 액체상태의 샘플에서 특정 세포를 구별하는 방법을 개발하였다. 본 발명에서는 이종 세포들이 혼합된 상태에서 특정 세포를 구별하기 위해서 이들 세포들을 다공성 물질 속에 고정을 시킨 후에 구별하기를 원하는 특정 세포만 선택적으로 성장하게 하는 생리활성 자극을 가한 다음 상기 특정 세포가 형성하는 마이크로콜로니(microcolony)를 현미경 관찰을 통해서 확인하는 방법을 제공한다. 처음에 이종 세포들이 있는 시료를 다공성 매질에 고정시켰을 경우에는 각 세포들의 성상이 구분되지 않아 특정 세포를 구별할 수 없지만, 상기 생리활성 자극에 의해 시간이 지나면서 특정 세포가 분열을 하여 마이크로콜로니를 형성하면 배경에 있는 크기 변화가 없는 다른 세포들과 구분되어 현미경 등을 통하여 시각적으로 확인할 수 있다. 본 발명의 일 구현예에 있어서, 혈액에 암세포가 혼합되어 있는 경우 혈구 세포의 수에 비해 암세포는 극소수로만 존재한다. 이 경우 암세포의 존재를 확인하기 위해서 암세포만 분열을 하게 하는 사람의 상피 세포 배지의 도입을 생리활성 자극으로 이용할 수 있다. 그러면 상기 생리활성 자극에 의해 암세포는 분열을 하게 되고 혈구 세포는 분열하지 않으므로, 일정 시간이 지난 뒤 현미경으로 관찰하면 암세포의 존재 유무를 확인할 수 있다. 본 발명의 다른 구현예에 있어서, 혈액 속에 세균이 존재하는 경우, 혈구 세포의 크기는 7~15 ㎛ 정도이고 세균의 크기는 1~2 ㎛이기 때문에 처음에는 세균을 구별하기 어렵다. 그러나 세균만 분열할 수 있는 배지를 넣어 주게 되면 세균은 평균적으로 30분에 한 번씩 분열하게 되고 수 시간이 지나면 혈구 세포보다 더 큰 세포 군집을 형성하므로 시각적으로 관찰할 수 있다. 이하 도면을 통해 본 발명의 다양한 구현예들을 좀더 구체적으로 상세히 설명한다. 도 1은 본 발명의 일 구현예에 따른 이종 세포들이 혼합되어 있는 샘플을 나타낸 것이다. 상기 샘플은 수계 액체(110)의 형태로 제공될 수 있다. 이종 세포들(120)의 종류는 원핵세포 또는 진핵 세포 모두가 될 수 있으며, 예를 들어 포유류 세포, 종양세포, 혈구 세포, 원핵생물(세균, 남색세균, 고세균), 사상균, 효모, 변형균, 담자균, 단세포성의 조류 또는 원생동물 등이 될 수 있다. 상기 샘플에는 질병의 원인이 되는 미생물들이 포함될 수 있으며, 바이러스, 리케차(rickettsia), 세균(구균, 간균, 나선균, 방선균), 진균 또는 원충 등이 포함될 수 있다. 이종 세포들(120)을 포함하는 샘플은 인체, 동물체, 식물체 등의 생체 내에서 유래할 수 있고, 바닷물, 강물, 폐수, 토양 등의 다양한 자연 환경에서 유래할 수도 있다. 상기 샘플이 생체 내에서 유래한 것일 경우, 이종 세포들(120)은 혈액, 고름 및 분비액에 함유된 다양한 세포들일 수 있다. 도 2는 본 발명의 일 구현예에 따른 다공성 매질에 고정된 이종 세포들(220)을 나타낸 것이다. 이종 세포들(220)을 포함하는 다공성 매질(210)은 액상에서 고상으로 되는 물질을 이용할 수 있다. 즉 이종 세포들(220)이 마이크로웰과 같은 용기(230) 내에서 액상 매질에 분산된 후 적절한 물리적 또는 화학적 환경 변화 하에서 겔화되어 고정될 수 있다. 예를 들어 상기 액상 매질은 약 95% 이상의 물을 포함할 수 있으며 이에 포함된 고형화 물질의 존재에 의해 고체화될 수 있다. 일 예로 액상 매질 내에는 상기 고형화 물질이 0.5 내지 4 중량%가 사용될 수 있다. 바람직하게는 상기 고형화 물질로서 한천 또는 아가로즈가 사용될 수 있다. 다공성 매질(210)은 하이드로젤(hydrogel)이나 기공을 가진 멤브레인(porous membrane) 등의 재질일 수 있다. 상기 하이드로젤은 천연 또는 합성 고분자 물질일 수 있다. 상기 하이드로젤은 콜라젠(collagen), 피브린(fibrin), 아가로즈(agarose), 한천(agar), 마트리젤(matrigel), 알지네이트(alginate), 젤라틴(gelatin) 등을 포함할 수 있다. 이러한 다공성 매질(210)은 처음에 액상이었다가 다양한 조건에 의해서 고형화될 수 있는데 그 조건은 온도, 빛, pH, 압력, 진동 등을 포함한다. 예를 들어 고온에서 액상인 다공성 매질이 저온에서 겔화될 수 있다. 생체 또는 자연 환경으로부터 채취된 샘플은 생리활성 자극의 인가 전에 별도의 배양 또는 정제 과정을 생략할 수 있다. 특히 채취된 샘플에 대해 순수 배양(pure culture) 단계를 생략하고 곧바로 고형화 물질과 혼합하여 고형화시킬 수 있다. 상기 샘플은 예를 들어 혈액 배양 양성 (positive blood culture) 샘플일 수 있다. 이 경우 각종 혈구 세포들과 박테리아가 다공성 매질에 함께 고정될 수 있다. 샘플링 후 16시간 내지 24시간 정도 걸리던 별도의 순수 배양과정을 생략함으로써 특정 세포를 검출하는 시간이 매우 단축될 수 있다. 더 나아가 생체 또는 자연 환경으로부터 채취된 샘플의 경우 균수를 늘리기 위한 배양 과정이 1~2일 정도 소요되는데, 샘플의 종류에 따라 이 과정을 생략하여도 관찰이 용이한 정도의 특정 세포 농도를 갖는 샘플일 경우라면 상기 배양 과정의 생략이 가능하다. 다공성 매질(210) 내에 이종 세포들(220)을 고정하였을 때 원하는 특정 세포들의 농도는 예를 들어 103 내지 105 CFU/ml 인 것이 추후 관찰 면에서 용이하다. 이 경우 샘플 채취 후 수 시간 내에 원하는 결과를 얻을 수 있으므로 분석시간이 매우 단축되는 장점이 있다. 상기 샘플 내의 다양한 세포들은 상기 고형화된 다공성 매질(210)이 가진 공극 내에 들어가면서 고정될 수 있다. 즉 다공성 매질(210)에의 고정은 액체 상태의 다공성 매질(210) 내에 분산된 이종 세포들(220)이 다공성 매질(210)의 겔화 과정을 통해 다공성 매질(210)의 매트릭스 내에 3차원적으로 고정되는 것이다. 그리하여 액상 매질 내에서는 운동성이 있는 세포들이 겔화 과정을 통해 특정 위치에 고정되므로 관찰 영역 내에서 세포 별로 고정된 위치를 중심으로 각 세포들의 변화를 현미경으로 용이하게 관찰할 수 있게 된다. 다공성 매질(210) 내 공극의 크기는 1nm 내지 수 mm일 수 있다. 상기 공극의 존재로 다양한 이종 세포들(220)이 각각 용이하게 고정될 수 있다. 세포의 크기를 고려할 때 상기 공극의 크기는 바람직하게는 1 내지 100 ㎛일 수 있다. 상기 고형화된 다공성 매질(210)의 형태를 갖는 다공성 매트릭스의 두께는 상기 고정된 이종 세포들의 군집을 현미경을 통하여 관찰할 수 있을 정도면 특별히 제한되지 않는다. 예를 들어 수 ㎛ 내지 수 mm의 범위를 가질 수 있다. 상기 샘플과 고정화제의 혼합물을 형성한 후 배양 배지를 공급하며 배양하는 단계를 더 포함할 수 있다. 도 3은 본 발명의 일 구현예에 따른 특정 세포만 반응하도록 선택적인 생리 활성 자극을 인가하는 단계를 나타낸 것이다. 선택적인 생리활성 자극(310)은 특정 유전자를 발현시키는 유전 물질, 특정 세포만 선택적으로 자라게 하는 배지, 특정 레이저 파장, 특정 온도, 특정 압력, 특정 화학 물질 및 특정 세포로 이루어진 군 중에서 선택되는 1종 이상을 포함한다. 상기 자극(310)은 지속적으로 가할 수도 있고 시간에 따라 간헐적으로 가할 수도 있다. 상기 자극(310)은 상기 샘플 내의 이종 세포들 일부 또는 전부에 가해질 수 있으며, 바람직하게는 이종 세포들 모두에 가해질 수 있다. 생리활성 자극(310)에 의해 특정한 종류의 세포(320)만이 선택적으로 성장하게 된다. 몇몇 구현예에서 상기 생리활성 자극 이외에 다른 종류의 생리활성 자극을 추가적으로 상기 다공성 매질에 인가할 수 있다. 상기 추가적 생리활성 자극은 원래의 처음의 자극과 동시에 또는 이후에 인가될 수 있다. 예를 들어 특정 세포를 성장시킬 수 있는 영양 배지를 생리활성 자극으로 인가함과 동시에 상기 특정 세포의 성장을 막는 약물을 상기 추가적 생리활성 자극으로 인가하여 상기 특정 세포의 성장을 관찰할 경우 약물에 대한 감수성을 검사할 수 있다. 도 4는 본 발명의 일 구현예에 따른 선택적 자극에 의해서 배양된 특정세포의 군집을 현미경으로 관찰하는 단계를 나타낸 것이다. 상기 선택적 생리활성 자극에 의해서 세포는 분열을 하게 된다. 분열된 세포는 고정된 상태에서 분열을 하였기 때문에 처음 크기보다 큰 군집을 형성한다. 이것을 현미경(410)으로 관찰하여 크기 변화를 통해 생리활성 자극에 선택적으로 반응한 세포를 구별할 수 있다. 즉 상기 특정 세포의 구별 과정은 상기 특정 세포의 분열에 의해 마이크로콜로니(420)가 형성됨을 관찰하여 수행될 수 있다. 상기 현미경 이미징은 구별하기 원하는 세포의 마이크로콜로니(420)를 관측 가능한 배율에서 수행한다. 통상 세균의 크기가 1~2 ㎛이라 할 때 상기 세균이 수십 내지 수백 개 모이면 관측 가능한 크기가 될 수 있다. 관측 가능한 마이크로콜로니(420)의 크기는 10 ㎛ 이상, 바람직하게는 20 ㎛ 이상, 더욱 바람직하게는 30 ㎛, 더더욱 바람직하게는 50 ㎛ 이상일 수 있다. 마이크로콜로니(420)의 관측 가능한 성장 시간을 고려하면 통상적으로 2 시간 이상, 바람직하게는 3시간 내지 5시간 정도면 특정 세포를 신속하게 구별할 수 있다. 마이크로콜로니(420)의 존재를 명시야 또는 암시야에서 관찰할 수 있으며 바람직하게는 명시야에서 관찰할 수 있다. 상기 세포들은 다공성 매질 내에 공간적으로 고정되어 있으므로, 전 영역을 시간별로 영상화하는 경우 세포의 성장, 분열과 같은 시계열적 변화를 추적할 수 있다. 상기 현미경 이미징은 관찰 영역을 배양 시간별로 영상화함으로써 상기 관찰 영역 내에 존재하는 상기 이종 세포들의 점유 면적의 변화를 시계열적으로 추적하여 수행하는 것일 수 있다. 영상화 과정은 현미경(410)으로 관찰시 CCD(Charge Coupled Device) 방식 또는 CMOS(Complementary Metal Oxide Semiconductor) 방식의 카메라를 사용하여 이미지를 얻고 이를 코드화된 프로그램에 의해 디지털 데이터로 변환하는 방식일 수 있다. 본 발명에서 제공하는 이종 세포들의 혼합 샘플에서 특정 세포를 구별하는 방법은 여러 가지 용도로 쓰일 수 있다. 환경에서 채취할 수 있는 시료에서 특정 미생물을 확인하게 되면 그 시료의 오염 정도를 확인할 수 있다. 혈액에서 특정 세균이 있는지 확인하는 방법은 환자의 혈액에서 균의 존재 유무를 빠르게 확인하여 신속하게 처방하는 데 도움이 된다. 또한 혈액 내에 극히 적은 수로 존재 하는 순환 종양 세포를 빠른 시간 내에 고감도로 확인하여 환자의 항암치료의 예후 관측이나 전이 정도를 확인할 수 있다. 또한, 항암제, 항생제 등을 처리하여 관찰할 경우 적합한 치료제를 신속하게 검색할 수 있다. 또한, 특정 유전자를 가진 세포를 확인할 수 있어서 암의 진단이나 돌연변이를 빠른 시간 내에 확인할 수 있다. 이하 실시예를 들어 본 발명을 좀 더 상세히 설명하고자 하나 본 발명의 기술적 사상이 이에 의해 제한되는 것은 아니다. [실시예] 박테리아 감염된 혈액 샘플로부터 박테리아 구별실험 이미지 데이터들은 C++로 코드화된 프로그램에 의해 디지털 데이터로 변환되었다. RGB 형식의 가공하지 않은 이미지 데이터를 그레이 형식으로 바꾼 다음 배경 데이터를 지워 노이즈 없이 선명한 데이터를 얻었다. 다음 콘트라스트를 증가시켜 이미지를 이진 형식이 되도록 하였다. C++ 프로그램은 초기 이미지와 4시간 후 배양 후 이미지에서 변화된 부분을 검출한다. 최초 물체가 검출되지 않았던 영역에서 새로운 물체가 검출되거나 최초 검출 시보다 크기가 커진 물체를 검출하여 박테리아 세포로 인식한다. 도 5는 The present invention relates to a method for distinguishing particular cells from a sample having mixed heterogeneous cells. The sample having mixed heterogeneous cells is fixed in a porous material, and then a selective physiologically active stimulus, to which only particular cells respond, is given. Thereafter, the formation of clusters of the particular cells, which respond and divide by the selective stimulus, can be observed through a microscope. Through the present invention, the presence or absence of circulating tumor cells existing in the blood can be confirmed, and the existence of cells having a specific gene as well as the existence of bacteria in the blood can be conveniently observed. (a) 이종 세포들의 혼합물을 함유한 수계 액체의 샘플을 제공하는 단계; (b) 상기 샘플 중 적어도 일부의 양을 채취하여 다공성 매질에 넣어 고정시키는 단계; (c) 상기 이종 세포들의 혼합물 중 특정 세포만 성장하게 하는 생리활성 자극을 상기 다공성 매질에 인가하여 상기 특정 세포를 배양하는 단계; 및 (d) 현미경 이미징을 통해서 상기 특정 세포를 다른 종류의 세포들과 구별하는 단계를 포함하는 이종 세포들의 혼합물로부터 특정 세포를 구별하는 방법. 제 1항에 있어서, 상기 이종 세포들은 생체 내 또는 자연 환경에서 유래된 것인 특정 세포를 구별하는 방법. 제 1항에 있어서, 상기 다공성 매질에의 고정은 액체 상태의 상기 다공성 매질 내에 분산된 상기 이종 세포들이 상기 다공성 매질의 겔화 과정을 통해 상기 다공성 매질의 매트릭스 내에 3차원적으로 고정되는 것인 이종 세포들의 혼합물로부터 특정 세포를 구별하는 방법. 제 1항에 있어서, 상기 샘플 제공 후 상기 생리활성 자극의 인가 전에 상기 이종 세포들에 대한 별도의 배양 또는 정제 과정이 생략된 것인 이종 세포들의 혼합물로부터 특정 세포를 구별하는 방법. 제 1항에 있어서, 상기 특정 세포의 구별 과정은 상기 특정 세포의 분열에 의해 마이크로콜로니가 형성됨을 관찰하여 수행되는 것인 이종 세포들의 혼합물로부터 특정 세포를 구별하는 방법. 제 5항에 있어서, 상기 현미경 이미징은 상기 마이크로콜로니를 관측 가능한 배율에서 수행하는 것인 이종 세포들의 혼합물로부터 특정 세포를 구별하는 방법. 제 1항에 있어서, 상기 현미경 이미징은 관찰 영역을 배양 시간별로 영상화함으로써 상기 관찰 영역 내에 존재하는 상기 이종 세포들의 점유 면적의 변화를 시계열적으로 추적하여 수행하는 것인 이종 세포들의 혼합물로부터 특정 세포를 구별하는 방법. 제 3항에 있어서, 상기 (c) 단계에서 상기 생리활성 자극과 다른 종류의 생리활성 자극을 추가적으로 상기 다공성 매질에 인가하는 단계를 더 포함하는 이종 세포들의 혼합물로부터 특정 세포를 구별하는 방법.