JANUS KINASE (JAK) FAMILY INHIBITOR, PREPARATION OF SAME, AND APPLICATIONS THEREOF
本申请属于医药技术领域,具体涉及7-氮杂吲哚衍生物及其用于制备抗炎药物的用途。 两面神激酶(JAK)是一类酪氨酸激酶,包括JAK1、JAK2、JAK3和TYK2四个成员。JAKs在多种细胞因子的信号传导过程中发挥重要作用,与其下游的信号转导和转录激活子(STAT)一起介导细胞因子受体对核内基因转录和表达的调控。 细胞因子与其受体结合,引起受体分子的二聚化,与受体偶联的JAKs相互接近并通过交互的酪氨酸残基磷酸化作用而活化。活化的JAKs催化受体本身的酪氨酸残基磷酸化,形成相应的STATs与受体复合物结合的位点。STATs通过其SH2结构域与受体分子上的磷酸酪氨酸残基结合,并在JAKs的作用下实现其C端酪氨酸残基的磷酸化。两个磷酸化的STAT分子相互作用形成同/异源二聚体离开受体分子进入细胞核,与目的基因的启动子区域结合,调节基因的转录和表达(J.Biol Chem.2007,282,20059)。 JAK/STAT系统是免疫活性细胞中的细胞因子的最主要的细胞内信号传导系统,通过4种JAK与7种STAT的组合,能进行约40种细胞因子的信号传导(Immunol Rev.2009,228,273)。JAK3能与细胞因子受体共有的γ链(Fcγ)特异性结合,JAK1则与beta链相结合,两者共同为IL-2、IL-4、IL-7、IL-9、IL-15和IL-21细胞因子所激活(Immunol.Rev.2009,228,273)。某些重要的炎症相关细胞因子如IL-6,只通过JAK1传导信号(EMBO J.1995,14,1421),IL-6单抗如tocilizumab已被证明是有效的类风湿性关节炎(RA)治疗药物(Arthritis Rheum.2006,54,2817),因此JAK1是理想的抗炎靶点。JAK2在促红细胞生成素(EPO)信号通路中起到重要作用,包括促红细胞分化和激活STAT5。此外,JAK2还与脂代谢通路相关(Obesity.2008,16,492)。JAK1、JAK2及TYK2广泛存在于各种组织和细胞中,而JAK3主要分布于淋巴细胞中,过度抑制会提高感染的风险。细胞因子产生的异常和细胞因子信号传导的异常不仅与自身免疫性疾病、过敏等各种免疫疾病和炎症疾病有关,而且与癌症等具有多种不同病理的疾病有很大关联。许多异常的免疫应答,如过敏、哮喘、(异体)移植排斥、类风湿性关节炎、肌萎縮性脊髓侧索硬化症和多发性硬化症等自身免疫性疾病,骨髓增生失调,白血病和淋巴瘤等血液系统恶性肿瘤,它们的调节都与JAK/STAT信号通路有关。 Tofatinib是首个上市的口服JAK抑制剂,但因为其是泛JAK抑制剂,选择性不好,抑制JAK1的同时抑制JAK2、JAK3,在临床上表现出较大的副作用,包括贫血和感染,影响的临床使用剂量和最终疗效(Transplantation.2005,79,791;Annals of the Rheumatic Diseases.2016, 75,1133.)。JAK1/JAK2抑制剂Baricitinib在临床试验中显示优于Humira(adalimumab)的抗炎疗效,但有明显的升高血脂副作用(Ann Rheum Dis.2018,77,988.),因而只被FDA批准低剂量版本制剂上市。选择性JAK1抑制ABT-494在临床试验中也表现出优异的抗炎疗效,但其仍有升高低密度脂蛋白(LDL)的临床风险(Arthritis&Rheumatology.2016,68,2857)。因此,开发选择性更好的JAK抑制剂仍具有重要的临床意义。 Tyk2也是JAK激酶家族成员,是重要的免疫调控位点,参与IFN-α,IL-6,IL-10、IL-12、IL-23信号通路的传导,可以磷酸化IL-12、IL-23和I型干扰素受体下游的STAT蛋白,传导炎症信号。上述炎症因子与多种自身免疫疾病发生相关,包括系统性红斑狼疮(SLE)、银屑病(PSO)、炎性肠病(IBD)等,因此Tyk2也是重要的炎症疾病治疗靶点。目前已有数个Tyk2抑制剂进入系统性红斑狼疮、银屑病、炎性肠病、斑秃的临床试验研究(J.Med.Chem.2018,61,8597;J.Med.Chem.,2018,61,8594)。 WO2018169700、WO2016116025公开了JAK抑制剂的化合物,但本发明化合物与其结构不同,且本发明化合物对JAK1的抑制活性总体上优于WO2018169700和WO2016116025专利中的化合物。 发明内容 本发明的目的是提供一种7-氮杂吲哚类JAK激酶家族抑制剂。 本发明的另一个目的是提供选择性好的JAK激酶家族抑制剂在制备预防或治疗JAK激酶家族相关疾病药物的用途。为实现本发明的目的,本发明的技术方案如下: 本发明所述的如下式(I)所示的化合物、其立体异构体或其药学上可接受盐: 其中,环A选自任选被取代的4~12元杂环基或5~10元杂芳基; R1选自H、羟基、任选被取代的C1-C8烷基、C3-C8环烷基、C2-C8烯基、C2-C8炔基、4~12元杂环基、6~10元芳基或5~10元杂芳基;
R2选自氰基、-C=ONR6R7、-C=ONR6NR7R8、-C=ONHOR6、-S(O)mR8、-S(O)m-NHR8、或-C=OOR6;
L选自氨基、-NR6C=O-、-NR6C=ONR10-、-C=ONR10-、-C=ONR6O-、-C=ONR6NR10-、-NR6S(O)m-、-S(O)mNR6-、-NR6S(O)mNR7-、-S(O)m-、-C=O-或-C=OO-;或者,L不存在;
R3选自H、任选被取代的C1-C8烷基、C3-C8环烷基或C=OR6;
R4和R5各自独立地选自H、氘、卤素、氰基、硝基、任选被取代的C1-C8烷基、C3-C8环烷基、6~10元芳基或5~10元杂芳基;
R6、R7和R10各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
或者,R10与其相连的N及R1可形成一个任选被取代的4~12元杂环基;
其中,所述的环A和R1中取代基团各自独立地选自一个或多个卤素、羟基、氰基、氨基、巯基、硝基、C1-C8烷基、C1-C8烷氧基、C3-C8环烷基、4~12元杂环基、6~10元芳基、5~10元杂芳基、-(CH2)nC=OOR8、-OC=OR8、-C=OR8、-C=ONR8R9、-NHC=OR8、-NR8R9、-OC=ONR8R9、-NHC=ONR8R9、-S(O)mR8、-S(O)m-NHR8、-NHC=OOR8或-NHS(O)mR8;
m选自1或2; n选自1、2、3、4或5; R8和R9各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
所述的R3、R4、R5、R6、R7、R8、R9和R10中取代基团各自独立地选自一个或多个氘、卤素、羟基、氰基、氨基、巯基、硝基、C1-C8烷基、C1-C8烷氧基或C3-C8环烷基。
本发明一些实施方案,环A选自任选被取代的4~12元杂环基; R1选自H、羟基、任选被取代的C1-C8烷基、C3-C8环烷基、C2-C8烯基、C2-C8炔基、4~12元杂环基、6~10元芳基或5~10元杂芳基;
R2选自氰基或-C=ONR6R7;
L选自氨基、-NR6C=O-、-NR6C=ONR10-、-C=ONR10-、-C=ONR6O-、-C=ONR6NR10-、-NR6S(O)m-、-S(O)mNR6-、-NR6S(O)mNR7-、-S(O)m-、-C=O-或-C=OO-;或者,L不存在;
R3选自H、任选被取代的C1-C8烷基、C3-C8环烷基或-C=OR6;
R4和R5各自独立地选自H、氘、卤素、氰基、硝基、任选被取代的C1-C8烷基或C3-C8环烷基;
R6、R7和R10各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
或者,R10与其相连的N及R1可形成一个任选被取代4~12元杂环基;
其中,所述的环A和R1中取代基团各自独立地选自一个或多个卤素、羟基、氰基、氨基、C1-C8烷基、C1-C8烷氧基、C3-C8环烷基、4~12元杂环基、6~10元芳基、5~10元杂芳基、-C=ONR8R9、-NHC=OR8、-NR8R9、-OC=ONR8R9、-NHC=ONR8R9、-S(O)mR8、-S(O)m-NHR8、-NHC=OOR8或-NHS(O)mR8;
m选自1或2; R8和R9各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
所述的R3、R4、R5、R6、R7、R8、R9和R10中取代基团各自独立地选自一个或多个氘、 卤素、羟基、氰基、氨基、C1-C8烷基、C1-C8烷氧基或C3-C8环烷基。
本发明的一些实施方案,环A选自任选被取代的4~12元杂环基; R1选自H、羟基、任选被取代的C1-C8烷基、C3-C8环烷基、C2-C8烯基、C2-C8炔基、4~12元杂环基、6~10元芳基或5~10元杂芳基;
R2选自氰基或-C=ONR6R7;
L选自氨基、-NR6C=O-、-NR6C=ONR10-、-C=ONR10-、-C=ONR6O-、-C=ONR6NR10-、-NR6S(O)m-、-S(O)mNR6-、-NR6S(O)mNR7-、-S(O)m-、-C=O-或-C=OO-;或者,L不存在;
R3选自H或甲基;
R4和R5各自独立地选自H、氘、卤素、氰基、硝基、任选被取代的C1-C8烷基或C3-C8环烷基;
R6、R7和R10各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
或者,R10与其相连的N及R1可形成一个任选被取代4~12元杂环基;
其中,所述的环A和R1中取代基团各自独立地选自一个或多个卤素、羟基、氰基、氨基、C1-C8烷基、C1-C8烷氧基、C3-C8环烷基、4~12元杂环基、6~10元芳基、5~10元杂芳基、-C=ONR8R9、-NHC=OR8、-NR8R9、-OC=ONR8R9、-NHC=ONR8R9、-S(O)mR8、-S(O)m-NHR8、-NHC=OOR8或-NHS(O)mR8;
m选自1或2; R8和R9各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
所述的R4、R5、R6、R7、R8、R9和R10中取代基团各自独立地选自一个或多个氘、卤素、羟基、氰基、氨基、C1-C8烷基、C1-C8烷氧基或C3-C8环烷基。
本发明的一些实施方案,环A选自任选被取代的下列基团: R1选自H、羟基、任选被取代的C1-C8烷基、C3-C8环烷基、4~12元杂环基、6~10元芳基或5~10元杂芳基;
R2选自氰基或-C=ONR6R7;
L选自氨基、-NR6C=O-、-NR6C=ONR10-、-C=ONR10-、-C=ONR6O-、-C=ONR6NR10-、-NR6S(O)m-、-S(O)mNR6-、-NR6S(O)mNR7-、-S(O)m-、-C=O-或-C=OO-;
或者,L不存在; R3选自H或甲基;
R4和R5各自独立地选自H、氘、卤素、氰基、硝基、任选被取代的C1-C8烷基或C3-C8环烷基;
R6、R7和R10各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
或者,R10与其相连的N及R1可形成一个任选被取代4~12元杂环基;
m选自1或2; 其中,所述的环A和R1中取代基团各自独立地选自一个或多个卤素、羟基、氰基、氨基、C1-C8烷基、C1-C8烷氧基、C3-C8环烷基、4~12元杂环基、6~10元芳基、5~10元杂芳基、-C=ONR8R9、-NHC=OR8、-NR8R9、-OC=ONR8R9、-NHC=ONR8R9、-S(O)mR8、-S(O)m-NHR8、-NHC=OOR8或-NHS(O)mR8;
R8和R9各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
所述的R4、R5、R6、R7、R8、R9和R10中取代基团各自独立地选自一个或多个氘、卤素、羟基、氰基、氨基、C1-C8烷基、C1-C8烷氧基或C3-C8环烷基。
本发明的一些实施方案,环A选自任选被取代的下列基团: R1选自H、羟基、任选被取代的甲基、乙基、丙基、环丙基、正丁基、叔丁基、环丁基、苯基、吡啶基、咪唑基、吡唑基、噁唑基、噻唑基或
R2选自氰基或-C=ONR6R7;
L选自氨基、-NR6C=O-、-NR6C=ONR10-、-C=ONR10-、-C=ONR6O-、-C=ONR6NR10-、-NR6S(O)m-、-S(O)mNR6-、-NR6S(O)mNR7-、-S(O)m-、-C=O-或-C=OO-;
或者,L不存在; R3选自H或甲基;
R4和R5各自独立地选自H、氘、卤素或氰基;
R6、R7和R10各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
或者,R10与其相连的N及R1可形成一个任选被取代4~12元杂环基;
m选自1或2; 其中,所述的环A和R1中取代基团各自独立地选自一个或多个卤素、羟基、氰基、氨基、C1-C8烷基、C1-C8烷氧基、C3-C8环烷基、4~12元杂环基、6~10元芳基或5~10元杂芳基;
所述的R6、R7和R10中取代基团各自独立地选自一个或多个氘、卤素、羟基、氰基、氨基、C1-C8烷基、C1-C8烷氧基或C3-C8环烷基。
本发明的一些实施方案,环A选自任选被取代的下列基团: R1选自H、羟基、任选被取代的甲基、乙基、丙基、环丙基、正丁基、叔丁基、环丁基、苯基、吡啶基、咪唑基、吡唑基、噁唑基、噻唑基或
R2选自氰基或-C=ONR6R7;
L选自氨基、-NR6C=O-、-C=ONR10-、-S(O)m-、-C=O-或-C=OO-;
或者,L不存在; R3选自H或甲基;
R4和R5各自独立地选自H、氘、F、Cl或氰基;
R6、R7和R10各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
或者,R10与其相连的N及R1可形成一个任选被取代4~12元杂环基;
m选自1或2; 其中,所述的环A和R1中取代基团各自独立地选自一个或多个卤素、羟基、氰基、氨基、C1-C4烷基或C1-C4烷氧基;
所述的R6、R7和R10中取代基团各自独立地选自一个或多个氘、卤素、羟基、氰基或氨基。
本发明的一些实施方案,环A选自任选被取代的下列基团: R1选自H、羟基、任选被取代的甲基、乙基、丙基、环丙基、叔丁基、环丁基或
R2选自氰基或-C=ONR6R7;
R6和R7选自H、甲基或氘代甲基;
L选自-C=ONR10-、-S(O)m-、-C=O-或-C=OO-;
或者,L不存在; R3选自H或甲基;
R4和R5各自独立选自H或氘;
R10为H;
m选自1或2; 其中,所述的环A和R1中取代基团各自独立地选自一个或多个F、Cl、羟基、氰基、氨基、甲基或甲氧基。
本发明的一些实施方案,所述化合物是如下所示的化合物或其药学上可接受的盐: 优选地,本发明的化合物是如下所示的化合物或其药学上可接受的盐: 本发明另一方面是提供式(I)化合物、其立体异构体或其药学上可接受的盐的制备方法,包括如下步骤: 其中,A、L、R1、R2、R3、R4和R5如上述式(I)化合物中所定义。
本发明还提供了一种药物组合物,包含式(I)化合物、其立体异构体或药学上可接受的盐和可药用载体。 优选地,药物组合物选自胶囊剂、散剂、片剂、颗粒剂、丸剂、注射剂、糖浆剂、口服 液、吸入剂、软膏剂、栓剂或贴剂。 本发明另一方面提供了式(I)化合物或其互变异构体、内消旋体、外消旋体、对映异构体、非对映异构体、及其混合物形式、及其可药用盐或包含其的药物组合物在制备预防或治疗由两面神激酶JAK家族介导的疾病的的药物中的用途。所述疾病包括免疫系统的疾病、自身免疫性疾病、皮肤病、变应性疾病、病毒性疾病、I型糖尿病与糖尿病并发症、阿尔茨海默病、干眼病、骨髓纤维化、血小板增多症、红细胞增多症、白血病和癌症,所述的免疫系统疾病为器官移植排斥,如异体抑制排斥或移植物抗宿主疾病;所述的自身免疫性疾病选自系统性红斑狼疮、多发性硬化、类风湿性关节炎、青少年关节炎、银屑病、溃疡性结肠炎、克罗恩氏病或自体免疫性甲状腺疾病;所述的皮肤病选自牛皮癣、皮疹、斑秃或特应性皮炎;所述的变应性疾病选自哮喘或鼻炎;所述的病毒性疾病选自乙型肝炎、丙型肝炎、水痘、带状疱疹病毒;所述的癌症选自实体瘤、血液癌或皮肤癌,所述的实体瘤选自前列腺癌、肾癌、肝癌、胰腺癌、胃癌、乳腺癌、肺癌、头颈部癌、甲状腺癌、胶质母细胞瘤或黑素瘤,所述的血液癌选自淋巴瘤或白血病,所述的皮肤癌选自皮肤T-细胞淋巴瘤或皮肤B-细胞淋巴瘤。 除非有相反陈述,下列用在说明书和权利要求书中的术语具有下述含义。 本发明中“芳基”指全碳单环或双环基团,“6-10元芳基”指含有6-10个碳的全碳芳基,例如苯基和萘基。所述芳基环可以稠合于杂芳基、杂环基或环烷基环上,其中与母体结构连接在一起的环为芳基环。 本发明中“杂芳基”指包含1至4个杂原子的杂芳族体系,所述杂原子包括氮、氧和硫的杂原子,包括但不限于呋喃基、噻吩基、吡啶基、吡咯基、吡唑基、N-烷基吡咯基、嘧啶基、吡嗪基、咪唑基、四唑基、噁唑基或
等。
本发明中“C1-C8烷基”指包括1至8个碳原子的直链烷基和含支链烷基,烷基指饱和的脂族烃基团,例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、仲丁基、正戊基、1,1-二甲基丙基、1,2-二甲基丙基、2,2-二甲基丙基、1-乙基丙基、2-甲基丁基、3-甲基丁基、正己基、1-乙基-2-甲基丙基、1,1,2-三甲基丙基、1,1-二甲基丁基、1,2-二甲基丁基、2,2-二甲基丁基、1,3-二甲基丁基、2-乙基丁基、2-甲基戊基、3-甲基戊基、4-甲基戊基、2,3-二甲基丁基、正庚基、2-甲基己基、3-甲基己基、4-甲基己基、5-甲基己基、2,3-二甲基戊基、2,4-二甲基戊基、2,2-二甲基戊基、3,3-二甲基戊基、2-乙基戊基、3-乙基戊基、正辛基、2,3-二甲基己基、2,4-二甲基己基、2,5-二甲基己基、2,2-二甲基己基、3,3-二甲基己基、4,4-二甲基己基、2-乙基己基、3-乙基己基、4-乙基己基、2-甲基-2-乙基戊基、2-甲基-3-乙基戊基或其各种支链异构体等。
本发明中“环烷基”指饱和单环烃取代基,“C3-C8环烷基”指包括3至8个碳原子的单环环烷基,例如:单环环烷基的非限制性实施例包含环丙基、环丁基、环戊基、环己基、环庚基、环辛基等。
本发明中“烯基”指由至少两个碳原子和至少一个碳-碳双键组成的如上述定义的烷基,“C2-C8烯基”指含有2-8个碳的直链或含支链烯基。例如乙烯基、1-丙烯基、2-丙烯基、1-,2-或3-丁烯基等。
本发明中“炔基”指至少两个碳原子和至少一个碳-碳三键组成的如上所定义的烷基,“C2-C8炔基”指含有2-8个碳的直链或含支链炔基。例如乙炔基、1-丙炔基、2-丙炔基、1-,2-或3-丁炔基等。
当取代基的键“---”连接在确定的位置上时,取代基在此位置发生取代; 当取代基的键“---”交叉连接在一个环上的两个原子间时,这种取代基可以与这个环上的任意原子相键合,代表取代基可以在环上任意位置取代。例如,结构单元
表示可在环己基上的任意一个位置发生取代。
本发明中“杂环基”指饱和或部分不饱和单环或多环环状烃取代基,其中一个或多个环原子选自氮、氧或S(O)m的杂原子,但不包括-O-O-、-O-S-或-S-S-的环部分,其余环原子为碳。“4-12元杂环基”指包含4至12个环原子的环基。单环杂环基的非限制性实施例包含吡咯烷基、哌啶基、哌嗪基、吗啉基、硫代吗啉基、高哌嗪基等,多环杂环基包括螺环、稠环和桥环的杂环基,包括但不仅限于如下结构:
本发明中“烷氧基”指-O-(烷基),其中烷基的定义如上所述。“C1-C8烷氧基”指含1-8个碳的烷基氧基,非限制性实施例包含甲氧基、乙氧基、丙氧基、丁氧基等。
“卤素”指氟、氯、溴或碘。 “药物组合物”表示含有一种或多种本文所述化合物或其生理学上可药用的盐或前体药物与其他化学组分的混合物,以及其他组分例如生理学可药用的载体和赋形剂。药物组合物的目的是促进对生物体的给药,利于活性成分的吸收进而发挥生物活性。 “载体”是指不会对生物体产生明显刺激且不会消除所给予化合物的生物活性和特性的材料。 本发明制备步骤中,所用试剂的缩写分别表示: DMF N,N-二甲基甲酰胺 THF 四氢呋喃 PE 石油醚 EA 乙酸乙酯 CDI 羰基二咪唑 TBTU O-苯并三氮唑-N,N,N’,N’-四甲基脲四氟硼酸 DCM 二氯甲烷 Boc 叔丁氧基羰基 TIPSCl 三异丙基氯硅烷 MeCN 乙腈 TFA 三氟乙酸 图1实施例1化合物的核磁共振氢谱; 图2实施例2化合物的核磁共振氢谱; 图3实施例3化合物的核磁共振氢谱; 图4实施例4化合物的核磁共振氢谱; 图5实施例5化合物的核磁共振氢谱; 图6实施例6化合物的核磁共振氢谱; 图7实施例7化合物的核磁共振氢谱; 图8实施例8化合物的核磁共振氢谱; 图9实施例9化合物的核磁共振氢谱; 图10实施例10化合物的核磁共振氢谱; 图11实施例11化合物的核磁共振氢谱; 图12实施例12化合物的核磁共振氢谱; 图13实施例13化合物的核磁共振氢谱; 图14实施例14化合物的核磁共振氢谱; 图15实施例15化合物的核磁共振氢谱; 图16实施例16化合物的核磁共振氢谱; 图17实施例17化合物的核磁共振氢谱; 图18实施例18化合物的核磁共振氢谱; 图19实施例19化合物的核磁共振氢谱; 图20实施例20化合物的核磁共振氢谱; 图21实施例21化合物的核磁共振氢谱; 图22实施例22化合物的核磁共振氢谱; 图23实施例23化合物的核磁共振氢谱; 图24小鼠DSS肠炎模型疾病活动指数(Disease activity index,DAI)评分结果; 图25大鼠DNBS诱导性克罗恩病模型结肠重量/长度比的影响结果; 图26大鼠DNBS诱导性克罗恩病模型老鼠结肠溃疡面积; 图27 G1组大鼠结肠图片; 图28 G2组大鼠结肠图片; 图29 G3组大鼠结肠图片; 图30 G4组大鼠结肠图片; 图31 G5组大鼠结肠图片; 图32 G6组大鼠结肠图片; 图33 G1-G6组大鼠结肠图片缩小对比。 以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。 下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的药材原料、试剂材料等,如无特殊说明,均为市售购买产品。 实施例1 (S)-4-(3-(2,2,2-三氟乙基氨基甲酰基)哌啶-1-氨基)-1H-7-氮杂吲哚-5甲酰胺的合成 步骤1:4-氯-1-(三异丙基硅基)-7-氮杂吲哚的合成 室温下,将4-氯-7氮杂吲哚(100.00g,655.39mmol)溶于DMF(1.2L)中,冰浴降温至0℃,分批加入NaH(39.47g,983.09mmol),加毕,0℃下搅拌1小时,滴加三异丙基氯硅烷(190.80g,983.09mmol,缩写TIPSCl),升至室温反应2小时。将反应液倒入2L冰水中,石油醚(1L x 2)萃取,合并有机相,用饱和食盐水(1L x3)洗涤,减压浓缩至干,柱层析(PE:EA=1:0)得无色透明状液体197.50g,收率97%。 步骤2:4-氯-1-(三异丙基硅基)-7-氮杂吲哚-5-甲酸乙酯的合成 将4-氯-1-(三异丙基硅基)-7-氮杂吲哚(20.00g,64.74mmol)溶于THF(100mL)的四口瓶中,降温至-75℃,滴加仲丁基锂(100mL,129.48mmol,Sec.BuLi),加毕,-75℃下搅拌1小时,加入氯甲酸氯乙酯(17.80g,129.48mmol),加毕,-75℃下反应1小时。将反应液倒入饱和氯化铵溶液中,分液,水相加入乙酸乙酯(100mL)萃取,合并有机相,饱和食盐水洗涤,无水硫酸钠干燥,过滤,浓缩,过柱(PE:EA=1:0~10:1)得淡黄色液体23.15g,收率94%。 步骤3:4-氯-7-氮杂吲哚-5-甲酸的合成 室温下,向单口瓶中加入4-氯-1-(三异丙基硅基)-7-氮杂吲哚-5-甲酸乙酯(12.94g,33.96mmol),加入乙醇(200mL)和10%的氢氧化钠(100mL),加毕,于60℃下反应2小时。减压蒸除乙醇,冰浴下用1N的稀盐酸调节水相至pH=4,有大量白色固体析出,过滤,滤饼烘干得白色固体8.60g,收率77%。 步骤4:4-氯-7-氮杂吲哚-5-甲酰胺的合成 在四口瓶中加入4-氯-7-氮杂吲哚-5-甲酸(7.00g,35.60mmol),加入DMF 100mL,搅拌下加入羰基二咪唑(8.72g,53.41mmol,CDI),室温下搅拌1.5小时,0℃下滴加氨水(9.34g,142.40mmol),自然升温至室温,搅拌反应2小时。向反应液中加入EA 100mL,有大量白色固体析出,静置后过滤,滤饼水洗、烘干,得到灰白色固体5.34g,收率76%。 步骤5:(S)-1-亚硝基哌啶-3-甲酸乙酯的合成 室温下,将(S)-3-哌啶甲酸乙酯(10.00g,0.064mol)加入到冰醋酸(100mL)、水(40ml)组成的混合溶液中,降温至0℃后滴加20mL溶有亚硝酸钠(8.78g,0.13mol)的水溶液,0℃下搅拌反应1h,升温至室温反应2h。向反应液中加入水200mL,乙酸乙酯(200mL x3)萃取,合并有机相,用饱和食盐水洗涤,减压浓缩后直接投下一步。 步骤6:(S)-1-氨基哌啶-3-甲酸乙酯盐酸盐的合成 室温下,将(S)-1-亚硝基哌啶-3-甲酸乙酯(11.83g,0.064mol)溶于甲醇(100mL)中,加入Zn粉(10.40g,0.16mol),降温至-5℃,缓慢滴加冰醋酸(50mL),加毕,0℃下搅拌反应0.5h,升温至室温继续反应2h。将反应液过滤,滤饼用100mL甲醇冲洗,滤液蒸干,残留物加入盐酸乙醇溶液搅拌0.5h,蒸除溶剂得黄色油状物13.27g,步骤5和步骤6两步粗品收率100%。 步骤7:(S)-1-(5-甲酰氨基-1H-7-氮杂吲哚-4-氨基)哌啶-3-甲酸乙酯的合成 将4-氯-7-氮杂吲哚-5-甲酰胺(1.00g,5.12mmoL)和(S)-1-氨基哌啶-3-甲酸乙酯盐酸盐(2.14g,10.24mmoL)加入到微波管中,加入20mL正丁醇,于150℃下微波反应1h。将反应液减压蒸干,柱层析(二氯甲烷/甲醇体系),得淡黄色凝胶状粗品0.80g,收率47.3%。1H NMR(300MHz,DMSO-d6)δ11.40(s,1H),9.97(s,1H),8.38(s,1H),8.19(s,1H),7.79(s,1H),7.07(s,1H),6.98(s,1H),4.06(q,J=7.0Hz,2H),3.17(d,J=56.4Hz,3H),2.88–2.64(m,2H),2.38(s,1H),2.07–1.59(m,3H),1.22–0.93(m,3H)。MS(ESI)m/z:332[M+H]+。
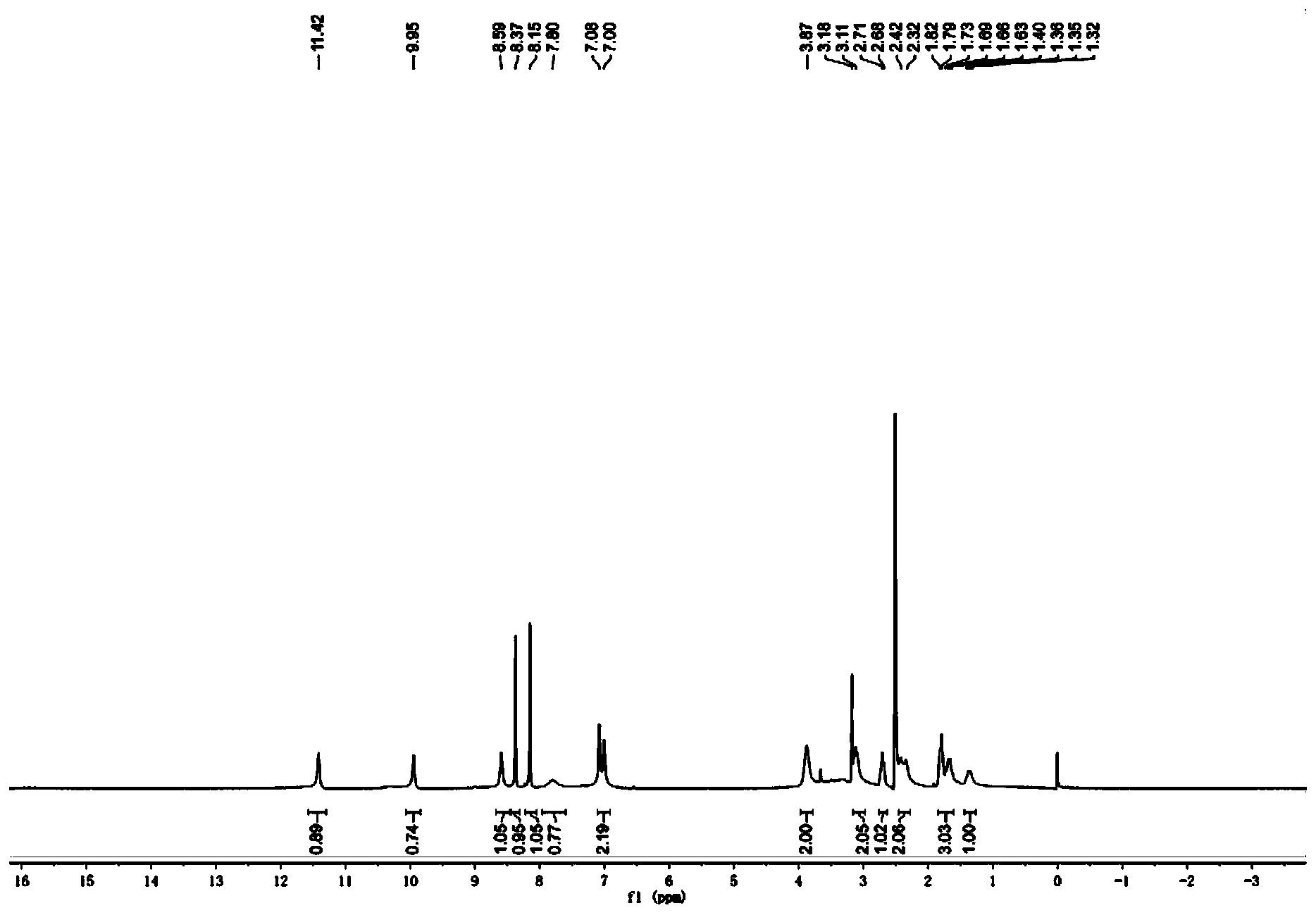
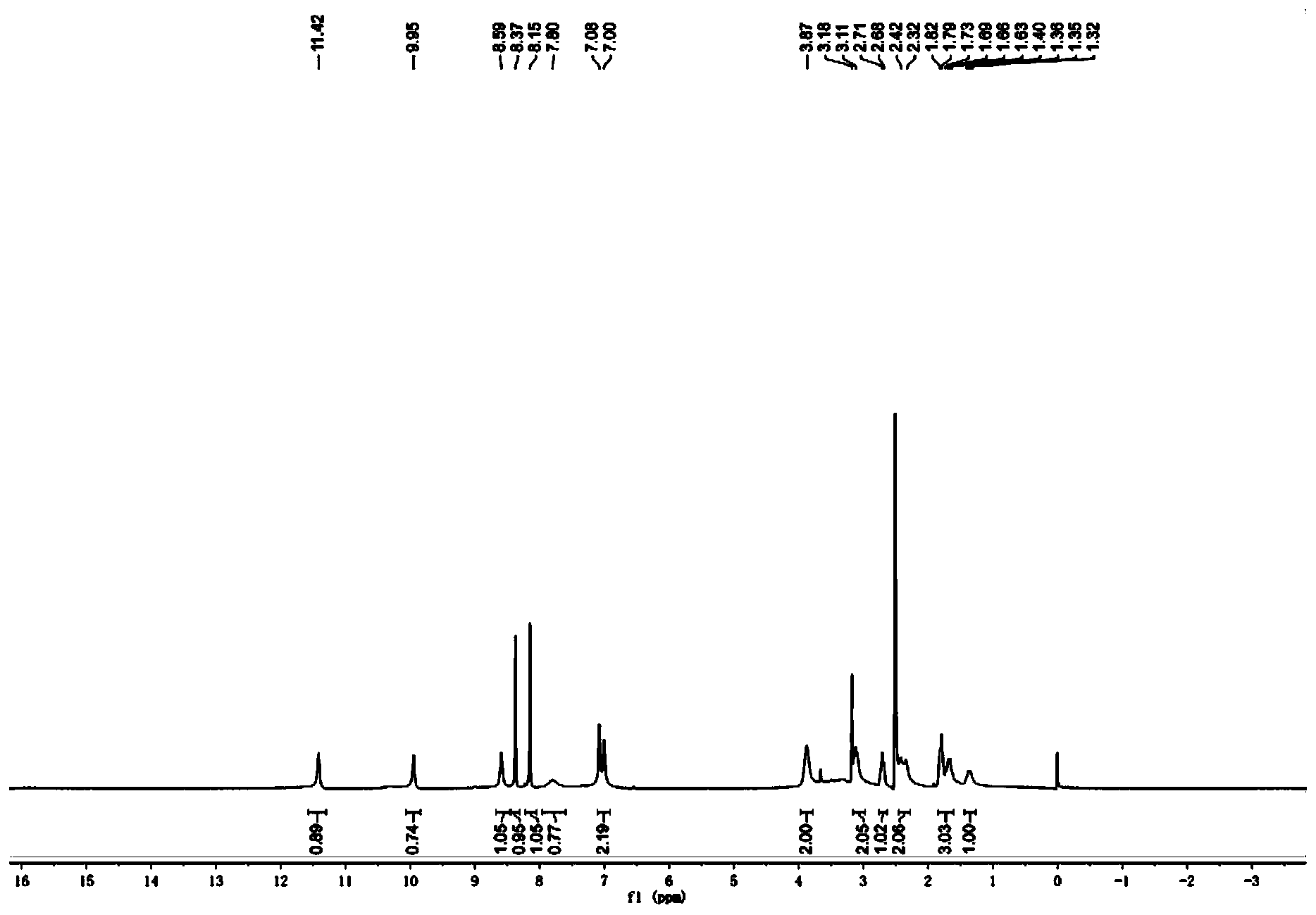
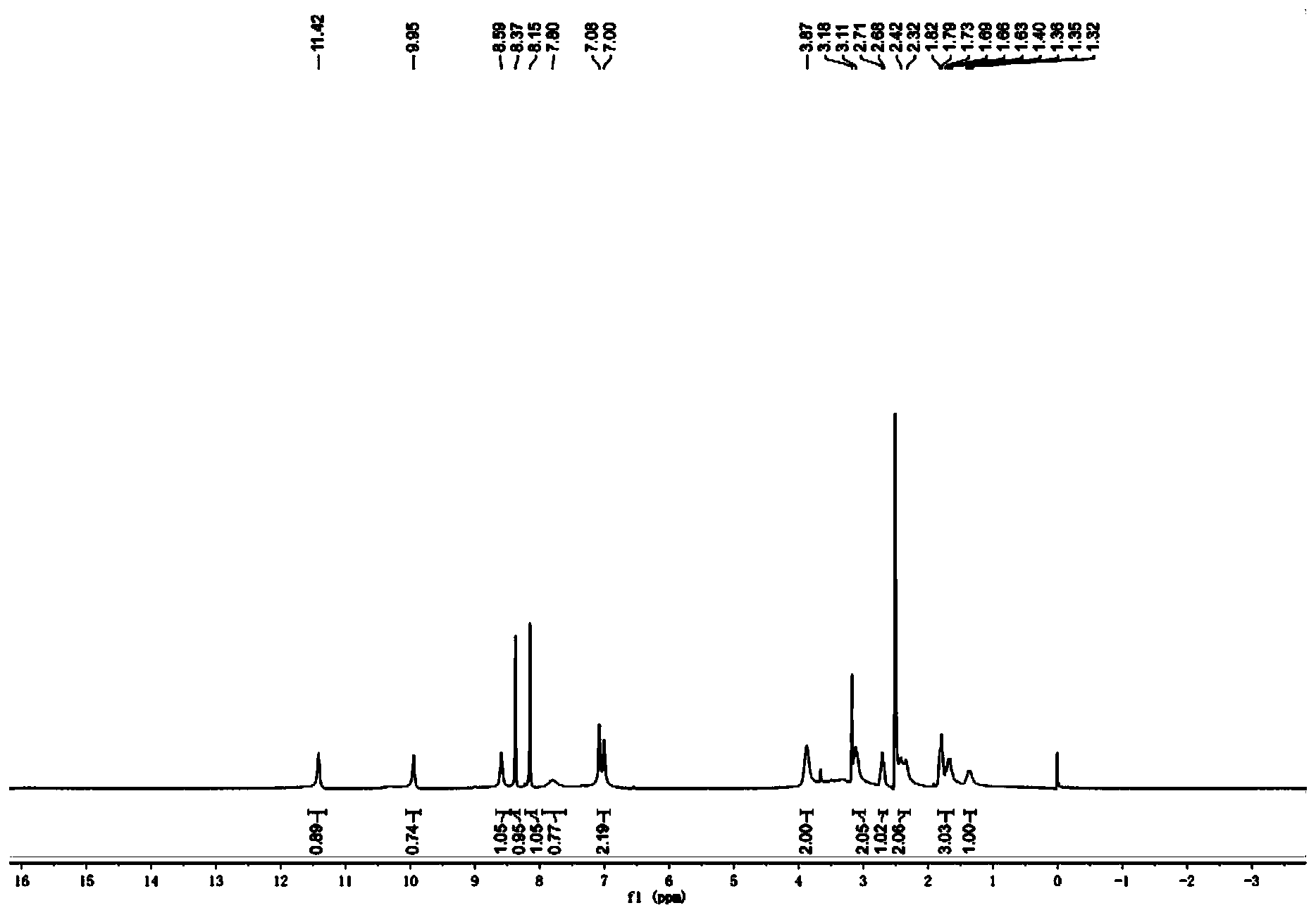
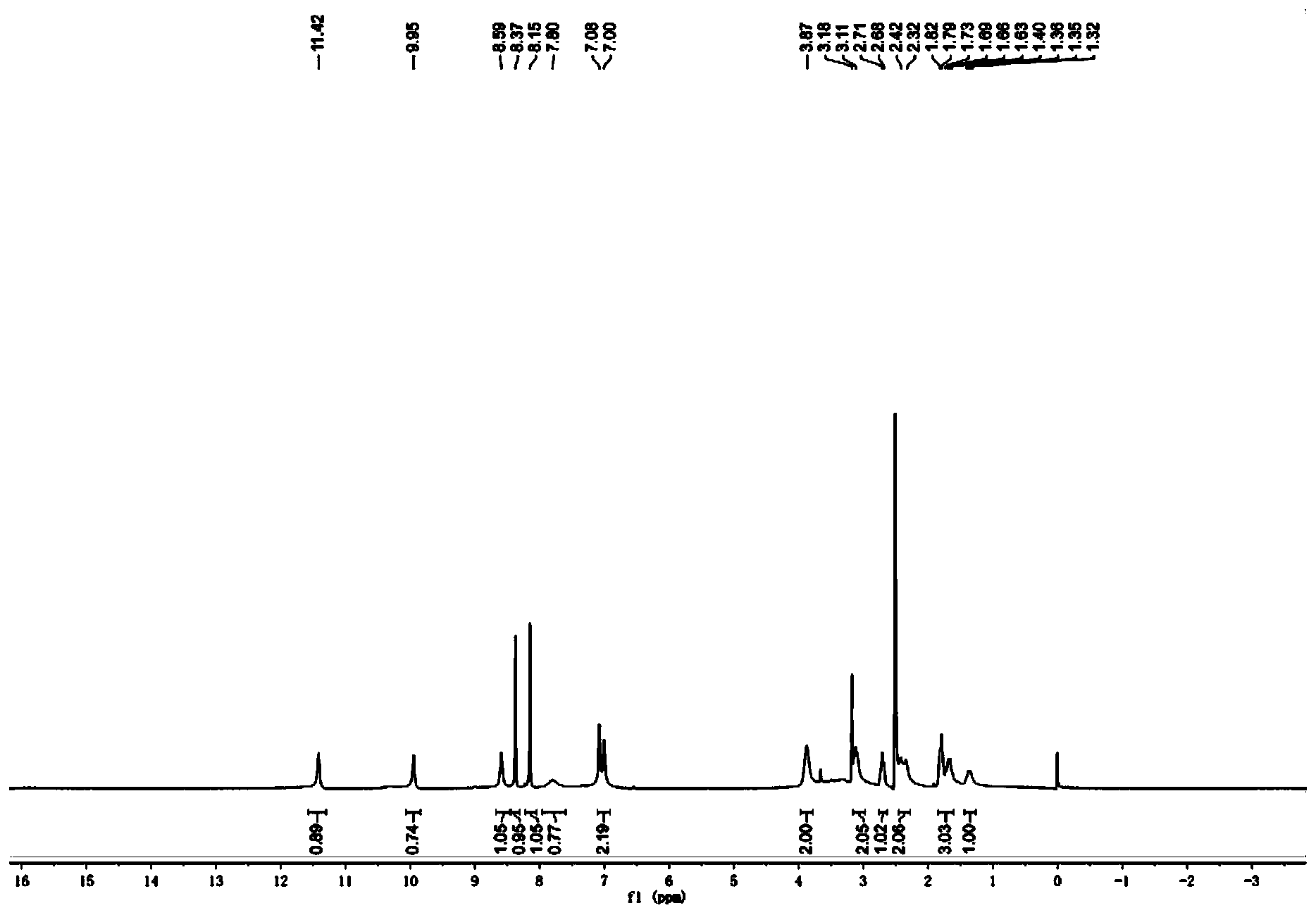
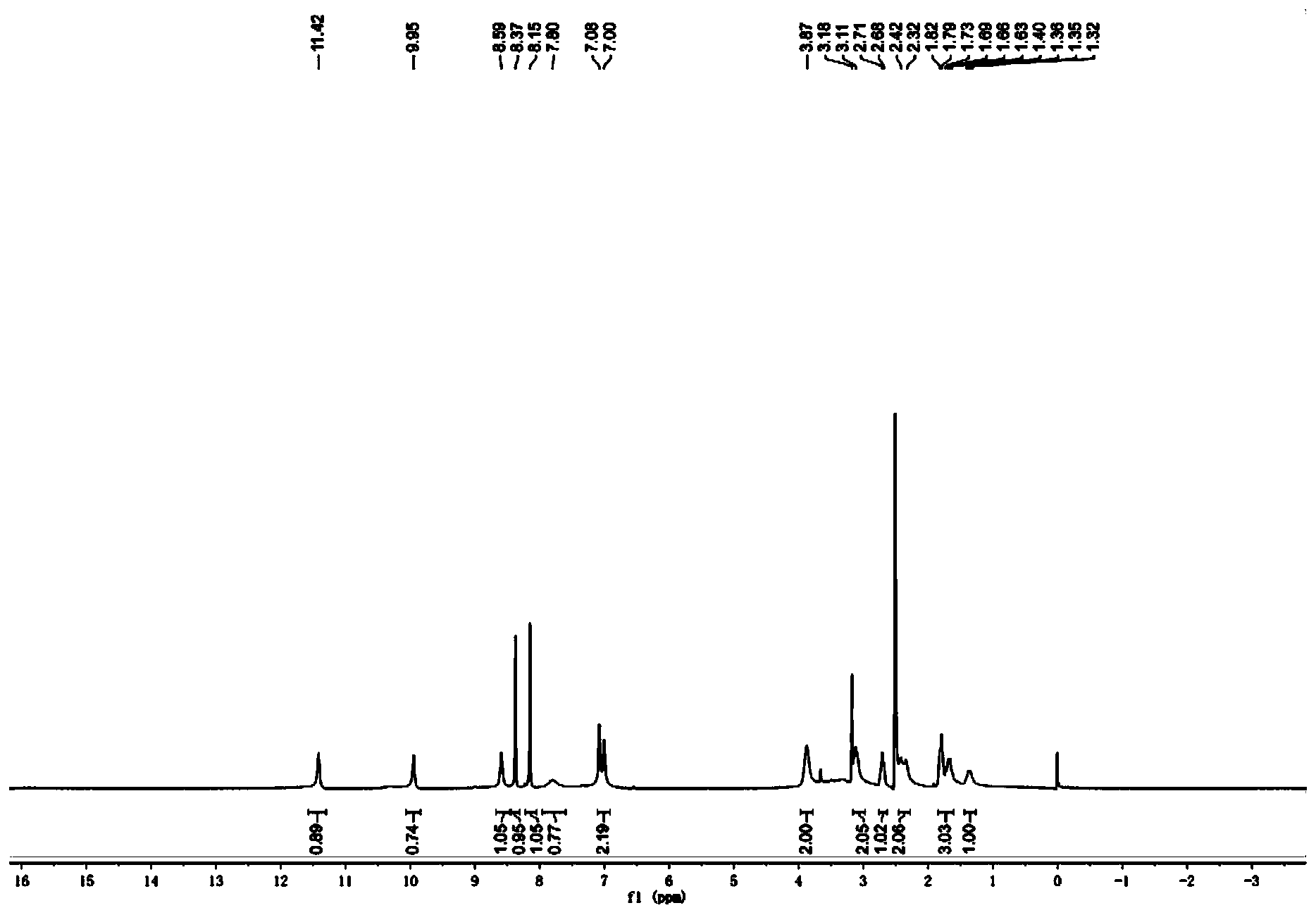
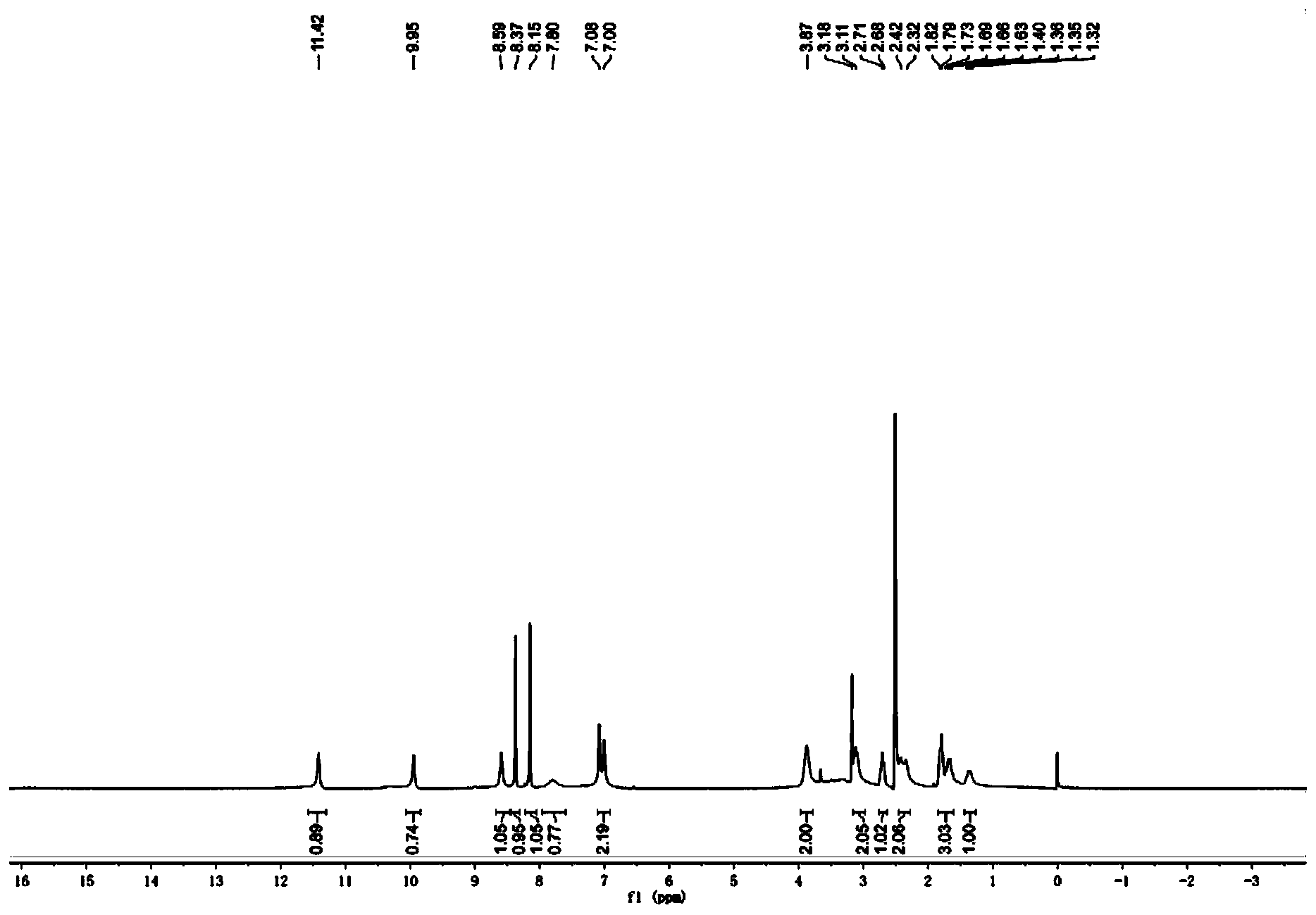
步骤8:(S)-1-(5-甲酰氨基-1H-7-氮杂吲哚-4-氨基)哌啶-3-甲酸的合成 室温下,将(S)-1-(5-甲酰氨基-1H-7-氮杂吲哚-4-氨基)哌啶-3-甲酸乙酯(0.70g,2.11mmol)溶于甲醇中,滴加3N的NaOH溶液,于23℃下反应3h。蒸除有机溶剂,水相用1N的稀盐酸调节至pH=4左右,减压蒸干,残留固体加入甲醇溶解,过滤除去无机盐,蒸除甲醇得淡黄色固体0.52g,收率81.3%。 步骤9:(S)-4-(3-(2,2,2-三氟乙基氨基甲酰基)哌啶-1-氨基)-1H-7-氮杂吲哚-5甲酰胺的合成 将(S)-1-(5-甲酰氨基-1H-7-氮杂吲哚-4-氨基)哌啶-3-甲酸(0.25g,0.82mmol)、三氟乙铵盐酸盐(0.17g,1.23mmol)以及O-苯并三氮唑-N,N,N’,N’-四甲基脲四氟硼酸(0.40g,1.23mmol,TBTU)加入到单口瓶中,加入5mL DMF,搅拌起来后加入三乙胺(0.48g,4.75mmol),加毕,室温下搅拌过夜。向反应液中加入水10mL,以DCM:MeOH=5:1混合溶剂(10mL x5)萃取。合并有机相,饱和食盐水洗涤,减压蒸干,柱层析(二氯甲烷/甲醇体系),得淡黄色固体0.022g,收率10%。1H NMR(400MHz,DMSO-d6)δ11.42(br,1H),9.95(br,1H),8.59(br,1H),8.37(s,1H),8.15(s,1H),7.78(br,1H),7.04(m,2H),3.87(br,2H),3.11(m,2H),2.71(m,1H),2.37(m,2H),1.82(m,2H),1.67(m,1H),1.34(m,1H)。MS(ESI)m/z:385[M+H]+。
实施例2 (S)-4-(3-(2,2-二氟乙基氨基甲酰基)哌啶-1-氨基)-1H-7-氮杂吲哚-5甲酰胺的合成 步骤1:(S)-3-((2,2-二氟乙基)氨基甲酰)哌啶-1-羧酸叔丁酯的合成 室温下,将(S)-1-(叔丁氧基羰基)哌啶-3-羧酸(15.00g,65.40mmol)溶于DCM(400mL)中,加入三乙胺(16.50g,163.50mmol)和TBTU(25.20g,78.50mmol)反应1h后移至冰浴0℃下缓慢加入2,2-二氟乙胺盐酸盐(10.00g,85.00mmol),加毕,于0℃下搅拌1小时室温反应5小时终止。浓缩,用水(200mL)稀释,乙酸乙酯(150mL)萃取三次。合并有机相,用100mL饱和食盐水洗三次,浓缩,柱层析(PE/EA体系)得无色透明状液体16.06g,收率84%。MS(ESI)m/z:237.1[M+H-56]+。
步骤2:(S)-N-(2,2-二氟乙基)哌啶-3-甲酰胺盐酸盐的合成 将(S)-3-((2,2-二氟乙基)氨基甲酰)哌啶-1-羧酸叔丁酯(16.06g,54.94mmol)溶于乙醇(150mL)中,常温下缓慢滴加35%HCl/EtOH(30mL),反应3小时终止。减压蒸除溶剂得到白色固体11.43g。收率91%。MS(ESI)m/z:193.1[M+H]+。
步骤3:(S)-N-(2,2-二氟乙基)-1-亚硝基哌啶-3-甲酰胺的合成 室温下将(S)-N-(2,2-二氟乙基)哌啶-3-甲酰胺盐酸盐(11.43g,49.98mmol)溶入到醋酸(100mL)中,0℃下缓慢加入溶有亚硝酸钠(4.49g,65.00mmol)的50mL水溶液。滴加完毕0℃下反应1小时并升至常温反应过夜。反应完毕向反应液中加入水(100mL)并用乙酸乙酯(80mL)萃取3次。合并有机相用饱和碳酸钠水溶液(80mL)洗涤有机相,并用无水硫酸钠干燥,浓缩有机相。硅胶拌样,柱层析(PE/EA)得白色固体9.80g,收率89%。MS(ESI)m/z:222.1[M+H]+。
步骤4:(S)-1-氨基-N-(2,2-二氟乙基)哌啶-3-甲酰胺盐酸盐的合成 将(S)-N-(2,2-二氟乙基)-1-亚硝基哌啶-3-甲酰胺(9.80g,44.30mmol)溶入到甲醇(40mL)中,室温下缓慢加入锌粉(8.70g,132.90mmol)并在氮气保护下降温至-20℃度搅拌10分钟。-20℃缓慢滴加醋酸(50mL)并在氮气保护下反应2小时终止,加入盐酸乙酸乙酯溶液搅拌1小时后使之成盐,减压蒸干,保存。过滤反应液,滤液直接硅胶拌样,柱层析(DCM/MeOH)得白色固体8.60g,加入盐酸乙酸乙酯溶液搅拌1小时后使之成盐,减压蒸干,保存。MS(ESI)m/z:208.1[M+H]+。
步骤5:(S)-4-(3-(2,2-二氟乙基氨基甲酰基)哌啶-1-氨基)-1H-7-氮杂吲哚-5甲酰胺的合成 将4-氯-7-氮杂吲哚-5-甲酰胺(0.10g,0.51mmoL)、(S)-1-氨基-N-(2,2-二氟乙基)哌啶-3-甲酰胺盐酸盐(0.25g,1.02mmoL)加入到微波管中,加入正丁醇2mL,150℃微波反应1h。将反应液过滤,滤液旋干,柱层析(二氯甲烷/甲醇体系),得淡黄色固体0.014g,收率7.5%。1H NMR(400MHz,DMSO-d6)δ11.41(br,1H),9.93(br,1H),8.37(s,1H),8.32(br,1H),7.81(br,1H),7.04(m,3H),5.96(t,J=57.5Hz,1H),3.44(m,2H),3.12(m,2H),2.68(m,1H),2.33(m,2H),1.78(m,2H),1.65(m,1H),1.32(m,1H)。MS(ESI)m/z:367[M+H]+。
实施例3 (R)-4-(3-(2,2,2-三氟乙基氨基甲酰基)哌啶-1-氨基)-1H-7-氮杂吲哚-5甲酰胺的合成 中间体(R)-1-氨基-N-(2,2,2-三氟乙基)哌啶-3-甲酰胺盐酸盐的合成参考实施例2中间体(S)-1-氨基-N-(2,2-二氟乙基)哌啶-3-甲酰胺盐酸盐的制备方法,将实施例2步骤(1)中的 (S)-1-(叔丁氧基羰基)哌啶-3-羧酸替换为(R)-1-(叔丁氧基羰基)哌啶-3-羧酸,将2,2-二氟乙胺盐酸盐替换为三氟乙胺盐酸盐制备得到。 将4-氯-7-氮杂吲哚-5-甲酰胺(0.10g,0.51mmoL)、(R)-1-氨基-N-(2,2,2-三氟乙基)哌啶-3-甲酰胺盐酸盐(0.27g,1.02mmoL)加入到微波管中,加入正丁醇2mL,150°微波反应1h。将反应液过滤,滤液旋干,柱层析(二氯甲烷/甲醇体系),得淡黄色固体粉末0.015g,收率7.6%。1H NMR(400MHz,DMSO-d6)δ11.41(br,1H),9.94(br,1H),8.60(br,1H),8.37(s,1H),8.15(br,1H),7.82(br,1H),7.04(m,2H),3.88(br,2H),3.10(m,2H),2.71(m,1H),2.38(m,2H),1.82(m,2H),1.67(m,1H),1.37(m,1H)。MS(ESI)m/z:385[M+H]+。
实施例4 (R)-4-(3-(2,2-二氟乙基氨基甲酰基)哌啶-1-氨基)-1H-7-氮杂吲哚-5甲酰胺的合成 (R)-1-氨基-N-(2,2-二氟乙基)哌啶-3-甲酰胺盐酸盐的合成参考实施例2中(S)-1-氨基-N-(2,2-二氟乙基)哌啶-3-甲酰胺的制备方法,将实施例2步骤(1)中的(S)-1-(叔丁氧基羰基)哌啶-3-羧酸替换为(R)-1-(叔丁氧基羰基)哌啶-3-羧酸制备得到。 将4-氯-7-氮杂吲哚-5-甲酰胺(0.10g,0.51mmoL)和(R)-1-氨基-N-(2,2-二氟乙基)哌啶-3-甲酰胺盐酸盐(0.25g,1.02mmoL)加入到微波管中,加入正丁醇2mL,150℃微波反应1h。将反应液过滤,滤液旋干,柱层析(二氯甲烷/甲醇体系),得淡黄色固体粉末0.035g,收率18.7%。1H NMR(400MHz,DMSO-d6)δ11.42(br,1H),9.94(br,1H),8.38(s,1H),8.32(br,1H),7.82(br,1H),7.08(m,3H),5.97(t,J=57.5Hz,1H),3.46(br,2H),3.12(m,2H),2.68(m,1H),2.37(m,2H),1.80(m,2H),1.67(m,1H),1.34(m,1H)。MS(ESI)m/z:367[M+H]+。
实施例5 (S)-4-(3-(正丙基氨基甲酰基)哌啶-1-氨基)-1H-7-氮杂吲哚-5甲酰胺的合成 将(S)-1-(5-甲酰氨基-1H-7-氮杂吲哚-4-氨基)哌啶-3-甲酸(0.25g,0.82mmol)、正丙胺(0.058g,1.00mmol)以及O-苯并三氮唑-N,N,N’,N’-四甲基脲四氟硼酸(0.39g,1.23mmol,TBTU)加入到单口瓶中,加入5mL DMF,搅拌起来后加入三乙胺(0.25g,2.46mmol),加毕,于室温下搅拌反应16h。将反应液直接减压蒸干,柱层析(二氯甲烷/甲醇体系),得淡黄色固体48mg,收率17%。1H NMR(300MHz,DMSO-d6)δ11.44(br,1H),9.97(br,1H),8.38(s,1H),7.85(br,2H),7.05(m,3H),3.11(m,2H),2.98(m,2H),2.60(m,1H),2.30(m,2H),1.72(m,3H),1.38(m,3H),0.81(t,J=7.4Hz,3H)。MS(ESI)m/z:345[M+H]+。
实施例6 (S)-4-(3-(环丙基氨基甲酰基)哌啶-1-氨基)-1H-7-氮杂吲哚-5甲酰胺的合成 将(S)-1-(5-甲酰氨基-1H-7-氮杂吲哚-4-氨基)哌啶-3-甲酸((0.16g,0.53mmol)、环丙胺(0.036g,0.63mmol)以及O-苯并三氮唑-N,N,N’,N’-四甲基脲四氟硼酸(0.25g,0.80mmol,TBTU)加入到单口瓶中,加入5mL DMF,搅拌起来后加入三乙胺(0.16g,1.59mmol),加毕,于室温下搅拌反应16h。将反应液直接减压蒸干,柱层析(二氯甲烷/甲醇体系),得淡黄色固体45mg,收率25%。1H NMR(300MHz,DMSO-d6)δ11.52(br,1H),10.03(br,1H),8.39(s,1H),7.93(br,2H),7.09(m,2H),7.01(m,1H),3.09(m,2H),2.59(m,2H),2.33(m,2H),1.80(m,2H),1.65(m,1H),1.36(m,1H),0.56(dt,J=4.6,2.7Hz,2H),0.36(dt,J=4.6,2.7Hz,2H)。MS(ESI)m/z:343[M+H]+。
实施例7 (S)-4-(3-(氰乙基氨基甲酰基)哌啶-1-氨基)-1H-7-氮杂吲哚-5甲酰胺的合成 将(S)-1-(5-甲酰氨基-1H-7-氮杂吲哚-4-氨基)哌啶-3-甲酸(0.25g,0.82mmol)、氨基乙氰盐酸盐(0.093g,1.00mmol)以及O-苯并三氮唑-N,N,N’,N’-四甲基脲四氟硼酸(0.39g,1.23mmol,TBTU)加入到单口瓶中,加入5mL DMF,搅拌起来后加入三乙胺(0.25g,2.46mmol),加毕,于室温下搅拌反应16h。将反应液直接减压蒸干,柱层析(二氯甲烷/甲醇体系),得淡黄色固体43mg,收率15%。1H NMR(300MHz,DMSO-d6)δ11.50(br,1H),10.01(br,1H),8.67(br,1H),8.38(s,1H),7.84(br,1H),7.05(m,3H),4.11(br,2H),3.18(m,2H),2.66(m,1H),2.38(m,2H),1.77(m,3H),1.30(m,1H)。MS(ESI)m/z:342[M+H]+。
实施例8 (S)-1-(5-甲酰氨基-1H-7-氮杂吲哚-4-氨基)哌啶-3-甲酸乙酯 (S)-1-(5-甲酰氨基-1H-7-氮杂吲哚-4-氨基)哌啶-3-甲酸乙酯为实施例1步骤7得到的中间体。1H NMR(300MHz,DMSO-d6)δ11.40(br,1H),9.97(br,1H),8.38(s,1H),8.19(br,1H),7.79(br,1H),7.07(br,1H),6.98(br,1H),4.06(q,J=7.0Hz,2H),3.18(m,2H),2.78(m,1H),2.38(m,2H),1.79(m,3H),1.30(m,1H),1.15(t,J=4.0Hz,3H)。MS(ESI)m/z:332[M+H]+。
实施例9 4-(3-(2,2,2-三氟乙基氨基甲酰基)吡咯-1-氨基)-1H-7-氮杂吲哚-5甲酰胺的合成 步骤1:1-叔丁氧羰基-吡咯-3-甲酸的合成 室温下,将3-吡咯甲酸(1.00g,8.68mmoL)溶于10mL THF和5mL水组成的混合溶剂中,加入碳酸氢钠(2.18g,0.026moL),降温至0℃,滴加(Boc)2O(2.08g,9.55mmoL), 加毕,升至室温反应2h。向反应液中加入100mL EA萃取除杂,水相用柠檬酸溶液调节PH=4,加入DCM萃取,无水硫酸钠干燥,浓缩,得白色固体1.64g,收率88%。
步骤2:1-叔丁氧羰基-吡咯-3-(2,2,2-三氟乙基)甲酰胺的合成 室温下,将1-叔丁氧羰基-吡咯-3-甲酸(1.64g,7.62mmoL)加入到20mL DMF中,依次加入O-苯并三氮唑-N,N,N’,N’-四甲基脲四氟硼酸(3.67g,11.43mmoL,TBTU)、三氟乙铵盐酸盐(1.24g,9.15mmoL)、三乙胺(2.31g,0.023moL),室温下搅拌反应16h。将反应液倒入50mL水中,加入DCM 30mL萃取,水相再用DCM萃取2次,合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥,减压蒸干,硅胶柱层析(PE:EA=1:1)得到淡黄色油状物1.90g,收率84%。 步骤3:N-(2,2,2-三氟乙基)吡咯-3-甲酰胺盐酸盐的合成 将1-叔丁氧羰基-吡咯-3-(2,2,2-三氟乙基)甲酰胺(1.90g,6.42mmoL)溶于盐酸乙酸乙酯(20mL)溶液中,室温下搅拌反应16h。直接将反应液减压蒸除溶剂,得粘稠油状物1.45g,粗产品收率100%。 步骤4:1-亚硝基-N-(2,2,2-三氟乙基)吡咯-3-甲酰胺的合成 将N-(2,2,2-三氟乙基)哌啶-3-甲酰胺盐酸盐(1.45g,6.23mmoL)加入到冰醋酸20mL、水5ml组成的混合溶剂中,降温至0℃,滴加亚硝酸钠(0.65g,9.35mmoL)配制的水溶液5ml,0℃下搅拌反应1h,升至室温反应2h。向反应液中加入水,用乙酸乙酯萃取三次,合并有机相,饱和食盐水洗涤,减压蒸干得淡黄色液体1.25g,直接投下一步反应,粗产品收率95%。 步骤5:1-氨基-N-(2,2,2-三氟乙基)吡咯-3-甲酰胺盐酸盐的合成 1-亚硝基-N-(2,2,2-三氟乙基)吡咯-3-甲酰胺(1.25g,5.90mmoL)溶于甲醇20mL中,加入Zn(1.15g,0.018moL),降温至-5℃,缓慢滴加冰醋酸(10mL),加毕,于0℃下搅拌0.5h,自然升温到室温反应2h。将反应液过滤,滤饼用甲醇冲洗,滤液减压蒸干,残留物加入50mL水,用碳酸钠调节溶液的pH至9,用DCM/MeOH(5:1)的混合溶剂萃取5次,合并有机相,用饱和食盐水洗涤一次后经无水硫酸钠干燥,过滤,浓缩得到淡黄色液体后加入盐酸乙酸乙酯溶液搅拌1h后使之成盐,旋干溶剂,得到1.50g淡黄色油状物,收率100%。 步骤6:4-(3-(2,2,2-三氟乙基氨基甲酰基)吡咯-1-氨基)-1H-7-氮杂吲哚-5甲酰胺的合成 4-(3-(2,2,2-三氟乙基氨基甲酰基)吡咯-1-氨基)-1H-7-氮杂吲哚-5甲酰胺的制备方法参考实施例2步骤(5)方法,将(S)-1-氨基-N-(2,2-二氟乙基)哌啶-3-甲酰胺盐酸盐替换为1-氨基-N-(2,2,2-三氟乙基)吡咯-3-甲酰胺盐酸盐制备得到。1H NMR(300MHz,DMSO-d6)δ11.40(br,1H),9.97(br,1H),8.62(br,1H),8.36(s,1H),7.77(br,1H),7.04(m,3H),3.95(m,2H),3.23–3.02(m,3H),2.69(m,2H),2.07(m,2H)。MS(ESI)m/z:371[M+H]+。
实施例10 4-((3-氧杂-8-氮杂二环[3.2.1]辛烷-8-基)氨基)-1H-7-氮杂吲哚-5-甲酰胺的合成 步骤1:8-亚硝基-3-氧杂-8-氮杂二环[3.2.1]辛烷的合成 室温下将3-氧杂-8-氮杂二环[3.2.1]辛烷盐酸盐(0.30g,2.00mmol)溶入到醋酸6mL中,0℃下缓慢加入溶有亚硝酸钠(0.21g,0.30mmol)的3mL水溶液。滴加完毕0℃下反应1小时并升至常温反应过夜。反应完毕向反应液中加入水15mL,乙酸乙酯15mL萃取3次。合并有机相,用饱和碳酸钠水溶液洗涤有机相,无水硫酸钠干燥,浓缩。硅胶柱层析(PE/EA),得黄色固体0.24g,收率85%。MS(ESI)m/z:143[M+H]+。
步骤2:3-氧杂-8-氮杂二环[3.2.1]辛烷-8-胺的合成 将8-亚硝基-3-氧杂-8-氮杂二环[3.2.1]辛烷(0.24g,1.69mmol)溶入到甲醇4mL中,室温下缓慢加入锌粉(0.33g,5.06mmol),氮气保护,降温至-20℃度搅拌10分钟。-20℃下缓慢滴加醋酸4mL,搅拌反应2小时。过滤反应液,滤液直接蒸干,硅胶柱层析(DCM/MeOH)得白色固油混合物0.20g,收率93%。MS(ESI)m/z:129[M+H]+。
步骤3:4-((3-氧杂-8-氮杂二环[3.2.1]辛烷-8-基)氨基)-1H-7-氮杂吲哚-5-甲酰胺的合成 4-((3-氧杂-8-氮杂二环[3.2.1]辛烷-8-基)氨基)-1H-7-氮杂吲哚-5-甲酰胺的制备方法参考实施例2步骤(5)方法,将(S)-1-氨基-N-(2,2-二氟乙基)哌啶-3-甲酰胺盐酸盐替换为3-氧杂-8-氮杂二环[3.2.1]辛烷-8-胺制备得到。 1H NMR(300MHz,DMSO-d6)δ11.41(br,1H),10.44(br,1H),8.38(s,1H),8.33(br,1H),7.23(br,1H),7.06(m,2H),3.77(d,J=10.7Hz,2H),3.57(d,J=10.6Hz,2H),3.27(m,2H),1.94(q,J=10.5,9.2Hz,4H)。MS(ESI)m/z:288[M+H]+。
实施例11 4-((3-羟基-8-氮杂二环[3.2.1]辛烷-8-基)氨基)-1H-7-氮杂吲哚-5-甲酰胺的合成 步骤1:(1R,3r,5S)-8-亚硝基-8-氮杂二环[3.2.1]辛烷-3-醇的合成 室温下将(1R,3r,5S)-8-氮杂二环[3.2.1]辛烷-3-醇盐酸(0.50g,3.94mmol)溶入到醋酸(10mL)中,0℃下缓慢加入溶有亚硝酸钠(0.54g,7.88mmol)的5mL水溶液。滴加完毕0℃下反应1小时并升至常温反应过夜。反应完毕向反应液中加入水(15mL)并用乙酸乙酯(15mL)萃取3次。合并有机相用饱和碳酸钠水溶液(20mL)洗涤有机相,并用无水硫酸钠干燥,浓缩有机相,硅胶柱层析(PE/EA),得黄色固体0.59g,收率96%。MS(ESI)m/z:157.1[M+H]+。
步骤2:(1R,3r,5S)-8-氨基-8-氮杂二环[3.2.1]辛烷-3-醇的合成 将(1R,3r,5S)-8-亚硝基-8-氮杂二环[3.2.1]辛烷-3-醇(0.51g,3.27mmol)溶入到甲醇(6mL)中,室温下缓慢加入锌粉(0.64g,9.81mmol)并在氮气保护下降温至-20℃度搅拌10分钟。-20℃缓慢滴加醋酸(8mL)并在氮气保护下0℃反应2小时终止。过滤反应液,滤液用碳酸钠调节pH至8,浓缩,硅胶柱层析(DCM/MeOH)得0.57g白色固油混合物,收率大于100%。MS(ESI)m/z:143.1[M+H]+。
步骤3:((3-羟基-8-氮杂二环[3.2.1]辛烷-8-基)氨基)-1H-7-氮杂吲哚-5-甲酰胺的合成 ((3-羟基-8-氮杂二环[3.2.1]辛烷-8-基)氨基)-1H-7-氮杂吲哚-5-甲酰胺的制备方法参考实施例2步骤(5)方法,将(S)-1-氨基-N-(2,2-二氟乙基)哌啶-3-甲酰胺盐酸盐替换为(1R,3r,5S)-8-氨基-8-氮杂二环[3.2.1]辛烷-3-醇制备得到。 1H NMR(400MHz,Methanol-d4)δ8.31(s,1H),7.71(br,1H),7.34(d,J=3.5Hz,1H),7.08(br,2H),3.40(t,J=3.6Hz,1H),2.37–2.31(m,2H),2.25–2.10(m,3H),2.05(dd,J=12.3,6.4Hz,1H),1.94(d,J=3.5Hz,1H),1.91(m,1H),1.61(t,J=13.1Hz,2H)。MS(ESI)m/z:302[M+H]+。
实施例12 4-(N-Boc-5-氨基-六氢吡咯并[3,4-c]吡咯-2(1H))-1H-7-氮杂吲哚-5-甲酰胺的合成 步骤1:N-Boc-5-亚硝基-六氢吡咯并[3,4-c]吡咯-2(1H)的合成 将N-Boc-六氢吡咯并[3,4-c]吡咯-2(1H)(2.12g,10mmoL)加入到冰醋酸20mL和水5ml组成的混合溶剂中,降温至0℃,滴加溶有亚硝酸钠(1.03g,15mmoL)的水溶液5ml,在0℃下搅拌1小时后自然升至室温反应2h。向反应液中加水,乙酸乙酯萃取三次,合并有机层,饱和食盐水洗涤,得白色固体2.41g,减压蒸干直接投下一步。 步骤2:N-Boc-5-氨基-六氢吡咯并[3,4-c]吡咯-2(1H)的合成 N-Boc-5-亚硝基-六氢吡咯并[3,4-c]吡咯-2(1H)(2.41g,10mmoL)溶于甲醇20mL中,加入Zn(1.95g,0.03moL),降温至-5℃,缓慢滴加冰醋酸10mL,加毕,0℃下搅拌0.5h,自然升温到室温反应2h。将反应液过滤,滤饼用甲醇冲洗,滤液减压蒸干,加入50mL水溶解后用碳酸钠,调节溶液的pH至9,用DCM/MeOH(5:1)混合溶剂萃取5次,合并有机相,饱和食盐水洗涤,无水硫酸钠干燥,蒸除溶剂,得白色固体1.76g,收率81.8%。 步骤3:4-(N-Boc-5-氨基-六氢吡咯并[3,4-c]吡咯-2(1H))-1H-7-氮杂吲哚-5-甲酰胺的合成 4-(N-Boc-5-氨基-六氢吡咯并[3,4-c]吡咯-2(1H))-1H-7-氮杂吲哚-5-甲酰胺的制备方法参考实施例2步骤(5)方法,将(S)-1-氨基-N-(2,2-二氟乙基)哌啶-3-甲酰胺盐酸盐替换为N-Boc-5-氨基-六氢吡咯并[3,4-c]吡咯-2(1H)制备得到。 1H NMR(400MHz,DMSO-d6)δ11.38(br,1H),9.86(br,1H),8.36(s,1H),7.78(br,1H),7.15–6.58(m,3H),3.57(m,2H),3.09(m,2H),2.88–2.51(m,4H),1.45(s,9H),1.18(m,1H),0.77(m,1H)。MS(ESI)m/z:387[M+H]+。
实施例13 4-(5-乙酰基六氢吡咯并[3,4-c]吡咯-2(1H))-1H-7-氮杂吲哚-5-甲酰胺的合成 步骤1:1-(5-亚硝基六氢吡咯并[3,4-c]吡咯-2(1H))乙酰的合成 将1-(六氢吡咯并[3,4-c]吡咯-2(1H))乙酰盐酸盐(1.50g,7.87mmoL)加入到冰醋酸20mL和水5ml组成的混合溶剂中,降温至0℃,滴加溶有亚硝酸钠(0.81g,11.80mmoL)的水溶液5ml,0℃下搅拌1h,自然升至室温反应2h。向反应液中加入水,乙酸乙酯萃取三次,合并有机相,饱和食盐水洗涤,减压蒸除溶剂得淡黄色液体1.44g,直接投下一步,收率100%。 步骤2:1-(5-氨基六氢吡咯并[3,4-c]吡咯-2(1H))乙酰盐酸盐的合成 1-(5-亚硝基六氢吡咯并[3,4-c]吡咯-2(1H))乙酰(1.44g,7.87mmoL)溶于甲醇20mL中,加入Zn粉(1.53g,0.023moL),降温至-5℃,缓慢滴加冰醋酸(10mL),加毕,0℃下搅拌0.5h,自然升温到室温反应2h。将反应液过滤,滤饼用甲醇冲洗,滤液减压蒸干,残留物加入50mL水溶解,碳酸钠调节溶液pH至9,用DCM/MeOH(5:1)的混合溶剂萃取5次,合并有机相,饱和食盐水洗涤,无水硫酸钠干燥,减压蒸除溶剂得淡黄色液体,加入盐酸乙酸乙酯溶液搅拌0.5h,使之成盐,蒸除溶剂,得到淡黄色油状物2.00g,粗品收率100%。 步骤3:4-(5-乙酰基六氢吡咯并[3,4-c]吡咯-2(1H))-1H-7-氮杂吲哚-5-甲酰胺的合成 4-(5-乙酰基六氢吡咯并[3,4-c]吡咯-2(1H))-1H-7-氮杂吲哚-5-甲酰胺的制备方法参考实施例2步骤(5)方法,将(S)-1-氨基-N-(2,2-二氟乙基)哌啶-3-甲酰胺盐酸盐替换为1-(5-氨基六氢吡咯并[3,4-c]吡咯-2(1H))乙酰盐酸盐制备得到。 1H NMR(400MHz,DMSO-d6)δ11.40(br,1H),9.85(br,1H),8.36(s,1H),7.88(br,1H),7.12(br,1H),7.03(br,1H),6.85(br,1H),3.67(m,2H),3.14–2.62(m,6H),2.00(s,3H),1.28(m,1H),0.86(m,1H)。MS(ESI)m/z:329[M+H]+。
实施例14 4-(1-酮-2,8-二氮杂螺[4.5]癸烷-8-氨基)-1H-7-氮杂吲哚-5-甲酰胺的合成 步骤1:8-亚硝基-2,8-二氮杂螺[4.5]癸烷-1-酮的合成 将2,8-二氮杂螺[4.5]癸烷-1-酮(2.08g,20mmoL)加入到冰醋酸20mL和水5ml组成的混合溶剂中,降温至0℃,滴加溶有亚硝酸钠(2.07g,30mmoL)的水溶液10ml,在0℃下搅拌1h,自然升至室温反应2h。向反应液中加入水,乙酸乙酯萃取三次,合并有机相, 饱和食盐水洗涤,减压蒸干得粗品2.47g,直接投下一步反应。 步骤2:8-氨基-2,8-二氮杂螺[4.5]癸烷-1-酮盐酸盐的合成 8-亚硝基-2,8-二氮杂螺[4.5]癸烷-1-酮(2.47g,20mmoL)溶于甲醇20mL中,加入Zn(3.90g,0.06moL),降温至-5℃,缓慢滴加冰醋酸10mL,加毕,于0℃下搅拌0.5h,自然升温到室温反应2h。将反应液过滤,滤饼用甲醇冲洗,滤液减压蒸干,加入盐酸乙醇溶液搅拌0.5h,减压蒸除溶剂后用乙酸乙酯打浆,过滤,滤饼烘干得到淡黄色固体2.12g,收率93%。 步骤3:4-(1-酮-2,8-二氮杂螺[4.5]癸烷-8-氨基)-1H-7-氮杂吲哚-5-甲酰胺的合成 4-(1-酮-2,8-二氮杂螺[4.5]癸烷-8-氨基)-1H-7-氮杂吲哚-5-甲酰胺的制备方法参考实施例2步骤(5)方法,将(S)-1-氨基-N-(2,2-二氟乙基)哌啶-3-甲酰胺盐酸盐替换为8-氨基-2,8-二氮杂螺[4.5]癸烷-1-酮盐酸盐制备得到。 1H NMR(400MHz,DMSO-d6)δ11.39(br,1H),9.92(br,1H),8.37(s,1H),7.64(br,2H),7.05(m,3H),3.53(m,2H),3.19(m,2H),3.05(m,2H),1.97(m,2H),1.91(m,2H),1.49(m,2H)。MS(ESI)m/z:329[M+H]+。
实施例15 4-(8-(环丙甲酰基)-3,8-二氮杂双环[3.2.1]辛烷-3-氨基)-1H-7-氮杂吲哚-5-甲酰胺的合成 步骤1:8-环丙甲酰基-(3-亚硝基3,8-二氮杂双环[3.2.1]辛烷的合成 室温下,将8-环丙甲酰基-3,8-二氮杂双环[3.2.1]辛烷盐酸盐(1.11g,5.00mmoL)加入到冰醋酸20mL和水5ml组成的混合溶液中,降温至0℃,滴加溶有亚硝酸钠(0.53g,7.68mmoL)的水溶液5ml,0℃下搅拌1h,自然升至室温反应2h。向反应液中加入水,乙酸 乙酯萃取三次,合并有机相,饱和食盐水洗涤,减压蒸除溶剂得到淡黄色液体1.04g,直接用于下一步反应。 步骤2:8-环丙甲酰基-(3-氨基-3,8-二氮杂双环[3.2.1]辛烷的合成 室温下,将8-环丙甲酰基-(3-亚硝基3,8-二氮杂双环[3.2.1]辛烷(1.04g,5.00mmoL)溶于甲醇20mL中,加入Zn粉(1.00g,15.00mmoL),降温至-5℃,缓慢滴加冰醋酸10mL,加毕,0℃下搅拌0.5h,自然升温到室温反应2h,将反应液过滤,滤饼用甲醇漂洗,收集滤液,减压蒸干后加入50mL水溶解,碳酸钠水溶液调节pH至9,DCM/MeOH(5:1)的混合溶剂萃取5次,合并有机相,饱和食盐水洗涤,无水硫酸钠干燥,减压蒸除溶剂得到淡黄色油状物0.98g。 步骤3:4-(8-(环丙甲酰基)-3,8-二氮杂双环[3.2.1]辛烷-3-氨基)-1H-7-氮杂吲哚-5-甲酰胺的合成 4-(8-(环丙甲酰基)-3,8-二氮杂双环[3.2.1]辛烷-3-氨基)-1H-7-氮杂吲哚-5-甲酰胺的制备方法参考实施例2步骤(5)方法,将(S)-1-氨基-N-(2,2-二氟乙基)哌啶-3-甲酰胺盐酸盐替换为8-环丙甲酰基-(3-氨基-3,8-二氮杂双环[3.2.1]辛烷制备得到。 1H NMR(400MHz,DMSO-d6)δ11.44(br,1H),10.47(br,1H),8.40(s,1H),7.83(br,1H),7.23(br,1H),7.10(m,2H),4.20(d,J=12.6Hz,1H),4.10(d,J=13.9Hz,1H),3.54(d,J=13.3Hz,1H),3.43(m,2H),2.98(d,J=13.7Hz,1H),1.96(m,3H),1.72(m,1H),1.58(m,1H),0.76(m,4H)。MS(ESI)m/z:355[M+H]+。
实施例16 4-(2-甲基-5-(2,2,2-三氟乙基氨基甲酰基)哌啶-1-氨基)-1H-7-氮杂吲哚-5甲酰胺的合成 步骤1:6-甲基-1-亚硝基-N-(2,2,2-三氟乙基)哌啶-3-甲酰胺的合成 将6-甲基-N-(2,2,2-三氟乙基)哌啶-3-甲酰胺(2.24g,10.00mmoL)加入到冰醋酸20mL 和水10ml成的混合溶剂中,降温至0℃后滴加溶有亚硝酸钠(1.03g,15.00mmoL)的水溶液10ml,0℃下搅拌1h,自然升至室温反应1h。向反应液中加入水,用DCM萃取三次,合并有机相,用饱和食盐水洗三次,减压蒸干得淡黄色固体2.53g,直接投下一步反应。 步骤2:6-甲基-1-氨基-N-(2,2,2-三氟乙基)哌啶-3-甲酰胺的合成 室温下,将6-甲基-1-亚硝基-N-(2,2,2-三氟乙基)哌啶-3-甲酰胺(2.53g,10.00mmoL)溶于甲醇20mL中,加入Zn粉(2.40g,40.00mmoL),降温至-5℃,缓慢滴加冰醋酸10mL,加毕,于0℃下搅拌0.5h,自然升温到室温反应2h,将反应液过滤,滤饼用甲醇冲洗,滤液减压蒸干,加入50mL水溶解后用碳酸钠调节溶液pH至9,用DCM/MeOH(5:1)的混合溶剂萃取5次,合并有机相,饱和食盐水洗涤,无水硫酸钠干燥,减压蒸干得到淡黄色油状物2.11g,收率88%。 步骤3:4-(2-甲基-5-(2,2,2-三氟乙基氨基甲酰基)哌啶-1-氨基)-1H-7-氮杂吲哚-5甲酰胺的合成 4-(2-甲基-5-(2,2,2-三氟乙基氨基甲酰基)哌啶-1-氨基)-1H-7-氮杂吲哚-5甲酰胺的制备方法参考实施例2步骤(5)方法,将(S)-1-氨基-N-(2,2-二氟乙基)哌啶-3-甲酰胺盐酸盐替换为6-甲基-1-氨基-N-(2,2,2-三氟乙基)哌啶-3-甲酰胺制备得到。 1H NMR(400MHz,Methanol-d4)δ8.34(s,1H),7.24(d,J=3.4Hz,1H),7.06(d,J=3.4Hz,1H),3.89(m,2H),3.28(m,1H),2.83(m,1H),2.66(m,1H),2.52(m,1H),2.29–2.00(m,1H),1.94(m,1H),1.60(m,2H),1.11(d,J=6.1Hz,3H)。MS(ESI)m/z:399[M+H]+。
实施例17 4-(8-(2,2,2-三氟乙基氨基甲酰基)-3,8-二氮杂双环[3.2.1]辛烷-3-氨基)-1H-7-氮杂吲哚-5-甲酰胺的合成 步骤1:3-亚硝基-N-(2,2,2-三氟乙基)-3,8-二氮杂双环[3.2.1]辛烷-8-甲酰胺的合成 将N-(2,2,2-三氟乙基)-3,8-二氮杂双环[3.2.1]辛烷-8-甲酰胺盐酸盐(3.51g,10.00mmoL)加入到冰醋酸40mL和水10ml组成的混合溶剂中,降温至0℃,滴加溶有亚硝酸钠(1.04g,15.00mmoL)的水溶液10ml,在0℃下搅拌1h,自然升至室温反应1h。向反应液中加入水,DCM萃取三次,合并有机相,饱和食盐水洗涤,减压蒸干得淡黄色固体2.66g,直接用于下一步反应。 步骤2:3-氨基-N-(2,2,2-三氟乙基)-3,8-二氮杂双环[3.2.1]辛烷-8-甲酰胺的合成 室温下,将3-亚硝基-N-(2,2,2-三氟乙基)-3,8-二氮杂双环[3.2.1]辛烷-8-甲酰胺(2.66g,10.00mmoL)溶于甲醇20mL中,加入Zn(2.64g,40.00mmoL),降温至-5℃,缓慢滴加冰醋酸(10mL),加毕,0℃下搅拌0.5h,自然升温到室温反应16h。将反应液过滤,滤饼用甲醇冲洗,滤液减压蒸干,加入水50mL溶解后用碳酸钠调节溶液pH至9,用DCM/MeOH(5:1)混合溶剂萃取5次,合并有机相,饱和食盐水洗涤,无水硫酸钠干燥,减压蒸干得到淡黄色油状物2.41g,收率95%。 步骤3:4-(8-(2,2,2-三氟乙基氨基甲酰基)-3,8-二氮杂双环[3.2.1]辛烷-3-氨基)-1H-7-氮杂吲哚-5-甲酰胺的合成 4-(8-(2,2,2-三氟乙基氨基甲酰基)-3,8-二氮杂双环[3.2.1]辛烷-3-氨基)-1H-7-氮杂吲哚-5-甲酰胺的制备方法参考实施例2步骤(5)方法,将(S)-1-氨基-N-(2,2-二氟乙基)哌啶-3-甲酰胺盐酸盐替换为3-氨基-N-(2,2,2-三氟乙基)-3,8-二氮杂双环[3.2.1]辛烷-8-甲酰胺制备得到。 1H NMR(400MHz,Methanol-d4)δ8.35(s,1H),7.38(d,J=3.5Hz,1H),7.10(d,J=3.5Hz,1H),3.92(m,2H),3.89–3.81(m,2H),3.51(m,2H),3.40(m,2H),2.21(m,2H),1.83(m,2H)。MS(ESI)m/z:412[M+H]+。
实施例18 4-(8-(2,2,2-三氟乙酰基)-3,8-二氮杂双环[3.2.1]辛烷-3-氨基)-1H-7-氮杂吲哚-5-甲酰胺的合成 步骤1:8-亚硝基-3,8-二氮杂双环[3.2.1]辛烷-3-甲酸叔丁酯的合成 将8-Boc-3,8-二氮杂双环[3.2.1]辛烷(1.06g,5.00mmoL)加入到冰醋酸20mL和水5ml组成的混合溶剂中,降温至0℃后滴加溶有亚硝酸钠(0.52g,15.00mmoL)的水溶液10ml,0℃下搅拌1h,自然升至室温反应2h。向反应液中加入水,乙酸乙酯萃取三次,合并有机相,用饱和食盐水洗涤,减压蒸干的粗品1.21g,直接投下一步。 步骤2:8-氨基-3,8-二氮杂双环[3.2.1]辛烷-3-甲酸叔丁酯的合成 将8-亚硝基-3,8-二氮杂双环[3.2.1]辛烷-3-甲酸叔丁酯(1.21g,5.00mmoL)溶于盛有甲醇20mL的四口瓶中,加入Zn粉(1.30g,20.00mmoL),降温至-5℃,缓慢滴加冰醋酸10mL,加毕,0℃下搅拌0.5h,自然升温到室温反应2h。将反应液过滤,滤饼用甲醇冲洗,滤液减压蒸除溶剂,得到淡黄色粘稠状液体1.14g,收率99%。 步骤3:4-(8-(2,2,2-三氟乙酰基)-3,8-二氮杂双环[3.2.1]辛烷-3-氨基)-1H-7-氮杂吲哚-5-甲酰胺的合成 参考实施例1步骤7方法,将实施例1步骤7中的(S)-1-氨基哌啶-3-甲酸乙酯盐酸盐替换为8-氨基-3,8-二氮杂双环[3.2.1]辛烷-3-甲酸叔丁酯,然后经过脱boc保护、酰化得到4-(8-(2,2,2-三氟乙酰基)-3,8-二氮杂双环[3.2.1]辛烷-3-氨基)-1H-7-氮杂吲哚-5-甲酰胺。 1H NMR(400MHz,Methanol-d4)δ8.53(s,1H),7.38(d,J=3.5Hz,1H),7.32(d,J=1.8Hz,1H),4.25(m,2H),3.42(m,2H),3.14(m,2H),2.47(m,2H),2.30(m,2H)。MS(ESI)m/z:383[M+H]+。
实施例19 4-(4-(2,2,2-三氟乙基氨基甲酰基)哌啶-1-氨基)-1H-7-氮杂吲哚-5甲酰胺的合成 步骤1:1-亚硝基-N-(2,2,2-三氟乙基)哌啶-4-甲酰胺的合成 将N-(2,2,2-三氟乙基)哌啶-4-甲酰胺盐酸盐(2.10g,10.00mmoL)加入到冰醋酸20mL和水5ml组成的混合溶剂中,降温至0℃后滴加溶有亚硝酸钠(1.04g,15.00mmoL)的水溶液5ml,0℃下搅拌1h,自然升至室温反应2h。向反应液中加入水,乙酸乙酯萃取三次,合并有机相,饱和食盐水洗涤,减压蒸干得淡黄色固体2.39g,直接投下一步反应。 步骤2:1-氨基-N-(2,2,2-三氟乙基)哌啶-4-甲酰胺盐酸盐的合成 将1-亚硝基-N-(2,2,2-三氟乙基)哌啶-4-甲酰胺(2.39g,10.00mmoL)溶于甲醇20mL中,加入Zn粉(2.64g,40.00mmoL),降温至-5℃,缓慢滴加冰醋酸10mL,加毕,于0℃下搅拌0.5小时后,自然升温到室温反应2h。将反应液过滤,滤饼用甲醇冲洗,滤液减压蒸干,残留物加入10mL的盐酸乙醇溶液,搅拌10min后减压蒸干得淡黄色粘稠状液体2.61g,收率100%。 步骤3:4-(4-(2,2,2-三氟乙基氨基甲酰基)哌啶-1-氨基)-1H-7-氮杂吲哚-5甲酰胺的合成 4-(4-(2,2,2-三氟乙基氨基甲酰基)哌啶-1-氨基)-1H-7-氮杂吲哚-5甲酰胺的制备方法参考实施例2步骤(5)方法,将(S)-1-氨基-N-(2,2-二氟乙基)哌啶-3-甲酰胺盐酸盐替换为1-氨基-N-(2,2,2-三氟乙基)哌啶-4-甲酰胺盐酸盐制备得到。 1H NMR(400MHz,DMSO-d6)δ11.41(br,1H),9.95(br,1H),8.59(br,1H),8.37(s,1H),7.83(br,1H),7.08-7.03(m,3H),3.88(br,2H),3.10(m,2H),2.71(m,1H),2.42(m,2H),1.80(m,2H),1.69(m,1H),1.36(m,1H)。MS(ESI)m/z:385[M+H]+。
实施例20 (S)-4-(3-(3,3-二氟环丁基氨基甲酰基)哌啶-1-氨基)-1H-7-氮杂吲哚-5-甲酰胺的合成 步骤1:(S)-N-(3,3-二氟环丁基)-1-亚硝基哌啶-3-甲酰胺的合成 将(S)-N-(3,3-二氟环丁基)哌啶-3-甲酰胺盐酸盐(2.18g,10.00mmoL)加入到冰醋酸20mL和水5ml组成的混合溶剂中,降温至0℃后滴加溶有亚硝酸钠(1.04g,15.00mmoL)的水溶液5ml,在0℃下搅拌1h后自然升至室温反应2h。向反应液中加入水,乙酸乙酯萃取三次,合并有机相,饱和食盐水洗涤,减压蒸干得淡黄色固体2.47g,直接投下一步反应,收率100%。 步骤2:(S)-N-(3,3-二氟环丁基)-1-亚硝基哌啶-3-甲酰胺盐酸盐的合成 将1-亚硝基-N-(2,2,2-三氟乙基)哌啶-4-甲酰胺(2.47g,10.00mmoL)溶于甲醇20mL中,加入Zn粉(2.64g,40.00mmoL),降温至-5℃,缓慢滴加冰醋酸10mL,加毕,0℃下搅拌0.5h,自然升温到室温反应2h。将反应液过滤,滤饼用甲醇冲洗,滤液减压蒸干,残留物加入10mL盐酸乙醇溶液搅拌10min,减压蒸干得到淡黄色粘稠液体2.69g,收率100%。 步骤3:(S)-4-(3-(3,3-二氟环丁基氨基甲酰基)哌啶-1-氨基)-1H-7-氮杂吲哚-5-甲酰胺的合成 (S)-4-(3-(3,3-二氟环丁基氨基甲酰基)哌啶-1-氨基)-1H-7-氮杂吲哚-5-甲酰胺的制备方法参考实施例2步骤(5)方法,将(S)-1-氨基-N-(2,2-二氟乙基)哌啶-3-甲酰胺盐酸盐替换为(S)-N-(3,3-二氟环丁基)-1-亚硝基哌啶-3-甲酰胺盐酸盐制备得到。 1H NMR(400MHz,Methanol-d4)δ8.32(s,1H),7.18(br,1H),7.07(d,J=2.4Hz,1H),4.12(m,1H),2.90(m,2H),2.74(m,1H),2.54(m,4H),2.22(t,J=7.3Hz,1H),2.06(m,1H),1.86(m,3H),1.62(m,1H)。MS(ESI)m/z:393[M+H]+。
实施例21 (S)-1-(5-氰基-1H-7-氮杂吲哚-4-氨基)哌啶-3-甲酸乙酯的合成 步骤1:4-氯-1-(三异丙基甲硅烷基)-1H-吡咯并[2,3-b]吡啶-5-甲腈的合成 氮气保护下将4-氯-1H-吡咯并[2,3-b]吡啶-5-甲腈(1.00g,5.60mmol)溶入到DMF(10mL)中,0℃加入NaH(0.27g,11.20mmol)搅拌反应20min。滴加三异丙基氯硅烷(1.60g,8.40mmol,TIPSCl),升至室温反应16h终止。加水稀释,EA萃取,合并、干燥,浓缩有机相。柱层析纯化(EA/PE体系)得白色固体1.77g,收率95%。 步骤2:(S)-1-(5-氰基-1H-7-氮杂吲哚-4-氨基)哌啶-3-甲酸乙酯的合成 将4-氯-1-(三异丙基甲硅烷基)-1H-吡咯并[2,3-b]吡啶-5-甲腈(0.90g,2.69mmol)溶入到1,4-二氧六环(15mL)中,室温下缓慢加三乙胺(0.68g,6.72mmol)、(S)-1-氨基哌啶-3-甲酸乙酯盐酸(0.73g,3.50mmol),氮气保护下升温至100℃,反应24h。浓缩反应液,柱层析纯化(正向柱EA/PE体系;反向柱H2O(0.1%TFA)/MeCN体系)得淡黄色固体0.03g。
1H NMR(300MHz,DMSO-d6)δ11.75(br,1H),8.62(br,1H),8.06(s,1H),7.20(br,1H),6.76(br,1H),4.08(q,J=6.0Hz,2H),3.21(m,1H),3.05(m,1H),2.81(m,1H),2.66(m,2H),1.99(m,1H),1.75(m,2H),1.32(m,1H),1.17(t,J=7.0Hz,3H)。MS(ESI)m/z:314[M+H]+。
实施例22 (S)-4-((3-((2,2-二氟乙基)氨基甲酰)哌啶-1-基)氨基)-N-甲基-1H-吡咯并[2,3-b]吡啶-5-甲酰胺的合成 (S)-4-((3-((2,2-二氟乙基)氨基甲酰)哌啶-1-基)氨基)-N-甲基-1H-吡咯并[2,3-b]吡啶-5-甲酰胺的合成参考实施例1化合物、实施例2化合物的制备方法,将实施例1步骤4中的氨水溶液替换为甲胺溶液,实施例2步骤5中的4-氯-7-氮杂吲哚-5-甲酰胺替换为4-氯-N-甲基-1H- 吡咯并[2,3-b]吡啶-5-甲酰胺制备得到。 1H NMR(400MHz,DMSO-d6)δ11.48(br,1H),9.74(br,1H),8.31(br,3H),7.06(d,J=38.4Hz,2H),5.97(t,J=56.0Hz,1H),3.56–3.40(m,2H),3.18–3.06(m,2H),2.75(d,J=4.2Hz,3H),2.68(t,J=10.9Hz,1H),2.48–2.30(m,2H),1.80(d,J=12.4Hz,2H),1.73–1.61(m,1H),1.35(m,1H);MS(ESI)m/z:381[M+H]+。
实施例23 (S)-4-((3-((2,2,2-三氟乙基)氨基甲酰)哌啶-1-基)氨基)-1H-吡咯并[2,3-b]吡啶-5-羧酸乙酯的合成 (S)-4-((3-((2,2,2-三氟乙基)氨基甲酰)哌啶-1-基)氨基)-1H-吡咯并[2,3-b]吡啶-5-羧酸乙酯的合成参考实施例1、实施例22化合物的制备方法,将实施例1步骤4中的氨水溶液替换为甲胺溶液制备得到。 1H NMR(400MHz,DMSO-d6)δ12.49(br,1H),10.53(br,1H),8.73(br,1H),8.63(br,1H),8.40(br,1H),7.33(br,1H),7.21(br,1H),3.89(dd,J=10.0,6.7Hz,2H),3.11(dd,J=24.0,9.1Hz,2H),2.80(s,3H),2.67(m,3H),1.85(m,2H),1.69(m,1H),1.38(m,1H);MS(ESI)m/z:399[M+H]+。 实施例24 激酶活性测试 本试验采用γ试33p-ATP同位素测试法测试化合物对激酶JAK1,JAK2,JAK3,TYK2的抑制作用,并得出化合物对该酶抑制活性的半数抑制浓度IC50。
托法替尼(也称托伐替尼,Tofacitinib)参考WO2014195978A2专利方法制备,江苏威凯尔医药科技有限公司,生产批号:321-1-1688-37C。 1.基础反应缓冲液 20mM 4-羟乙基哌嗪乙磺酸缓冲液(Hepes,pH 7.5),10mM氯化镁(MgCl2),1mM乙二醇二乙醚二胺四乙酸(EGTA),0.02%十二烷基聚乙二醇醚(Brij35),0.02mg/ml牛血清白蛋白(BSA),0.1mM钒酸钠(Na3VO4),2mM二硫苏糖醇(DTT),1%二甲亚砜(DMSO)。
2.化合物配制 化合物采用100%DMSO溶解至特定的浓度,之后采用自动加样装置梯度稀释成不同浓度的待测样品(DMSO溶解液)。 3.反应步骤 3.1使用基础反应缓冲液稀释反应底物; 3.2将激酶加入底物溶液中,轻柔混匀; 3.3采用自动加样系统将100%DMSO稀释的不同浓度化合物加入激酶溶液中,室温下孵育20min; 3.4室温下加入33P-ATP(10μM,10μCi/μl)启动激酶反应,反应2h。
4.检测 反应液经离子交换过滤系统除去未反应的ATP及反应产生的ADP等离子后检测底物中33P同位素放射量。
5.数据处理 依据放射量计算加入不同浓度抑制剂体系中的激酶活性从而得到不同浓度化合物对激酶活性的抑制作用,采用graphpad prism拟合得化合物抑制IC50。
本发明化合物的生物化学活性通过以上的试验进行测定,测得的IC50值,具体见表1。
表1 注:“-”代表未测试。 参考WO2016116025A1专利实施例12、实施例13方法制备化合物WX14、WX15,其结构如下: 结论:本发明实施例1、实施例2、实施例3、实施例7、实施例9和实施例23化合物对照阳性药Tofacitinib有更好的JAK1激酶抑制活性,大部分化合物抑制JAK1相对JAK2、JAK3激酶的选择性更强,因此有更好的安全性预期。本发明化合物对TYK2也有显著的抑制活性,具有相应的抗炎活性。 实施例25 肝微粒体测试 孵育体系总体积为250μL,用50mmol/L PBS缓冲液(pH=7.4)配制其中含有蛋白浓度为0.5mg/mL的人源肝微粒体孵育液,孵育开始前将100μmol/L待测化合物2.5μL与上述孵育液197.5μL混合,在37℃水浴中预孵育5min后加入同样经预孵育5min的还原性辅酶Ⅱ溶液(5mmol/L)50μL启动反应,(反应体系中种属肝微粒体蛋白含量为0.5g/L、待测化合 物终浓度为1μmol/L),在37℃水浴中振荡孵育,并分别于0,5,15,30,60min取出,立即加入内标为Terfenadine(正离子内标,25ng/mL)和Tolbutamide(负离子内标,50ng/mL)的正负内标混合甲醇溶液600μL以终止反应。将终止后的孵育液振荡2min、离心(4℃、16000r/min)10min后取上清液进行LC-MS/MS检测,定量分析母药的剩余量。(DMSO=0.1%) 将孵育0min化合物的浓度作为100%,其他孵育时间点的浓度转换为百分剩余量,将各时间点的百分剩余量的自然对数对孵育时间作线性回归,求算得斜率k,根据公式,T1/2=-0.693/k计算得到体外半衰期。肝微粒体中的清除率(CLint(μL/min/mg protein)=Ln(2)*1000/T1/2(min)/Protein Conc(mg/ml))。
表2 结论:本发明实施例1、实施例2化合物具有优良的肝脏代谢稳定性,特别是实施例2化合物肝微粒体代谢半衰期显著优于阳性药物Tofacitinib,具有更好的体内代谢稳定性。 实施例26 DSS诱导小鼠溃疡性结肠炎模型治疗活性测试 将6-7周龄小鼠随机分组,每组6只老鼠。阴性对照组小鼠自由饮用纯净水,其他组别小鼠小鼠自由饮用2%葡聚糖硫酸钠(DSS)溶液,连续7天;造模的同时依据分组给予药物治疗,每天1次,持续7天(可根据具体情况调整治疗组别及老鼠只数)。此后8-10天,将含DSS的水换为纯净水,小鼠自由饮用。继续照常给药3天。 从给药第一天起,每天分别观察小鼠精神状态、进食、饮水及活动等一般情况,每日称量老鼠体重,收集动物粪便评价性状并进行隐血检测。综合得到实验动物1-10天的疾病活动指数(Disease active index,DAI)。 表3 DAI评分标准 按照上述标准进行评分。将体重下降、大便性状和隐血情况的评分相加,得出每只小鼠的疾病活动指数(Disease activity index,DAI),以评估疾病的活动情况。DAI=(体重下降分值+粪便性状分值+便血分值)/3,分值范围为0-4分。 实验数据采用统计学处理,数据均用mean±SD或mean±SME表示,采用SPSS13.0软件进行统计学分析,各组间的差异比较用t检验(方差齐)或者t'检验(方差不齐),设α=0.05,P<0.05为差异有统计学意义。 DAI评分结果:实施例1(5mg/kg组,第8天DIA评分2.8;15mg/kg组,第8天DIA评分2)、实施例2(5mg/kg组,第8天DIA评分1.5)化合物在小鼠DSS模型上显示出明确的疗效,与阳性药物美沙拉嗪(5ASA)(100mg/kg组,第8天DIA评分3.5)、托法替尼(5mg/kg组,第8天DIA评分3.5)相比疗效更强。 结论:本发明实施例1、实施例2化合物在较低剂量下即显示出显著的抑制DSS诱导的小鼠肠炎作用,同剂量下药效强于阳性对照药托法替尼。 实施例27 DNBS(2,4-二硝基苯磺酸)诱导大鼠克罗恩病模型评价治疗活性测试 将4-5周龄雄性wistar大鼠适应性喂养5天,在实验前两天随机分为6组: 空白对照组:G1(Normal),选取正常大鼠4只给予30%乙醇,10mL/kg。 模型组:向大鼠肠道内灌注0.5mL浓度为50mg/mL DNBS(DNBS溶解于30%乙醇中)诱导大鼠肠炎,共40只,选取其中8只作为模型组G2(Model),其余32只大鼠给药。 给药组:对DNBS诱导肠炎的大鼠分别给予ABT494和实施例2化合物,分为G3~G6组,每组8只,G3:ABT494 10mg/kg-QD,G4:实施例2 0.3mg/kg-BID,G5:实施例2 1mg/kg-BID,G6:实施例2 3mg/kg-BID。 大鼠禁食不禁水48h,5%的葡萄糖盐溶液(10mL/kg)作为实验动物在禁食期间的能量补充剂,每天一次。实验造模当天,禁食大鼠用舒泰(25mg/kg)麻醉之后从大鼠肛门至结肠左曲(至肛门约8cm)处注入0.5mL,50mg/mL的DNBS来诱导大鼠肠炎。大鼠均保持头朝下姿势15min直至其苏醒,以防止DNBS倒流。从实验造模当天开始给予药物治疗7天。 阳性药ABT494购于南京新酶合医药科技有限公司,批号NNES190329,其结构如下: 自DNBS造模后,每天测量记录动物的体重,并对动物的日常活动进行观察,记录异常情况。实验过程中,每天对大鼠粪便状态进行评分。在第7天用异氟烷(3-5%)麻醉,经眼眶取血,分离血清后-80℃保存。所有动物采用吸入过量CO2窒息后脱颈锥的方式安乐死。剪开腹腔,取出结直肠,纵向剖开,对结直肠内的粪便性状进行评分。用冰PBS冲洗干净结直肠后观察溃疡面,记录肠的长度、重量以及溃疡面积,计算其重量长度比值(结肠重量(g)/长度(cm)比值×100),并整体拍照。所有肠组织纵向一分为二,一份4%中性PFA固定及石蜡包埋,剩余结肠样本-80℃冻存。
采用Excel、Graphpad软件进行统计分析。结果以mean±SD表示。组间比较采用双尾数T检验,*p<0.05为药物治疗组与模型组比较有显著性统计学差异,**p<0.01为药物治疗组与模型组比较有极显著性统计学差异;#p<0.05为模型组与正常组比较有显著性统计学差异,##p<0.01为模型组与正常组比较有极显著性统计学差异。
化合物对大鼠DNBS诱导性克罗恩病模型结肠重量/长度比的影响结果见图25,结肠图片见图27~图33,其中G3:ABT494 10mg/kg-QD,G4:实施例2 0.3mg/kg-BID,G5:实施例2 1mg/kg-BID,G6:实施例2 3mg/kg-BID药物治疗组结肠重量长度比值分别为13.4±5.2、10.5±3.9、10.0±1.9、10.5±2.0均低于模型组G2结肠重量长度比值(14.6±5.1),其中G5实施例2 1mg/kg-BID组与模型组G2比较具有显著性差异(*P<0.05)。 化合物对大鼠DNBS诱导性克罗恩病模型结肠溃疡面积的影响见图26,其中G3ABT494 10mg/kg-QD、G4实施例2 0.3mg/kg-BID、G5实施例2 1mg/kg-BID、G6实施例23mg/kg-BID药物治疗组老鼠结肠溃疡面积分别为1.37±1.72、0.83±1.00、0.65±1.05、0.76±1.21,均低于模型组G2(1.54±2.00)。 结论:本发明实施例2化合物在较低剂量下显示出显著的抑制DNBS诱导的大鼠肠炎作用。 A 7-azaindole derivative having the structure of formula (I), a pharmaceutical composition containing the compound of formula (I), and uses of the compound in preparing a medicament for preventing or treating Janus kinase (JAK) family-related diseases, specifically, uses in preventing or treating inflammatory diseases related to protein tyrosine kinase. 如下式(I)所示的化合物、其立体异构体或其药学上可接受的盐: 其中,环A选自任选被取代的4~12元杂环基或5~10元杂芳基; R1选自H、羟基、任选被取代的C1-C8烷基、C3-C8环烷基、C2-C8烯基、C2-C8炔基、4~12元杂环基、6~10元芳基或5~10元杂芳基;
R2选自氰基、-C=ONR6R7、-C=ONR6NR7R8、-C=ONHOR6、-S(O)mR8、-S(O)m-NHR8或-C=OOR6;
L选自氨基、-NR6C=O-、-NR6C=ONR10-、-C=ONR10-、-C=ONR6O-、-C=ONR6NR10-、-NR6S(O)m-、-S(O)mNR6-、-NR6S(O)mNR7-、-S(O)m-、-C=O-或-C=OO-;
或者,L不存在; R3选自H、任选被取代的C1-C8烷基、C3-C8环烷基或-C=OR6;
R4和R5各自独立地选自H、氘、卤素、氰基、硝基、任选被取代的C1-C8烷基或C3-C8环烷基、6~10元芳基或5~10元杂芳基;
R6、R7和R10各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
或者,R10与其相连的N及R1可形成一个任选被取代的4~12元杂环基;
其中,所述的环A和R1中取代基团各自独立地选自一个或多个卤素、羟基、氰基、氨基、巯基、硝基、C1-C8烷基、C1-C8烷氧基、C3-C8环烷基、4~12元杂环基、6~10元芳基、5~10元杂芳基、-(CH2)nC=OOR8、-OC=OR8、-C=OR8、-C=ONR8R9、-NHC=OR8、-NR8R9、-OC=ONR8R9、-NHC=ONR8R9、-S(O)mR8、-S(O)m-NHR8、-NHC=OOR8或-NHS(O)mR8;
m选自1或2; n选自1、2、3、4或5; R8和R9各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
所述的R3、R4、R5、R6、R7、R8、R9和R10中取代基团各自独立地选自一个或多个氘、卤素、羟基、氰基、氨基、巯基、硝基、C1-C8烷基、C1-C8烷氧基或C3-C8环烷基。
根据权利要求1所述的化合物,其特征在于: 环A选自任选被取代的4~12元杂环基; R1选自H、羟基、任选被取代的C1-C8烷基、C3-C8环烷基、C2-C8烯基、C2-C8炔基、4~12元杂环基、6~10元芳基或5~10元杂芳基;
R2选自氰基或-C=ONR6R7;
L选自氨基、-NR6C=O-、-NR6C=ONR10-、-C=ONR10-、-C=ONR6O-、-C=ONR6NR10-、-NR6S(O)m-、-S(O)mNR6-、-NR6S(O)mNR7-、-S(O)m-、-C=O-或-C=OO-;
或者,L不存在; R3选自H、任选被取代的C1-C8烷基、C3-C8环烷基或-C=OR6;
R4和R5各自独立地选自H、氘、卤素、氰基、硝基、任选被取代的C1-C8烷基或C3-C8环烷基;
R6、R7和R10各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
或者,R10与其相连的N及R1可形成一个任选被取代4~12元杂环基;
其中,所述的环A和R1中取代基团各自独立地选自一个或多个卤素、羟基、氰基、氨基、C1-C8烷基、C1-C8烷氧基、C3-C8环烷基、4~12元杂环基、6~10元芳基、5~10元杂芳基、-C=ONR8R9、-NHC=OR8、-NR8R9、-OC=ONR8R9、-NHC=ONR8R9、-S(O)mR8、-S(O)m-NHR8、-NHC=OOR8或-NHS(O)mR8;
m选自1或2; R8和R9各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
所述的R3、R4、R5、R6、R7、R8、R9和R10中取代基团各自独立地选自一个或多个氘、卤素、羟基、氰基、氨基、C1-C8烷基、C1-C8烷氧基或C3-C8环烷基。
根据权利要求1或2所述的化合物,其特征在于: 环A选自任选被取代的4~12元杂环基; R1选自H、羟基、任选被取代的C1-C8烷基、C3-C8环烷基、C2-C8烯基、C2-C8炔基、4~12元杂环基、6~10元芳基或5~10元杂芳基;
R2选自氰基或-C=ONR6R7;
L选自氨基、-NR6C=O-、-NR6C=ONR10-、-C=ONR10-、-C=ONR6O-、-C=ONR6NR10-、-NR6S(O)m-、-S(O)mNR6-、-NR6S(O)mNR7-、-S(O)m-、-C=O-或-C=OO-;
或者,L不存在; R3选自H或甲基;
R4和R5各自独立地选自H、氘、卤素、氰基、硝基、任选被取代的C1-C8烷基或C3-C8环烷基;
R6、R7和R10各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
或者,R10与其相连的N及R1可形成一个任选被取代4~12元杂环基;
其中,所述的环A和R1中取代基团各自独立地选自一个或多个卤素、羟基、氰基、氨基、C1-C8烷基、C1-C8烷氧基、C3-C8环烷基、4~12元杂环基、6~10元芳基、5~10元杂芳基、-C=ONR8R9、-NHC=OR8、-NR8R9、-OC=ONR8R9、-NHC=ONR8R9、-S(O)mR8、-S(O)m-NHR8、-NHC=OOR8或-NHS(O)mR8;
m选自1或2; R8和R9各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
所述的R4、R5、R6、R7、R8、R9和R10中取代基团各自独立地选自一个或多个氘、卤素、羟基、氰基、氨基、C1-C8烷基、C1-C8烷氧基或C3-C8环烷基。
如权利要求3所述的化合物,其特征在于: 环A选自任选被取代的下列基团: R1选自H、羟基、任选被取代的C1-C8烷基、C3-C8环烷基、4~12元杂环基、6~10元芳基或5~10元杂芳基;
R2选自氰基或-C=ONR6R7;
L选自氨基、-NR6C=O-、-NR6C=ONR10-、-C=ONR10-、-C=ONR6O-、-C=ONR6NR10-、-NR6S(O)m-、-S(O)mNR6-、-NR6S(O)mNR7-、-S(O)m-、-C=O-或-C=OO-;
或者,L不存在; R3选自H或甲基;
R4和R5各自独立地选自H、氘、卤素、氰基、硝基、任选被取代的C1-C8烷基或C3-C8环烷基;
R6、R7和R10各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
或者,R10与其相连的N及R1可形成一个任选被取代4~12元杂环基;
其中,所述的环A和R1中取代基团各自独立地选自一个或多个卤素、羟基、氰基、氨基、C1-C8烷基、C1-C8烷氧基、C3-C8环烷基、4~12元杂环基、6~10元芳基、5~10元杂芳基、-C=ONR8R9、-NHC=OR8、-NR8R9、-OC=ONR8R9、-NHC=ONR8R9、-S(O)mR8、-S(O)m-NHR8、-NHC=OOR8或-NHS(O)mR8;
m选自1或2; R8和R9各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
所述的R4、R5、R6、R7、R8、R9和R10中取代基团各自独立地选自一个或多个氘、卤素、羟基、氰基、氨基、C1-C8烷基、C1-C8烷氧基或C3-C8环烷基。
如权利要求4所述的化合物,其特征在于: 环A选自任选被取代的下列基团: R1选自H、羟基、任选被取代的甲基、乙基、丙基、环丙基、正丁基、叔丁基、环丁基、苯基、吡啶基、咪唑基、吡唑基、噁唑基、噻唑基或
R2选自氰基或-C=ONR6R7;
L选自氨基、-NR6C=O-、-NR6C=ONR10-、-C=ONR10-、-C=ONR6O-、-C=ONR6NR10-、-NR6S(O)m-、-S(O)mNR6-、-NR6S(O)mNR7-、-S(O)m-、-C=O-或-C=OO-;
或者,L不存在; R3选自H或甲基;
R4和R5各自独立地选自H、氘、卤素或氰基;
R6、R7和R10各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
或者,R10与其相连的N及R1可形成一个任选被取代4~12元杂环基;
m选自1或2; 其中,所述的环A和R1中取代基团各自独立地选自一个或多个卤素、羟基、氰基、氨基、C1-C8烷基、C1-C8烷氧基、C3-C8环烷基、4~12元杂环基、6~10元芳基或5~10元杂芳基;
所述的R6、R7和R10中取代基团各自独立地选自一个或多个氘、卤素、羟基、氰基、氨基、C1-C8烷基、C1-C8烷氧基或C3-C8环烷基。
如权利要求5所述的化合物,其特征在于: 环A选自任选被取代的下列基团: R1选自H、羟基、任选被取代的甲基、乙基、丙基、环丙基、正丁基、叔丁基、环丁基、苯基、吡啶基、咪唑基、吡唑基、噁唑基、噻唑基或
R2选自氰基或-C=ONR6R7;
L选自氨基、-NR6C=O-、-C=ONR10-、-S(O)m-、-C=O-或-C=OO-;
或者,L不存在; R3选自H或甲基;
R4和R5各自独立地选自H、氘、F、Cl或氰基;
R6、R7和R10各自独立地选自H、任选被取代的C1-C8烷基或C3-C8环烷基;
或者,R10与其相连的N及R1可形成一个任选被取代4~12元杂环基;
m选自1或2; 其中,所述的环A和R1中取代基团各自独立地选自一个或多个卤素、羟基、氰基、氨基、C1-C4烷基或C1-C4烷氧基;
所述的R6、R7和R10中取代基团各自独立地选自一个或多个氘、卤素、羟基、氰基或氨基。
如权利要求6所述的化合物,其特征在于: 环A选自任选被取代的下列基团: R1选自H、羟基、任选被取代的甲基、乙基、丙基、环丙基、叔丁基、环丁基或
R2选自氰基或-C=ONR6R7;
R6和R7各自独立地选自H、甲基或氘代甲基;
L选自-C=ONR10-、-S(O)m-、-C=O-或-C=OO-;
或者,L不存在; R3选自H或甲基;
R4和R5各自独立选自H或氘;
R10为H;
m选自1或2; 其中,所述的环A和R1中取代基团各自独立地选自一个或多个F、Cl、羟基、氰基、氨基、甲基或甲氧基。
化合物、其立体异构体或其药学上可接受盐,其特征在于,选自如下结构的化合物: 化合物、其立体异构体或其药学上可接受盐,其特征在于,选自如下结构的化合物: 一种药物组合物,其包含如权利要求1~9任一项所述的化合物、其立体异构体或其药学上可接受盐和可药用的载体。 根据权利要求10所述的药物组合物,其特征在于,所述药物组合物选自胶囊剂、散剂、片剂、颗粒剂、丸剂、注射剂、糖浆剂、口服液、吸入剂、软膏剂、栓剂或贴剂。 根据权利要求1-9中任一项所述的化合物、其立体异构体或其药学上可接受盐,或根据权利要求11所述的药物组合物在制备用于预防或治疗由两面神激酶JAK家族介导的疾病的药物中的应用。 根据权利要求12的应用,所述疾病包括免疫系统的疾病、自身免疫性疾病、皮肤病、变应性疾病、病毒性疾病、I型糖尿病与糖尿病并发症、阿尔茨海默病、干眼病、骨髓纤维化、 血小板增多症、红细胞增多症、白血病和癌症,所述的免疫系统疾病为器官移植排斥,如异体抑制排斥或移植物抗宿主疾病;所述的自身免疫性疾病选自系统性红斑狼疮、多发性硬化、类风湿性关节炎、青少年关节炎、银屑病、溃疡性结肠炎、克罗恩氏病或自体免疫性甲状腺疾病;所述的皮肤病选自牛皮癣、皮疹、斑秃或特应性皮炎;所述的变应性疾病选自哮喘或鼻炎;所述的病毒性疾病选自乙型肝炎、丙型肝炎、水痘、带状疱疹病毒;所述的癌症选自实体瘤、血液癌或皮肤癌,所述的实体瘤选自前列腺癌、肾癌、肝癌、胰腺癌、胃癌、乳腺癌、肺癌、头颈部癌、甲状腺癌、胶质母细胞瘤或黑素瘤,所述的血液癌选自淋巴瘤或白血病,所述的皮肤癌选自皮肤T-细胞淋巴瘤或皮肤B-细胞淋巴瘤。技术领域
背景技术
附图说明
具体实施方式