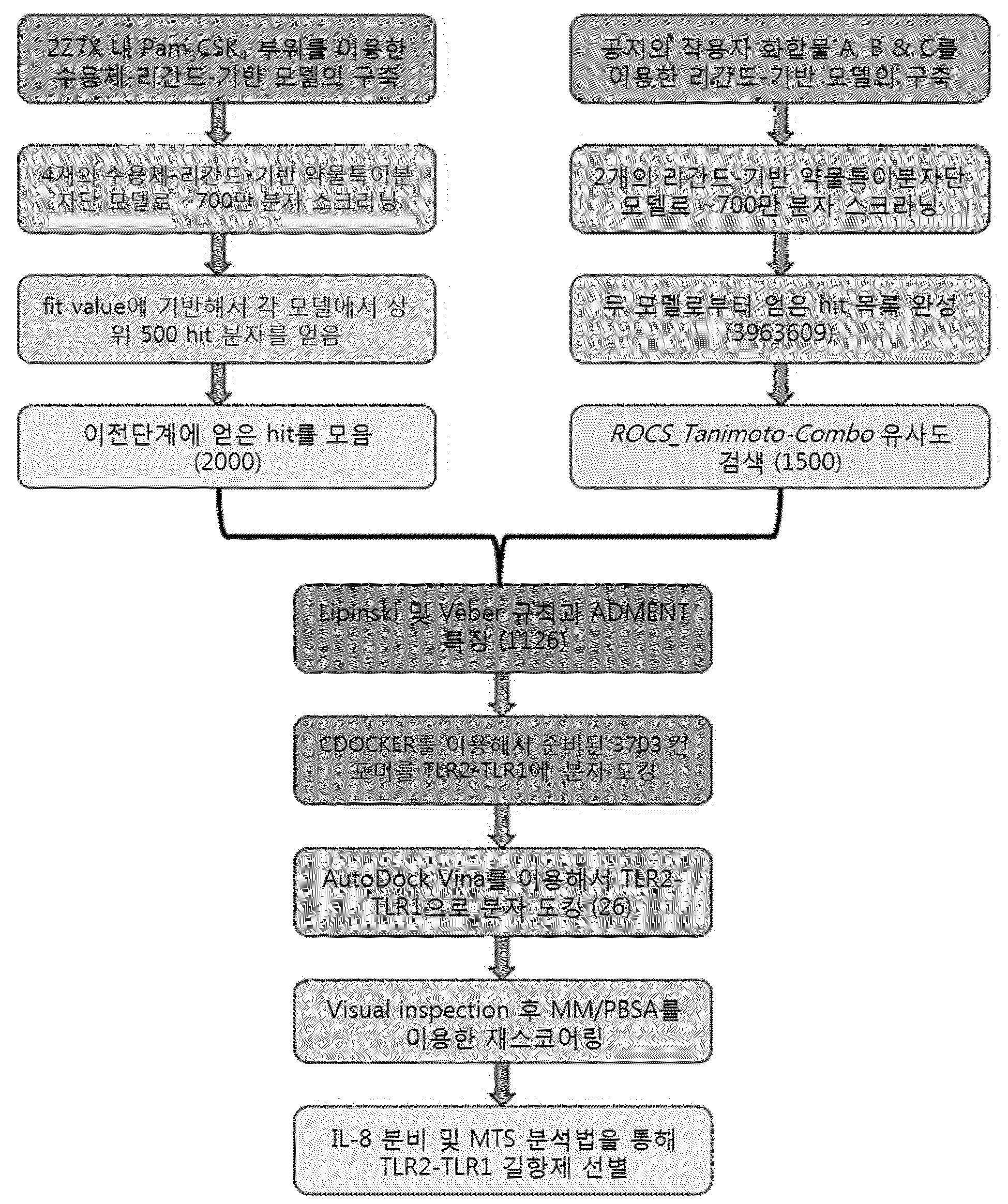
NOVEL TLR2 ANTAGONISTS
본 발명은 신규한 작은 분자인 TLR2 길항제에 관한 것으로, 구체적으로는 19개의 신규한 TLR2 길항제, 상기 길항제를 포함하는 염증성 질환의 예방 또는 치료용 약학적 조성물 및 TLR4 조절자에 관한 것이다. 가상 스크리닝(virtual screening)은 타겟 수용체에 대한 화합물 라이브러리로부터 분자의 결합을 신속히 예상하고, 추가적인 확인 실험을 위한 관련된 생물학적 활성(biological activities)을 갖는 분자들을 효과적으로 우선 순위를 매길 수 있는 인실리코(in silico) 접근 방법이다. 실험적인 HTS(high-throughput screening) 방식의 단점인 고비용성 문제를 극복하기 위해서는 방대한 양의 화합물 라이브러리를 특정 타켓 약물을 포함할 수 있는 작은 세트로의 선택적 다운사이징을 필요로 한다. 이것을 위해서 가상 스크리닝은 약물 발견 프로젝트에서 실험적 HTS에 선행하여 그 적용이 점차 증가되어 오고 있다. 다양한 가상 스크리닝 기술의 적용은 약물 발견 분야에서의 연구 효율성을 현저하게 증가시킬 수 있다. 가상 스크리닝에 있어서 널리 적용되는 기술 중 하나는, 실험적으로 결정된 리간드와 화합물 라이브러리로부터의 분자들 사이의 2차원(2D) 속성을 비교하는 것이다. 이 접근 방법에서는 구성 원자들의 종류와 그들의 결합 수준(bond level)에 의해 분자들의 구조적 특징이 표현된다. 또 다른 기술 중 하나는, 분자들의 3차원적 구조적 속성을 분자들 간의 유사성 비교에 사용하는 것이다. 3차원 구조 기반의 가상 스크리닝 접근 방법은 주로 리간드 배위(ligand coordinates)에 근거한 접근 방법과, 수용체 배위(receptor coordinates)에 근거한 접근 방법으로 분류된다. 2차원(2D) 방법과 같이, 리간드 기반 접근 방법은 분자들 사이의 3차원 구조 속성을 비교함으로써 실험적으로 결정된 활성 리간드와 유사한 분자들을 탐색한다. 이러한 접근 방법은 타겟 수용체에 대한 제한된 정보만이 이용 가능한 경우에서 전형적으로 적용된다. 리간드 기반 방법은 필수적으로 구조적 속성의 비교 분석 과정을 포함하며, 이에 따라 이의 적용에는 공지 활성 리간드의 정보 입수가 반드시 필요하다. 유효한 프로그램 중 하나인 ROCS(Rapid Overlay of Chemical Structures)는 대규모 형태 기반 비교를 위한 중첩 방법을 사용한다. ROCS는 3차원 형태에 기반 하여 두 분자간의 구조적 유사성을 비교하는 방식을 채택하고 있다. 파라미터화된 구체적으로 표현된 분자의 3차원 형태는 가우시안 기반 중첩(overlap)을 이용하여, 두 분자 간의 가장 큰 체적 중첩의 최적 정렬을 얻는다. 분자의 형태적 유사성 뿐만 아니라 화학적 특성의 유사성은 생물학적 활성에 결정적인 요소이기 때문에, 화합물이 가지고 있는 작용기들 간의 중첩이 칼라 포스 필드(color force field)를 이용하여 추가적으로 계산된다. 컨포머(conformers) 앙상블을 사전 컴퓨팅하고 순차적으로 이들 각각을 비교함으로써, 분자의 배좌 유연성(conformational flexibility)이 고려될 수 있다. ROCS 방법의 우수성은 다수의 연구 문헌들을 통해 보고되고 있다. 타겟 수용체의 고해상도 배위(high-resolution coordinates)가 이용 가능한 경우에는, 분자 도킹(docking)이 가상 스크리닝에서 선택되는 일반적인 방법이다. 도킹은 컴퓨터 연산에 의해 화합물 라이브러리로부터의 분자들과 수용체 간의 결합 친화력을 수치화 하여 이들 간의 결합 가능성을 예측하는데 이용된다. 본질적으로, 이 방법은 약물 표적에 대해 활성을 보이는 화합물에 대한 정보를 필수적으로 요구하지는 않지만, 공지 활성 물질의 결합 속성을 도킹 과정에 통합함으로써 성능을 증가시킬 수 있다. 한편, 길항제(antagonist)는 어떤 생체 작용자(agonist)의 수용체에 결합하지만 자신은 수용체를 통한 생리작용을 나타내지는 않는 물질이다. TLR2(Toll-like receptor 2)는 원형질막이나 엔도솜(endosome)에 존재하며 염증 반응시 숙주 방어의 첫 번째 방어 라인에 속한다. TLR2와 관련된 시그널링은 암, 결핵, 빈혈, 아토피 피부염, 죽상경화증과 관련이 있다고 보고되어있다. 특히, TLR2의 길항제는 이것의 염증성 질환의 억제 효과로 인하여 약학적으로 주요한 타겟이 되고 있다. 따라서 약학적으로 이용할 수 있는 신규한 TRL2의 길항제를 스크리닝 할 필요성이 있고, 특히 작은 분자인 길항제를 스크리닝하기 위한 연구가 필요한 실정이다. 본 발명자들은 약 700만 개의 화합물을 대상으로 하여 약물특이분자단 모델을 기반으로 컴퓨터를 이용한 스크리닝의 결과, 염증성 질환의 예방 또는 치료에 이용될 수 있는 신규한 작은 분자인 TLR2 길항제를 선별하여 본 발명을 완성하였다. 본 발명의 목적은 신규한 TLR2 길항제를 제공하는 것이다. 본 발명의 다른 목적은 상기 TLR2 길항제를 포함하는 염증성 질환의 예방 또는 치료용 약학적 조성물, 경구 투여제 및 상기 길항제를 포함하는 TLR4 조절자를 제공하는 것이다. 본 발명에 따른 신규한 TLR2 길항제는 분자량이 작아 경구적 생체이용률이 높으므로 경구 투여제로서 효과적으로 사용될 수 있으며, IL-8 분비를 효과적으로 저해하고 생체 내에서 독성을 유발하지 않으므로 염증성 질환의 예방 또는 치료용 약학적 조성물에 유용하게 사용될 수 있다. 또한 본 발명에 따른 신규한 TLR2 길항제는 TLR4의 조절자로 이용될 수 있다. 도 1은 TLR2 길항제를 동정하기 위한 전체 단계를 간략하게 나타낸 도이다. 도 2는 인 실리코 알라닌 스캐닝 돌연변이 유발 결과 계산된 자유 에너지를 기초로 하여 결합에 영향을 주는 주요 잔기를 확인한 결과를 나타낸 도이다. 도 3은 수용체-리간드-기반 약물특이분자단 모델을 구축하기 위해 사용한 TLR2-TLR1-Pam3CSK4 복합체의 크리스탈 구조를 나타낸 도이다. 도 4는 TLR2-TLR1에 결합한 Pam3CSK4로부터 얻은 모든 약물특이분자단 특징들을 나타낸 도이다. 도 5는 수용체-리간드-기반 약물특이분자단 모델에서 5개의 선택된 약물특이분자단의 특징 및 그 특징들이 라벨링된 잔기의 주변을 나타낸 도이다(별표 : TLR1 잔기, 초록색 구 : HBA, 자주색 구 : HBD, 파란색 구 : HBY, 회색 구 : 단백질이 차지하는 공간). 도 6은 수용체-리간드-기반 약물특이분자단 모델이 보여주는 주요한 특징을 나타낸 도이다. 도 7는 수용체-리간드-기반 약물특이분자단 모델로부터 선택된 5개의 특징을 4개의 하위 모델로 구축한 결과를 나타낸 도이다. 도 8은 리간드-기반 약물특이분자단 모델을 구축하는 데 사용된 화합물 A, B, 및 C의 구조를 나타낸 도이다. 도 9는 화합물 A로부터 구축한 리간드-기반 약물특이분자단 모델 1로부터 매핑된 활성 분자를 나타낸 도이다. 도 10은 화합물 B와 C로부터 구축한 리간드-기반 약물특이분자단 모델 2로부터 매핑된 활성 분자를 나타낸 도이다. 도 11은 CDocker를 이용한 분자 도킹을 나타낸 도이다. 도 12는 스크리닝된 3개의 화합물(S06690562, S01688300, S01382085)의 2차원 구조를 나타낸 도이다. 도 13a는 스크리닝된 화합물 S06690562의 도킹 결과를 나타낸 도이다. 도 13b는 스크리닝된 화합물 S01688300의 도킹 결과를 나타낸 도이다. 도 13c는 스크리닝된 화합물 S01382085의 도킹 결과를 나타낸 도이다. 도 14a는 스크리닝된 화합물 S06690562의 도킹 결과를 나타낸 도이다. 도 14b는 스크리닝된 화합물 S01688300의 도킹 결과를 나타낸 도이다. 도 14c는 스크리닝된 화합물 S01382085의 도킹 결과를 나타낸 도이다. 도 15는 19개의 화합물을 세포에 처리하여 IL-8의 분비를 확인한 도이다(*P<0.05, **P<0.01). 도 16은 스크리닝된 3개의 화합물(S06690562, S01688300, S01382085)의 농도 의존적 IL-8의 분비 억제 결과를 나타낸 도이다(*P<0.05, **P<0.01). 도 17은 스크리닝된 3개의 화합물(S06690562, S01688300, S01382085)의 세포 독성 여부를 확인한 도이다. 이하, 본 발명에 대해 상세히 설명한다. 본 발명은 하기의 표 1의 화합물로 이루어진 군에서 선택된 1종 이상의 TLR2(Toll-like receptor 2) 길항제를 제공한다. 본 발명의 "TLR2(Toll-like receptor 2)"는 단구, 대식세포, 호중구 등의 세포 표면에 위치하며 세균의 균체성분(지방다당, 펩티드글리칸, 지방세포단백질, 항산균당지질 등 및 열충격단백질(hsp)의 수용체의 기능을 하는 물질을 의미한다. TLR2가 자극되면 세포는 활성화되어 염증성 사이토카인 및 염증 매개체(TNF, IL-1, IL-6, IL-8, NO등)의 생성이 촉진된다. 본 발명에서 "길항제(antagonist)"는 어떤 약물이 다른 약물과의 병용에 의하여 그 작용의 일부 또는 전부를 감쇠시키는 역할을 하는 약제 또는 어떤 생체작용자(agonist)의 수용체에 결합하지만 자신은 수용체를 통한 생리작용을 나타내지는 않는 물질을 의미한다. 따라서, 상기 TLR2 길항제는 TLR2에 강한 결합력을 가지므로 마이크로 분자 수준에서 부분적으로 TLR2 관련 시그널링을 저해하되 완전히 폐지하지 않는 작용을 할 수 있다. 본 발명의 "TLR2 길항제"는 표 1의 19개 화합물을 포함하며 바람직하게는 6개의 화합물(S02546436, S02276077, S06696686, S06690562, S01688300, S01382085), 더욱 바람직하게는 3개의 화합물(S06690562, S01688300, S01382085)을 포함한다. 또한 본 발명의 TLR2 길항제는 표 1의 19개의 화합물 뿐만 아니라 이와 동일, 유사한 활성을 갖는 이의 유사체(analog)를 제한 없이 포함할 수 있다. 상기 화합물들 중 일부 화합물, 예컨대 S06690562는 토토머(tautomer) 분자로, pH에 따라 토토머화(tautomerization)에 의해서 에놀(enol) 또는 케토(keto) 형태로 존재할 수 있다. 본 발명의 TLR2 길항제는 fatty acyl 잔기를 가지지 않기 때문에 작은 분자인 특징이 있다. 이러한 분자량의 감소는 약동학(pharmacokinetics)상 유리하므로, 본 발명의 길항제와 이들의 유사체들은 약학적 조성물의 유효성분으로서 약을 디자인하는 데 유용하게 사용될 수 있다. 상기 "작은 분자"란 이에 제한되는 것은 아니나 바람직하게는 분자량 900 Da 이하의 유기 화합물을 의미한다. 본 발명의 TLR2 길항제는 이전에 TLR2의 길항제로서 제시된 분자들과는 다른 코어 구조(core structure)를 가진다. 또한, 표 1에 제시된 19개의 화합물들은 각기 다른 구조를 가지는 특징이 있다. 본 발명의 19개의 TLR2 길항제는 구입하여 사용하거나 당 분야에 공지된 방법을 통해 합성되는 물질을 모두 포함한다. 또한, 본 발명은 상기 TLR2(Toll-like receptor 2) 길항제를 포함하는 염증성 질환의 예방 또는 치료용 약학적 조성물을 제공한다. 본 발명에서 "염증성 질환"은 부종, 피부염, 알레르기, 아토피, 천식, 결막염, 치주염, 비염, 중이염, 인후염, 편도염, 폐렴, 위궤양, 위염, 크론병, 대장염, 치질, 통풍, 강직성 척추염, 류마티스 열, 루푸스, 섬유근통(fibromyalgia), 건선관절염, 골관절염, 류마티스관절염, 견관절주위염, 건염, 건초염, 근육염, 간염, 방광염, 신장염, 쇼그렌 증후군(sjogren's syndrome) 및 다발성 경화증을 포함하나, 이에 제한되지 않는다. 본 발명에서 사용되는 용어 "예방"은 본 발명의 조성물의 투여로 염증성 질환을 억제시키거나 진행을 지연시키는 모든 행위를 의미한다. 본 발명에서 사용되는 용어 "치료"는 본 발명의 조성물의 투여로 염증성 질환이 호전 또는 이롭게 변경되는 모든 행위를 의미한다. 본 발명의 조성물은 약학적으로 허용되는 담체를 포함한다. 본 발명의 약학적 조성물에 포함되며 허용되는 담체는 제제 시에 통상적으로 이용되는 것으로서, 락토스, 덱스트로스, 수크로스, 솔비톨, 만니톨, 전분, 아카시아 고무, 인산 칼슘, 알기네이트, 젤라틴, 규산 칼슘, 미세결정성 셀룰로스, 폴리비닐피롤리돈, 셀룰로스, 물, 시럽, 메틸 셀룰로스, 메틸히드록시벤조에이트, 프로필히드록시벤조에이트, 활석, 스테아르산 마그네슘, 미네랄 오일, 식염수, PBS(phosphate buffered saline) 또는 배지 등을 포함하나, 이에 제한되는 것은 아니다. 본 발명의 약학적 조성물은 상기 성분들 이외에 윤활제, 습윤제, 감미제, 향미제, 유화제, 현탁제, 보존제 등을 추가로 포함할 수 있다. 적합한 약제학적으로 허용되는 담체 및 제제는 Remington's Pharmaceutical Sciences (19th ed., 1995)에 상세히 기재되어 있다. 또한 본 발명의 약학적 조성물은 TLR2와 관련된 염증성 질환을 예방 또는 치료하기 위해 사용할 수 있는 추가적인 성분을 포함하여 함께, 동시에, 순차적으로 사용할 수 있다. 본 발명의 약학적 조성물의 적합한 투여량은 제제화 방법, 투여 방식, 환자의 연령, 체중, 성, 병적 상태, 음식, 투여 시간, 투여 경로, 배설 속도 및 반응 감응성과 같은 요인들에 의해 다양하게 처방될 수 있다. 또한, 본 발명은 상기 TLR2(Toll-like receptor 2) 길항제를 포함하는 염증성 질환의 예방 또는 치료용 경구 투여제를 제공한다. 본 발명의 TLR2 길항제는 작은 분자인 것을 특징으로 하므로, 경구적 생체이용률(oral bioavailability)이 좋은 특징이 있다. 본 발명에서 생체이용률은 약물의 흡수(absorption)의 하위범주에 속하는 것으로 전신 순환에 도달하는 투여된 약물의 양의 일부분을 의미한다. 따라서 본 발명의 TLR2 길항제를 포함하는 염증성 질환의 예방 또는 치료용 경구 투여제를 경구로 투여할 경우 약물이 전신 순환에 높은 비율로 도달하는 효과가 있다. 본 발명에 따른 경구 투여제는 정제, 알약, 캡슐, 분말 및 과립과 같은 고체 약학 제제, 또는 약제학적으로 허용 가능한 수용액, 현탁액 및 에멀션, 시럽, 사용시 용해되는 약학 제제 및 엘릭시르 경구용 액체 약학 제제 중에서 선택되는 제형으로 투여되는 것을 특징으로 한다. 또한, 본 발명은 (a) 수용체-리간드-기반 약물특이분자단 모델(pharmacophore model)을 구축하는 단계; (b) 리간드-기반 약물특이분자단 모델(pharmacophore model)을 구축하는 단계; (c) 상기 (a), (b)의 결과물을 스크리닝하는 단계; 및 (d) 상기 (c)의 결과물로 생물학적 실험을 수행하여 스크리닝하는 단계;를 포함하는, TLR2(Toll-like receptor 2) 길항제의 스크리닝 방법을 제공한다. 본 발명에서 "약물특이분자단(pharmacophore)"은 리간드의 분자 인식을 위해 필요한 분자의 특징을 의미한다. "약물특이분자단 모델(pharmacophore model)"은 어떻게 다양한 리간드가 공통의 수용체 위치에 결합할 수 있는지를 설명해주며, 동일 수용체에 결합하는 신규한 리간드의 가상 스크리닝에 사용될 수 있다. 본 발명에서 "수용체-리간드-기반 약물특이분자단 모델(Pharmacophore models)"을 구축하는 방법은 TLR2-TLR1-Pam3CSK4복합체에서 Pam3CSK4 와 TLR2-TLR1의 결합 부위(binding site)의 잔기는 알라닌으로 돌연변이시키는 과정을 포함하는 인 실리코 알라닌 스캐닝 돌연변이 유발(In Silico Alanine Scanning Mutagenesis) 기법, 본 발명의 "Pam3CSK4"는 TLR2 및 TLR1의 작용자(agonist)이다. 본 발명에서 "리간드-기반 약물특이분자단 모델(Pharmacophore model)"을 구축하는 방법은 공지된 작은 분자인 TLR2의 길항제를 이용하여 약물특이분자단 모델의 특징을 확인하는 과정을 포함한다. 본 발명에서 구축된 약물특이분자단 모델로부터 동정된 결과물을 스크리닝하는 단계는 fit value, 분자 유사도, 약물-유사 화합물의 스크리닝, 분자 도킹(moleculatr docking)과 스코어링(scoring) 및 도킹 복합체의 재스코어링(rescoring)을 포함한다. 상기 스크리닝 과정을 통하여 TLR2에 결합력이 우수하여 약물-유사성이 있는 작은 분자인 TLR2의 길항제의 후보 화합물을 얻을 수 있다. 본 발명에서 "생물학적 실험"은 IL-8 분비, 세포 생존활성(cell viability) 분석을 포함한다. 상기 생물학적 실험을 통하여 선별된 TLR2의 길항제의 후보 화합물이 TLR2의 길항제 역할을 하는 지 여부, 독성을 나타내는지 여부를 확인할 수 있다. 또한, 본 발명은 상기의 표 1의 화합물로 이루어진 군에서 선택된 1종 이상의 TLR4(Toll-like receptor 4) 조절자(regulator)를 제공한다. 본 발명에서 "조절자(regulator)"는 분자 수준을 측정 가능한 정도로 증가시키거나 감소시키는 물질을 의미하며, 저해제(inhibitor), 길항제, 작용자 등을 포함하나 이에 제한되지 않는다. 본 발명의 TLR4는 TLR2와 구조적, 기능적 유사성을 가지는 것을 특징으로 하며, TLR2의 길항제로 스크리닝된 화합물은 TLR4의 조절자 활성을 가질 수 있다. 따라서 본 발명의 TLR2 길항제인 19개의 화합물을 TLR4의 조절자로서 활용할 수 있다. 본 명세서에서 달리 정의되지 않은 용어들은 본 발명이 속하는 기술분야에서 통상적으로 사용되는 의미를 갖는 것이다. 이하 본 발명을 실시예를 통하여 보다 상세하게 설명한다. 그러나, 이들 실시예는 본 발명을 예시적으로 설명하기 위한 것으로 본 발명의 범위가 이들 실시예에 한정되는 것은 아니다. 이하 실시예 나타낸 통계적 분석은 3번의 독립적인 실험으로부터 얻은 데이터에 대하여, 통계적 유의도를 SigmaPlot software version 12.0 (Systat Software Inc., San Jose, CA, USA)를 이용한 1차원 분산 분석으로 P value(0.05 이하 또는 0.01 이하)로 정의하여 이루어졌다. 실시예 1 - 인 실리코 알라닌 스캐닝 돌연변이 유발(In SilicoAlanine Scanning Mutagenesis) 약물특이분자단(pharmacophore)모델을 구축하는 데 필요한 주요 잔기들의 분석을 위하여, 알라닌 스캐닝 돌연변이 유발 기법을 이용하였다. TLR2-TLR1-Pam3CSK4복합체에서 Pam3CSK4 와 TLR2-TLR1의 결합 부위(binding site)의 잔기는 알라닌으로 돌연변이시켰고, 돌연변이 에너지는 돌연변이와 야생형(wild-type)의 결합 자유 에너지의 차이에 의해 기초하여 계산하였다. 상위 10개의 불안정하게 만드는 잔기의 값을 표 2에 나타내었으며, 다른 모든 잔기의 값은 표 3에 나타내었다. * TLR1의 잔기 * TLR1의 잔기 상기 표 2에서 계산되어 결합력에 영향을 준다고 판단된 잔기들은 TLR2의 Phe325와 Phe349 및 TLR1의 Gln316이며, 이들은 이전의 연구에서 생물학적 실험 기법으로 밝혀진 주요 잔기와도 일치함을 확인하였다. 따라서, 상기 3가지의 잔기는 단백질-리간드복합체를 형성하는 과정에서 중요한 역할을 하는 것으로 확인하였으며 하기의 수용체-리간드-기반 약물특이분자단 모델을 구축하는 데 사용되었다. 실시예 2 - 수용체-리간드-기반 약물특이분자단 모델의 구축 수용체-리간드-기반 약물특이분자단 모델을 구축하기 위해, 수용체와 결합을 가능하게 하는 리간드의 특징을 동정하기 위하여 TLR2-TLR1-Pam3CSK4복합체를 이용하였다. 상기 복합체의 크리스탈 구조를 도 3에 나타내었다. 디폴트 파라미터와 함께 TLR2-TLR1-Pam3CSK4복합체의 리포펩티드 결합 부위를 타게팅(targeting)하여 도 5 및 도 6에 나타낸 것과 같이, 단백질과 결합을 가능하게 하는 리간드는 2개의 수소 결합 수용체(HBA), 1개의 수소 결합 제공자(HBD), 2개의 소수성 특징(HBY)을 가지는 것을 확인하였다. 상기에서 확인한 5가지 특징을 다시 4개의 하위 모델로 분류하였으며, 이를 도 7에 나타내었다. 실시예 3 - 리간드-기반 약물특이분자단 모델의 구축 리간드-기반 약물특이분자단 모델을 구축하기 위하여, 공지된 작은 분자 TLR2의 길항제인 화합물 A, B, 및 C를 이용하였으며, 이들의 구조를 도 8에 나타내었다. 이들의 2차원 구조는 ChemBioDraw Ultra(CambridgeSoft)를 이용하여 그렸다. 또한 실시예 2에서 확인한 상기 HBD, HBA, HBY 특징을 리간드-기반 약물특이분자단 모델 1을 구축하는데 있어서 화합물 A를 query 분자로 사용하였다. 화합물 A의 다양한 특징으로부터 10개의 약물특이분자단 모델이 구축되었고, 이 중 3개의 HBA와 2개의 HBY를 리간드-기반 약물특이분자단 모델 1로 구축하였다. 이를 바탕으로 활성 분자(active molecule)를 매핑하였으며 그 결과를 도 9에 나타내었다 리간드-기반 약물특이분자단 모델 2를 구축하는데 있어서 화합물 B를 query 분자로 사용하였다. 화합물 B로부터 확인한 약물특이분자단의 특징은 1개의 HBD, 2개의 HBA, 2개의 HBY인 것을 확인하였으며 이를 바탕으로 하여 매핑한 결과를 도 10에 나타내었다. 또한 화합물 C와 화합물 B의 구조적 유사성 때문에, 화합물 C로부터 확인한 특징을 매핑한 결과가 도 10과 같음을 확인하였다. 실시예 4 - fit value를 이용한 스크리닝 상업적으로 얻을 수 있는 약 700만 분자의 라이브러리로부터 TLR2 길항제 후보 물질을 선별하기 위하여, 상기 실시예 2에서 구축한 4개의 하위 수용체-리간드-기반 약물특이분자단 모델을 이용하였다. DS 4.0의 실시예 5 - 분자 유사도를 이용한 스크리닝 상업적으로 얻을 수 있는 약 700만 분자의 라이브러리로부터 TLR2 길항제 후보 물질을 선별하기 위하여, 상기 실시예 4와 같은 방법에 따라, 화합물 A를 입력(input)으로 한 리간드-기반 약물특이분자단 모델 1로부터 2312604개의 hit 분자를, 화합물 B를 입력(input)으로 한 리간드-기반 약물특이분자단 모델 2로부터 1651005개의 hit 분자를 선별하였다. 두 모델로부터 선별된 3963609개의 hit 분자들을 추가적으로 선별하기 위하여, query 분자와 hit 분자의 모양 및 원자 타입의 유사도에 따른 ROCS_tanimoto-Combo의 스코어링 기능을 이용하였다. 리간드-기반 약물특이분자단 모델 1로부터 얻은 2312604개의 hit 분자와 비교하기 위해서 화합물 A를 query 분자로 하였고, 리간드-기반 약물특이분자단 모델 2로부터 얻은 1651005개의 hit 분자와 비교하기 위해서 화합물 B, C를 query 분자로 하였다. 스코어링 결과, 리간드-기반 약물특이분자단 모델로부터 총 1500개의 hit 분자를 선별하였다. 실시예 6 - 약물-유사 화합물의 스크리닝 상기 실시예 4에서 얻은 2000개의 hit 분자와 상기 실시예 5에서 얻은 1500개의 hit 분자, 즉 총 3500개의 hit 분자 중 신약 개발 단계에서 요구되는 약물-유사성을 가진 화합물을 추가적으로 스크리닝하기 위하여 Lipinski 및 Veber 규칙과 ADMET(absorption, distribution, metabolism, excretiom, toxicity) 특징을 이용하였다. 구체적으로, Lipinski 및 Veber 규칙은 더 좋은 경구적 생체이용률(oral bioavailability)를 가지는 화합물을 스크리닝 하기 위한 필터로 이용되었다. ADMET(absorption, distribution, metabolism, excretiom, toxicity) 특징은 좋은 흡수, 적절한 용해도, 낮은 혈액-뇌 장벽 관통성(blood-brain penetrability), 시토크롬 P450 2D6 비-저해, 비-간세포독성, 및 비-플라즈마 단백질 결합 능력을 동정하는 데 이용되었다. 결과적으로, 총 3500개의 hit 분자로부터 약물-유사 화합물로 선별된 1126개의 분자를 확인하였다. 후보 화합물들의 약물-유사 특징을 계산하여 선별함으로써 약 개발 단계에서 이용가능성이 낮은 분자를 배제하였다. 실시예 7 - 분자 도킹(moleculatr docking)과 스코어링(scoring) 리간드와 수용체의 결합에 있어 최적의 도킹 포즈를 선별하고 리간드를 스크리닝하기 위하여 TLR2-TLR1 이합체의 분자 도킹을 이용하였다. 리간드는 DS 4.0의 보다 구체적으로, 상기 실시예 6에서 얻은 1126개의 약물-유사 화합물들을 CD를 이용하여 4개의 Pam3CSK4위치에 도킹시켰다. 이 때 도 11에 나타낸 바와 같이 B, C 위치를 대부분 커버하는 반지름 13Å의 구를 이용하였다. CD 상호작용 에너지(CD interaction energy)를 계산하였으며 그 결과 약 60개의 화합물에서 상위 100개의 포즈(pose)가 스크리닝되었다. 상기 100개의 포즈를 AD Vina를 이용하여 재도킹시켰다. 이 때 실시예 8 - 도킹 복합체의 재스코어링(rescoring) 단백질-리간드 상호작용의 추진력(driving force)를 판단하기 위하여 결합 자유에너지(binding free energy)를 이용한 도킹 복합체 재스코어링을 수행하였다. 구체적으로는, TRL2-TLR1 복합체와 리간드의 열역학적 상호작용을 정량화하기 위하여, 상기 실시예 7에서 얻은 26개의 도킹 복합체들을 Poisson-Boltzmann surface area(MM/PBSA) 결합 자유에너지 계산에 따른 분자 역학(molecular dynamics, MD)에 따라 다시 정렬하였다. MD 시뮬레이션은 g_mmpbsa tool을 이용하여 이루어졌고, 평균 결합 에너지와 이의 표준 편차/오차는 MnPbSaSatat.pyscript로 계산하였다. MM/PBSA 결합 자유에너지는 하기의 식 1에 의해 계산하였다. [식 1] Gbind는 평균 결합 자유에너지, Gcomplex는 TRL2-TLR1복합체의 결합 자유에너지, Gprotein은 단백질(수용체)의 결합 자유에너지, Gligand는 리간드의 결합 자유에너지를 의미한다. 상기와 같은 계산에 의하여 얻은 평균 MM/PBSA 값, 상기 실시예 7의 AD 결합 에너지값 및 CD 결합 에너지값에 기반하여 3개의 화합물(S06690562, S01688300, S01382085)을 선별하였다. 그 결과, 수용체-리간드-기반 모델로부터 2개의 화합물이, 리간드-기반 모델로부터 1개의 화합물이 선별되었음을 확인하였고 이들의 2차원 구조를 도 12에 나타내었다. 또한 이들의 분자 도킹 결과는 도 13a 내지 13c 및 도 14a 내지 14c에 나타내었다. 실시예 9 - IL-8 분비의 확인 상기 실시예 7에서 스크리닝한 26개의 화합물 중 19개의 화합물 (S02546436, S02276077, S06696686, S06690562, S06713271, S02396152, S01525559, S06542401, S01739292, S01688300, S06570841, S06570001, S06568641, S06572801, S01577528, S01382085, S01442577, S01414289, S01292238)이 TLR2의 길항제로서 생물학적 활성을 나타내는지 확인하기 위하여 상기 화합물을 처리하고, TLR2에 의해 유발되는 사이토카인인 IL-8의 분비 변화를 확인하였다. HEK293-TLR2(TLR1은 내생 수준으로 발현됨)와 HEK293-Null 세포 라인은 96-웰 조직 배양 플레이트(BD Biosciences)에서 밀도 1×104 세포/웰로, 37℃, 95% 공기 및 5% CO2에서 24시간 동안 배양되었다. 작용자(agonist)의 활동성을 알아보기 위하여, 세포 자극은 50 μM 농도의 화합물 및 50 nM의 Pam3CSK4(Invivogen, SanDiego, CA, USA)를 처리함으로써 이루어졌다. 길항제 활동성을 알아보기 위하여, 세포를 다양한 농도의 화합물로 1시간동안 처리하였고, 후에 50 nM의 Pam3CSK4를 동시-처리(co-treatment)하였다. 다음날, IL-8 분비를 인간 IL-8 ELISA Ready-SET-Go!® (second-generation) kit (eBioscience, San Diego, CA, USA)로 제조업자의 가이드에 따른 방법으로 정량하였으며, 정량한 결과를 도 15에 나타내었다. 도 15에 나타낸 바와 같이 19개의 화합물 모두 IL-8의 분비를 감소시키는 것을 확인하였고, 특히 6개의 화합물(S02546436, S02276077, S06696686, S06690562, S01688300, S01382085)을 처리한 경우에 Pam3CSK4-유발된 IL-8의 분비량이 크게 감소되었음을 확인하였다. 따라서 상기 6개의 화합물이 TLR2의 길항제로 작용하여 IL-8의 분비를 유의적으로 감소시키는 사실을 확인하였다. 상기 6개의 화합물 중 상위 3개의 화합물(S06690562, S01688300, S01382085)에 대한 농도 의존적(dose-dependent) 분석을 위하여, 상기 3가지 화합물의 농도를 12.5 μM, 25 μM, 50 μM로 달리하고 상기의 방법과 같이 IL-8의 분비량을 분석하였으며 그 결과를 도 16에 나타내었다. 도 16에 나타낸 것과 같이 3개의 화합물 모두 낮은 농도로 처리했을 때에 비하여 50 μM의 고농도로 화합물을 처리한 경우에 IL-8의 분비가 상당 수준 감소됨을 확인하였다. 따라서 상기 3개의 화합물이 농도 의존적으로 IL-8의 분비를 감소시키는 물질임을 확인하였다. 실시예 10 - 세포 배양 및 세포 생존활성(cell viability) 분석 HEK293-TLR2 와 HEK293-Null 세포주(Invivogen, San Diego, CA, USA)를 10% 열-비활성화된 FBS(fetal bovine serum, Thermo Fisher Scientific Inc.), 50 IU/mL 페니실린, 50 ㎍/mL 스트렙토마이신 (Thermo Fisher Scientific Inc.) 및 NormocinTM 100 mg/mL (Invivogen., San Diego, CA, USA)가 보충된 Dulbecco's modified Eagle's medium(Thermo Fisher Scientific Inc., MA, USA)에서 배양하였다. 화합물은 갈색 튜브에 들어있는 디메틸 설폭사이드(dimethyl sulfoxide, Sigma-Aldrich, St. Louis, MO, USA)에 녹였고 10 mM의 농도로 저장하였다. 상기 실시예 8에서 스크리닝된 3개의 화합물(S06690562, S01688300, S01382085)에 대하여 세포 독성 여부를 확인하기 위하여, HEK293-TLR2에서 MTS 기법을 수행하였으며, 그 결과를 도 7에 나타내었다. 구체적으로, 제조업체의 가이드라인에 따라 CellTiter 96® AQueous One Solution Cell Proliferation Assay (MTS assay; Promega, Madison, WI, USA)를 이용하여 세포 활성도를 측정하였다. 세포들은 96-웰 플레이트에 농도 5×103 세포/mL 로 배양되었고 5%의 CO2를 포함하는 가습 대기에서 37℃로 밤새도록 유지되었다. 다음날, 상기 배양된 세포를 3개의 스크리닝된 화합물(S06690562, S01688300, S01382085)의 3가지 농도 조건(12.5 μM, 25 μM, 및 50 μM)으로 처리하였다. 24시간 후, MTS 용액을 웰에 처리하였고, 마이크로플레이트 분광 광도계 시스템(Molecular Devices Inc.)으로 490nm에서 흡광도를 측정하였으며, 그 결과를 도 17에 나타내었다. 도 17에 나타낸 바와 같이, 상기 3개의 화합물 모두 12.5 μM, 25 μM, 및 50 μM의 농도 조건에서 세포 독성을 나타내지 않아 안전한 물질이며 약물로 활용 가능함을 확인하였다. 본 발명에 따른 신규한 TLR2 길항제는 IL-8 분비를 효과적으로 저해하고 생체 내에서 독성을 유발하지 않으므로 염증성 질환의 예방 또는 치료용 약학적 조성물에 유용하게 사용될 수 있다. 상기 TLR2 길항제는 분자량이 작아 경구적 생체이용률이 높으므로 특히 경구 투여제로서 효과적으로 사용될 수 있으며, TLR4의 조절자로도 이용될 수 있다. The present invention relates to TLR2 antagonists, which are small novel molecules, and, particularly, to: 19 novel TLR2 antagonists; a pharmaceutical composition, containing the antagonists, for preventing or treating inflammatory diseases; and a TLR4 modulator, containing the antagonists. The novel TLR2 antagonists according to the present invention can be effectively used as a preparation for oral administration by having low molecular weight and high oral bioavailability, and can be useful in pharmaceutical compositions for preventing or treating inflammatory diseases since the secretion of IL-8 is effectively inhibited and 표 1의 화합물로 이루어진 군에서 선택된 1종 이상의 TLR2(Toll-like receptor 2) 길항제(antagonist). [표 1] 제1항에 있어서, 상기 TLR2 길항제는 표 1의 S06690562, S01688300 및 S01382085로 이루어진 군에서 선택된 1종 이상인, TLR2(Toll-like receptor 2) 길항제. 제1항의 TLR2(Toll-like receptor 2) 길항제를 포함하는 염증성 질환의 예방 또는 치료용 약학적 조성물. 제3항에 있어서, 상기 염증성 질환은 부종, 피부염, 알레르기, 아토피, 천식, 결막염, 치주염, 비염, 중이염, 인후염, 편도염, 폐렴, 위궤양, 위염, 크론병, 대장염, 치질, 통풍, 강직성 척추염, 류마티스 열, 루푸스, 섬유근통(fibromyalgia), 건선관절염, 골관절염, 류마티스관절염, 견관절주위염, 건염, 건초염, 근육염, 간염, 방광염, 신장염, 쇼그렌 증후군(sjogren's syndrome) 및 다발성 경화증으로 구성된 군으로부터 선택된 1종 이상인 것을 특징으로 하는, 염증성 질환의 예방 또는 치료용 약학적 조성물. 제1항의 TLR2(Toll-like receptor 2) 길항제를 포함하는 염증성 질환의 예방 또는 치료용 경구 투여제. 표 1의 화합물로 이루어진 군에서 선택된 1종 이상의 TLR4(Toll-like receptor 4) 조절자(regulator). [표 1]화합물 명칭 화합물 구조 S02546436 S02276077 S06696686 S06690562 S06713271 S02396152 S01525559 S06542401 S01739292 S01688300 S06570841 S06570001 S06568641 S06572801 S01577528 S01382085 S01442577 S01414289 S01292238