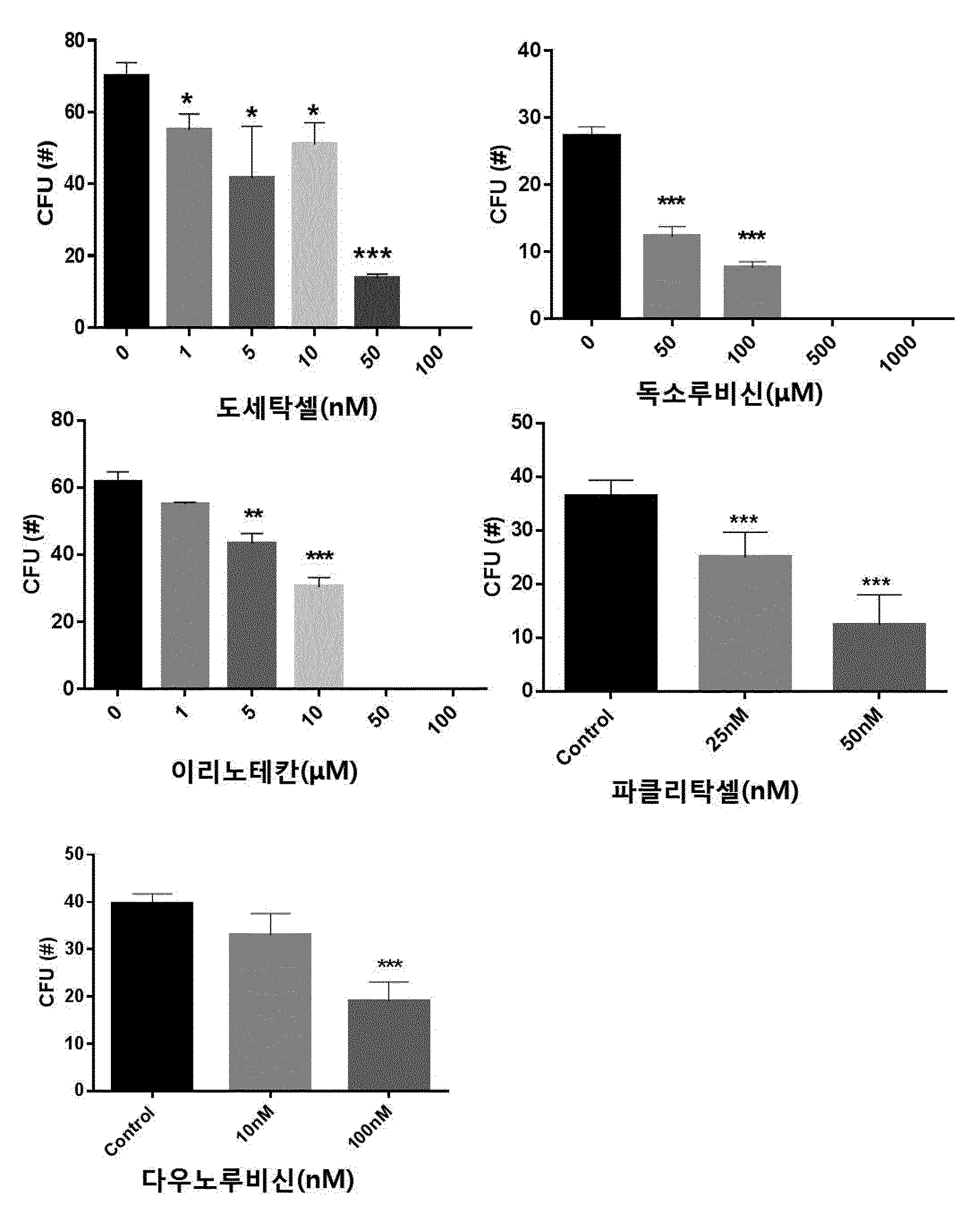
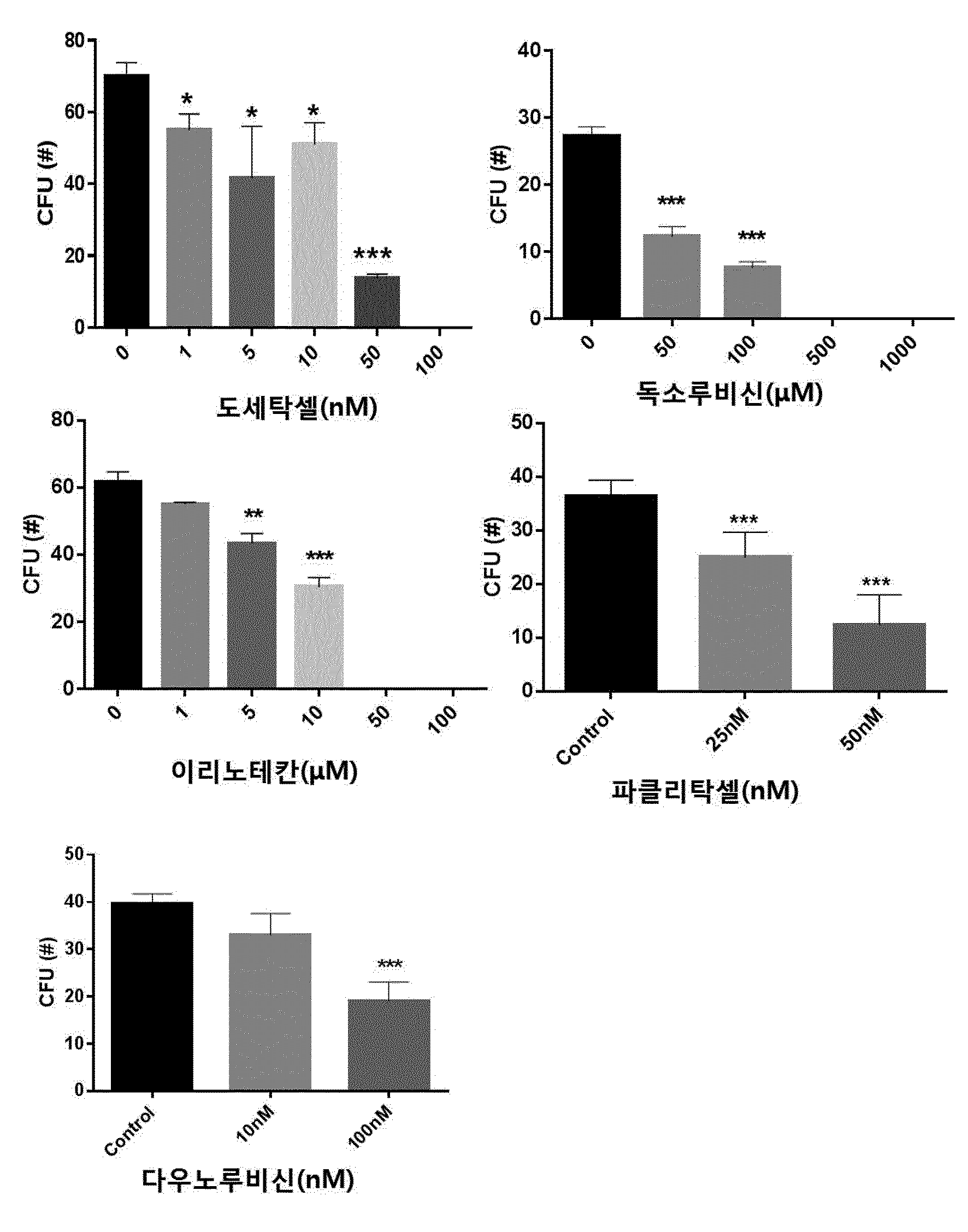
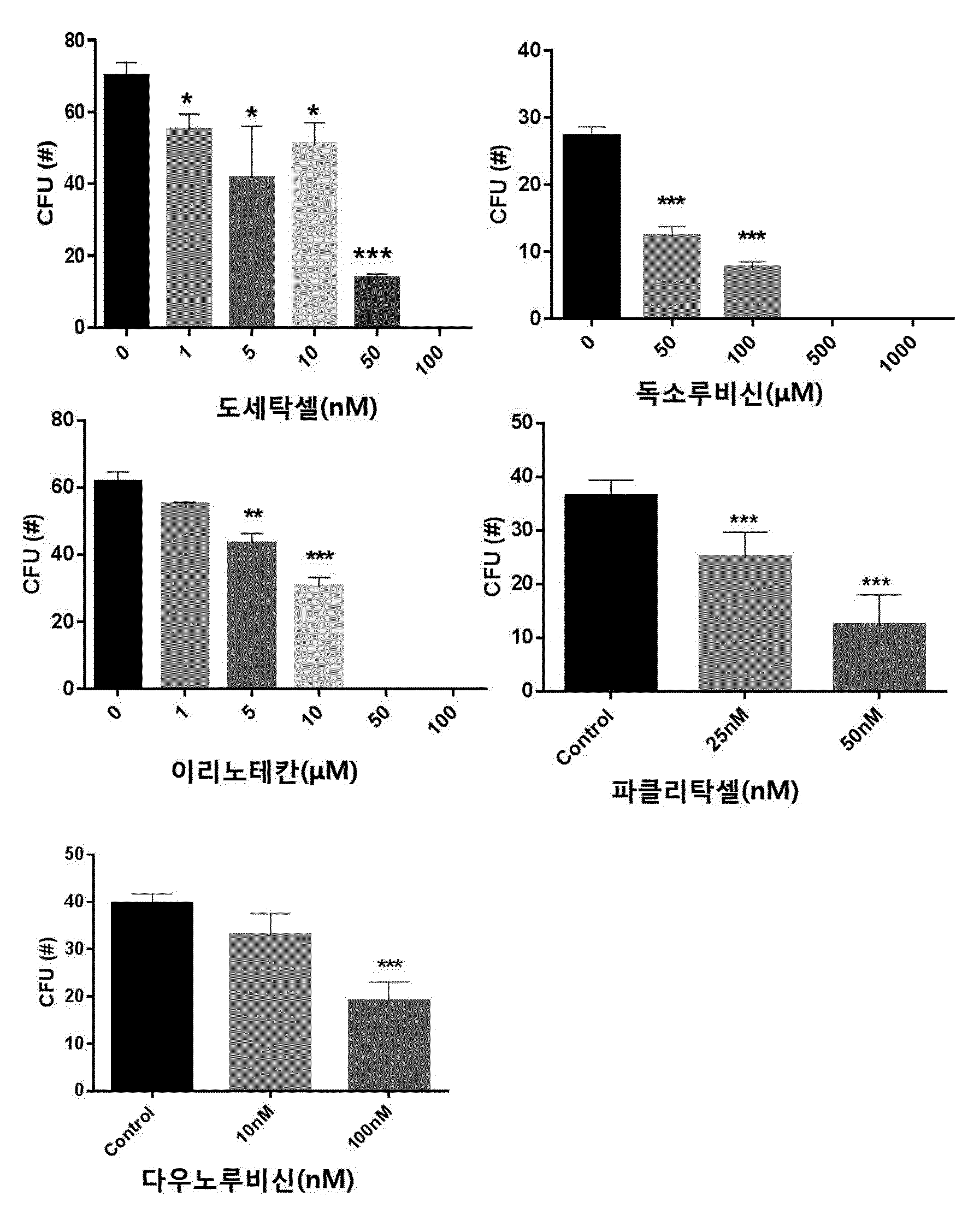
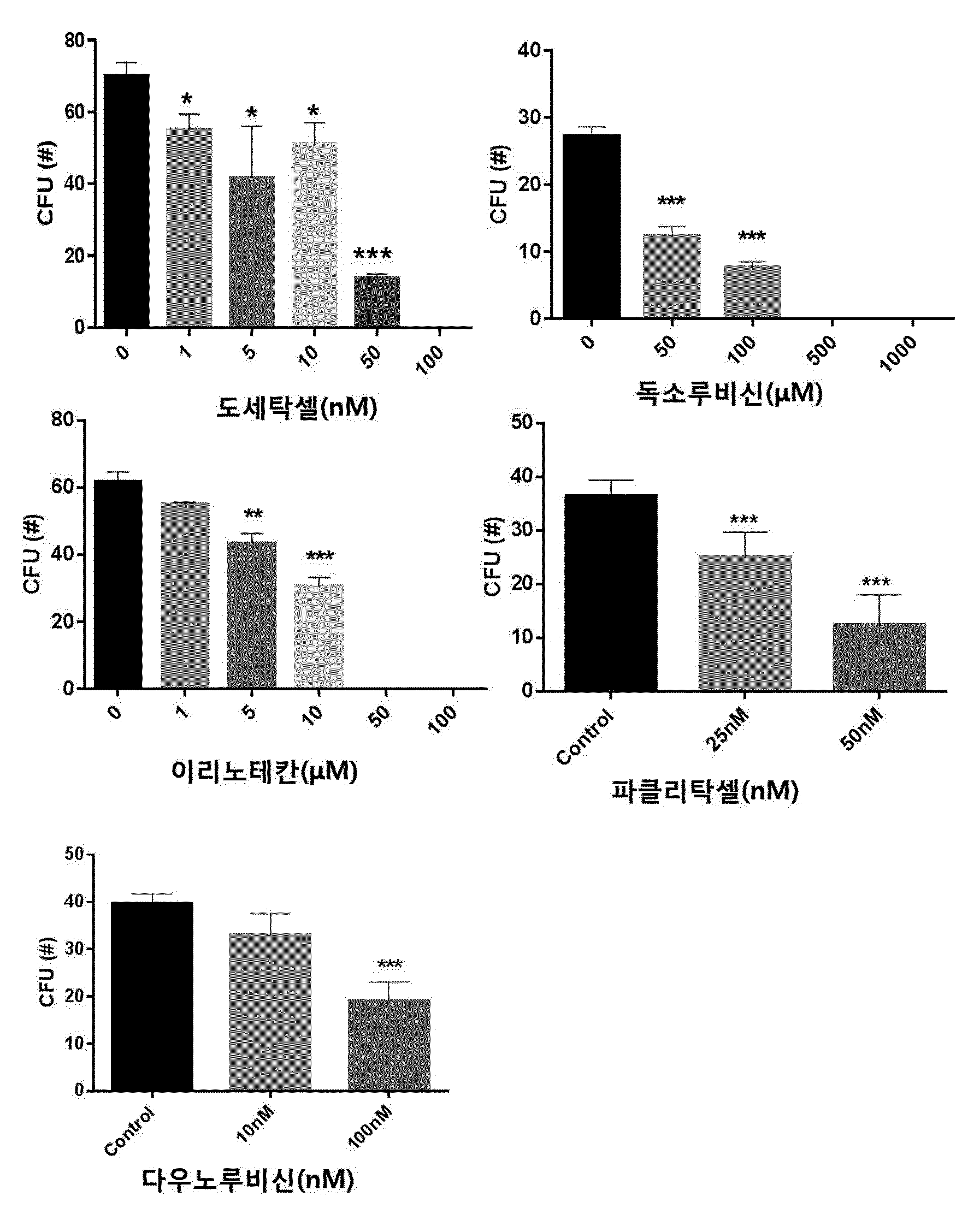
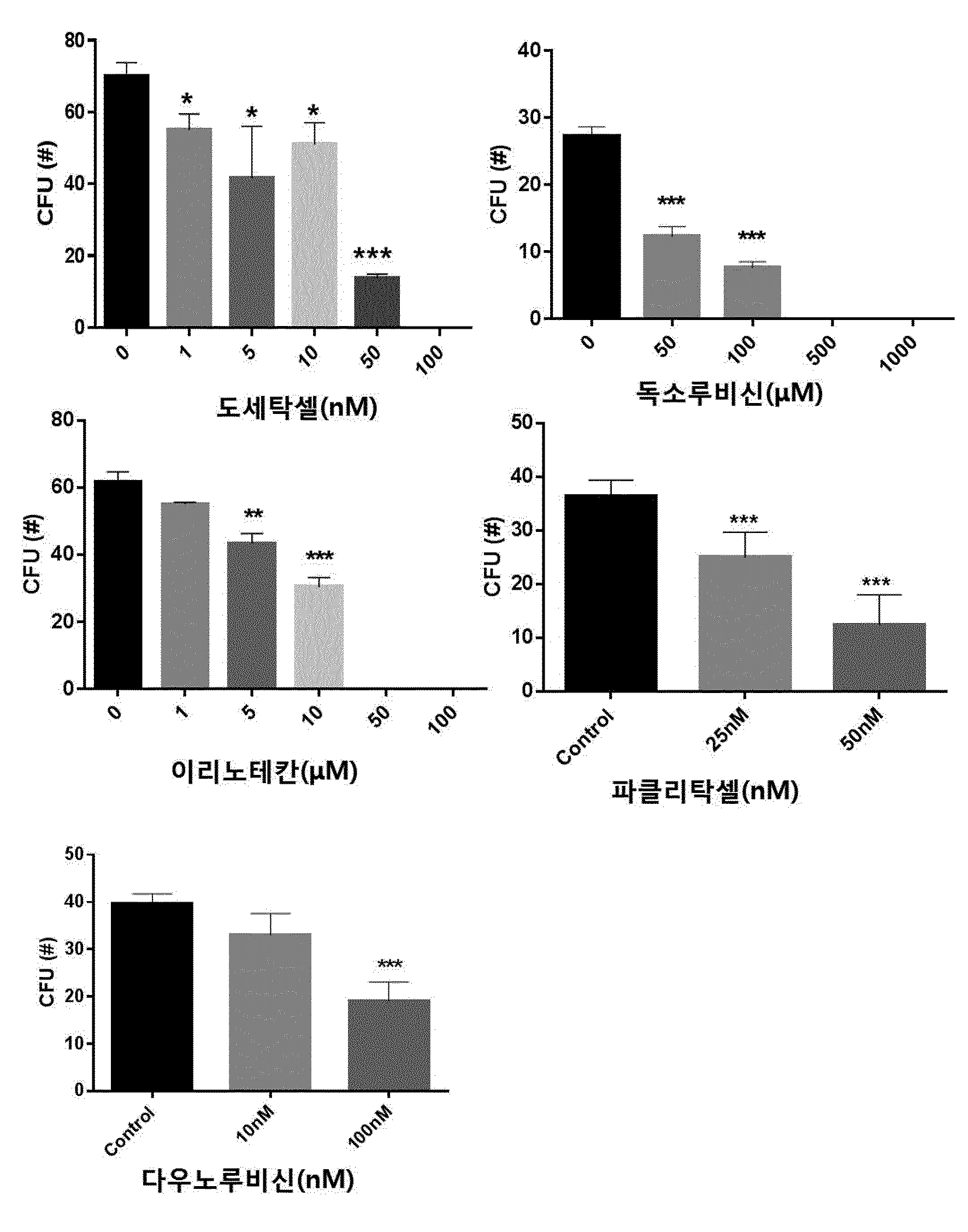
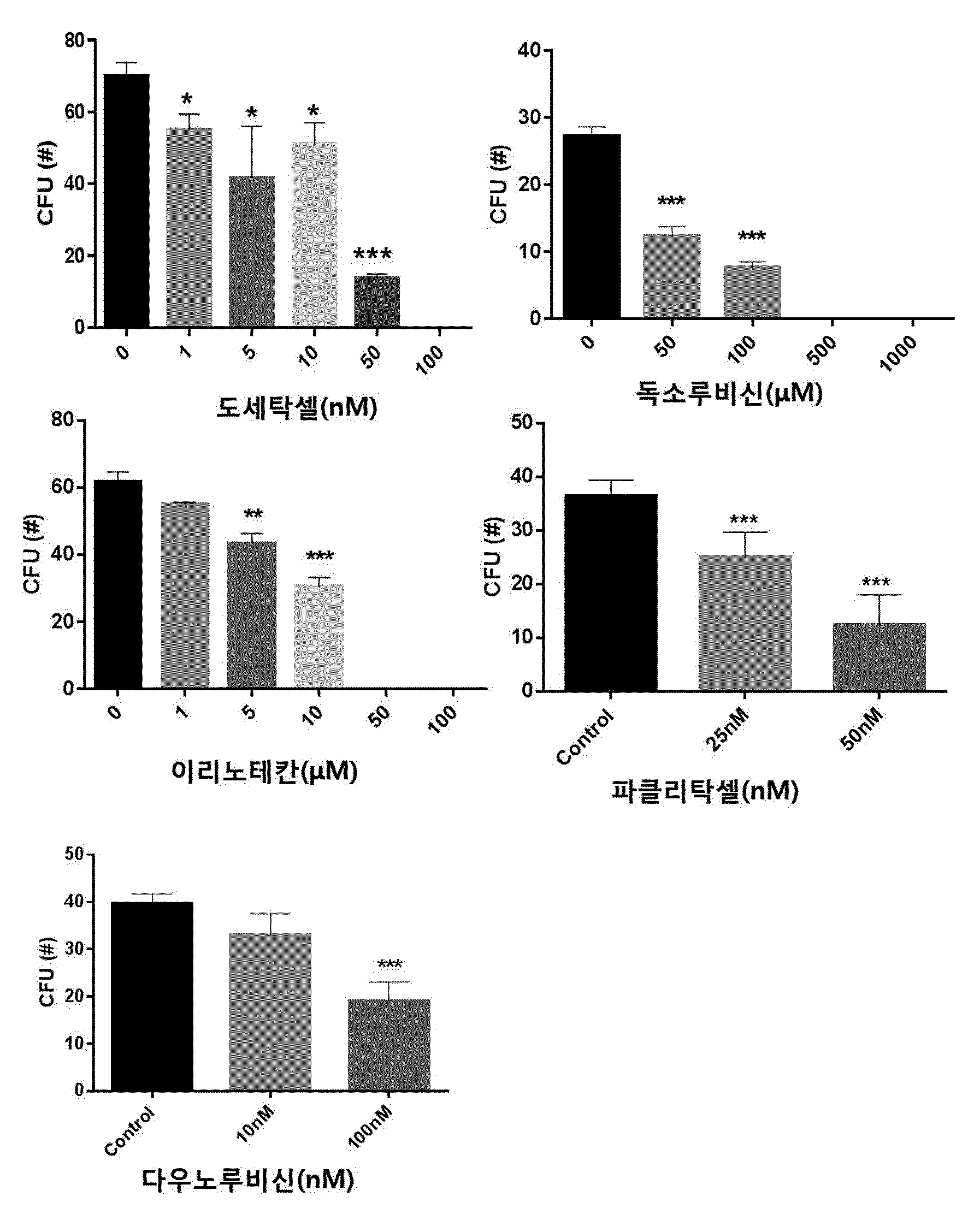
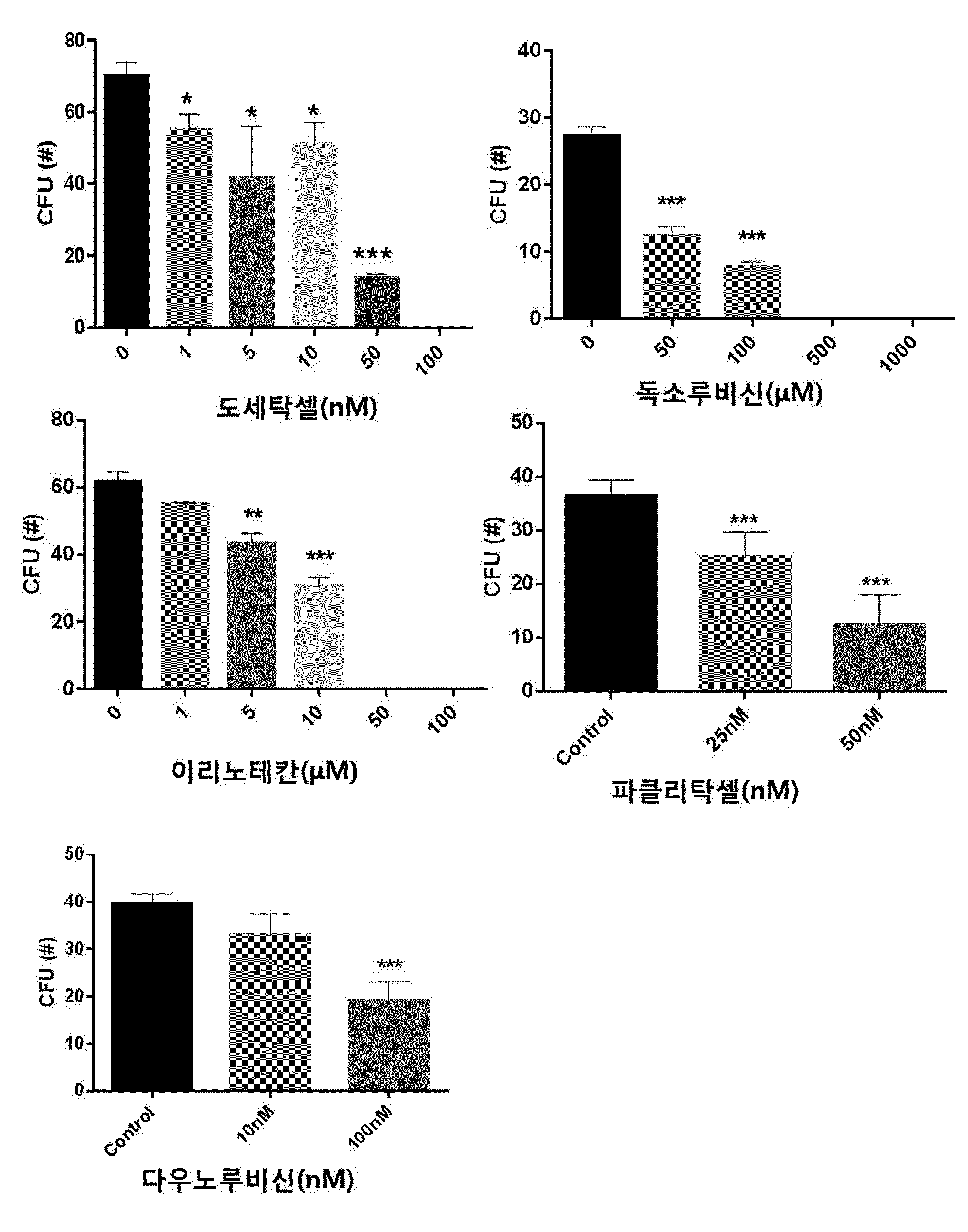
COMPOSITION CONTAINING PHRAGMITIS RHIZOMA EXTRACT AS ACTIVE INGREDIENT FOR PREVENTING, AMELIORATING, OR TREATING DISEASE ATTRIBUTED TO SIDE EFFECT OF ANTICANCER AGENT
본 발명은 노근(Phragmitis Rhizoma) 추출물을 유효성분으로 함유하는 항암제 부작용에 의한 질환의 예방, 개선 또는 치료용 조성물에 관한 것이다. 암은 국내 사망원인 1~2위를 차지하고 있으며, 국내 50대, 60대 사망자의 30%가 암으로 죽어가고 있다. 이러한 암의 치료에는 일반적으로 외과적 수술, 방사선 요법, 화학 요법이 가장 많이 활용되고 있다. 그 중 화학적 요법으로서의 항암제 개발은 다양한 시도가 많았지만,혹 현재까지 진정한 치료제로서의 항암제는 개발되지 않은 상태이고, 보조 치료제 은 단기간의 생명연장을 돕는 정도에 불과한 상태이다. 화학요법으로 사용되는 항암제는 암세포의 대사경로에 개입하여 DNA와 직접 작용하여 DNA의 복제, 전사, 번역과정을 차단하거나, 핵산 전구체의 합성을 방해하고, 세포의 분열을 저해함으로써 세포에 대한 세포독성을 나타낸다. 그러나 현재의 항암제는 암에 대한 특이적 선택성이 없어서 치료 효과와 독성효과가 동시에 나타나는 특성을 보이며, 항암제 투여로 인한 독성은 골수 파괴로 인한 백혈구, 혈소판, 적혈구 등의 혈구 감소증, 모낭 세포 파괴로 인한 탈모증상, 난소와 고환에 대한 부작용으로 월경불순 및 남성불임의 원인, 소화기의 점막 세포 파괴로 인한 부작용으로 구내염, 오심구토 및 음식 연하장애와 소화 장애, 설사증상, 세뇨관 괴사에 의한 신장 독성, 신경계 장애로 발생하는 말초 신경염과 쇠약감, 혈관 통증 및 발진 등의 혈관장애, 피부 및 손발톱 변색 등의 다양한 부작용이 나타난다. 이에, 항암제에 의한 부작용을 최소화하면서 항암치료 효과를 상승시킬 수 있는 약제의 개발이 절실한 상황이다. 한편, 노근(Phragmitis Rhizoma)은 위근이라고도 하며, 벼과 식물인 갈대( 노근의 맛은 달고 성질은 차고, 폐경(肺經) 및 위경(胃經)에 작용하는 것으로 알려져 있다. 노근의 약효로는 열을 내리고 진액을 생기게 하여 구역질을 멎게 하는 효능이 있고, 열병에 의한 구토, 식도암, 폐농양을 치료하고 복어 독을 해독하는데 사용되어왔다. 또한, 자외선 차단작용을 하고, 멜라닌 세포의 증식을 촉진하여 두발을 검고 윤기 있게 하며 미백 크림으로 사용하면 피부에 미백작용 및 영양을 공급한다고 보고되어 있다. 노근의 생리활성 연구로는 노근 추출물이 혈청 내 포도당, 인슐린 및 지질 합성에 영향을 미치는 것도 보고된 바 있고, 스트렙토조토신(streptozotocin) 투여에 의한 랑게르한스섬 A 세포 내 글루카곤 과립들의 증가를 억제하는 작용과 B 세포 내 인슐린 탈 과립을 억제하는 효과가 보고된 바 있다. 또한, 노근 메탄올 추출물이 혈중 콜레스테롤과 포도당을 낮추는 효과가 있다는 것도 알려져 있다. 노근의 근경 메탄올 추출물이 고중성지질 혈증과 고콜레스테롤 혈증 및 당뇨병성 고지혈증 흰쥐에 대하여 중성지방의 농도를 현저히 감소시키며, 메탄올 추출물에서 분리한 베타-시토스테롤(β-sitosterol)과 파라-쿠마릭산(p-coumaric acid)이 혈중 지방 농도개선 효과가 있다는 것이 알려져 있다. 노근 추출물 관련 기술로는 한국등록특허 제1098875호에 면역 증강능 및 항암능이 있는 노근 추출물의 제조방법에 대해 알려져 있으며, 한국등록특허 제1151718호에 노근 추출물을 유효성분으로 포함하는 피부 보습용, 피부염 또는 아토피 피부염 치료용 조성물에 대해 개시되어 있으나, 본 발명의 노근 추출물을 유효성분으로 함유하는 항암제 부작용에 의한 질환의 예방, 개선 또는 치료용 조성물에 대해 개시된 바 없다. 본 발명은 상기와 같은 요구에 의해 도출된 것으로서, 본 발명은 노근 추출물을 유효성분으로 함유하는 항암제 부작용에 의한 질환의 예방, 개선 또는 치료용 조성물에 관한 것으로, 상세하게는 본 발명의 노근 추출물을 항암제의 투여에 의해 조혈모세포가 감소된 마우스의 골수 세포에 처리함으로써, 현저하게 조혈모세포의 생존을 회복시키고, 항암제를 복강 주사하여 골수억제를 유도한 동물 모델에서도 항암제에 의한 골수억제가 현저하게 회복되는 것을 확인함으로써, 본 발명을 완성하였다. 상기 목적을 달성하기 위하여, 본 발명은 노근 추출물을 유효성분으로 함유하는 항암제 부작용에 의한 질환의 예방 또는 치료용 약학 조성물을 제공한다. 또한, 본 발명은 노근 추출물을 유효성분으로 함유하는 항암제 부작용에 의한 질환의 예방 또는 개선용 건강기능식품을 제공한다. 또한, 본 발명은 노근 추출물을 유효성분으로 함유하는 항암 보조제를 제공한다. 본 발명은 노근 추출물을 유효성분으로 함유하는 항암제 부작용에 의한 질환의 예방 또는 치료용 약학 조성물에 관한 것으로, 항암제에 의해 유발된 조혈모세포 콜로니의 감소를 현저하게 회복시킬 뿐만 아니라, 항암제에 의한 골수억제를 현저하게 회복시킬 수 있으므로, 본 발명의 노근 추출물을 항암제 부작용에 의한 질환의 예방 및 치료용 약학 조성물, 건강기능식품 또는 항암 보조제로 활용할 수 있다. 도 1은 항암제(도세탁셀, 독소루비신, 이리노테칸, 파클리탁셀 또는 다우노루비신)의 농도별 처리에 따른 마우스의 대퇴골(femur)로부터 분리한 골수세포의 성장 및 분화에 미치는 영향을 CFU(colony forming unit) 어세이로 확인한 결과이다. *, **, ***은 항암제를 처리하지 않은 대조군의 CFU(colony forming unit)에 비해 항암제를 처리한 것이 통계적으로 유의하게 차이가 있다는 것으로, *는 p값이 0.05 미만이고, **는 p값이 0.01 미만이며, ***는 p값이 0.001 미만임을 의미한다. 도 2는 C5BL/6 마우스에 50, 100, 150mg/kg의 도세탁셀을 복강 주사 3일 후(A)와 7일 후(B) 대퇴골(femur)로부터 골수세포 수를 확인한 결과를 나타낸 것이다. **, ***은 도세탁셀을 처리하지 않은 대조군(Veh)에 비해 도세탁셀을 처리한 것의 세포 생존률이 통계적으로 유의하게 차이가 있다는 것으로, **는 p값이 0.01 미만이고, ***는 p값이 0.001 미만임을 의미한다. 도 3은 항암제(도세탁셀, 독소루비신, 이리노테칸, 파클리탁셀 또는 다우노루비신)의 처리에 의한 마우스의 골수세포의 감소 및 상기 항암제와 본 발명의 25, 50 및 100㎍/㎖의 노근 추출물을 병용처리하여 골수세포의 감소를 억제하는 효과를 확인한 결과이다. ##, ###, ####는 항암제를 처리하지 않은 대조군(Control)에 비해 항암제를 처리한 것의 CFU가 통계적으로 유의하게 차이가 있다는 것으로, ##는 p값이 0.01 미만이며, ###는 p값이 0.001 미만이고, ####는 p값이 0.0001 미만임을 의미하고, *, **, ***은 항암제 처리군과 항암제 및 노근 추출물을 병용처리한 군의 CFU가 통계적으로 유의하게 차이가 있다는 것으로, *는 p값이 0.05 미만이며, **는 p값이 0.01 미만이고, ***는 p값이 0.001 미만임을 의미한다. 도 4는 도세탁셀의 처리에 의한 마우스 체중의 감소 및 상기 도세탁셀과 본 발명의 노근 추출물을 병용처리하여 체중감소를 억제하는 효과를 확인한 결과이다. 대조군(Control)은 아무것도 처리하지 않은 마우스이고, 도세탁셀+노근-125 및 도세탁셀+노근-250은 도세탁셀과 125 및 250㎍/㎖의 노근 추출물을 병용 투여한 마우스를 의미한다. 도 5는 도세탁셀의 처리에 의한 마우스의 골수세포의 감소 및 상기 15nM의 도세탁셀과 본 발명에 따른 125㎍/㎖ 및 250㎍/㎖의 노근 추출물을 병용처리하여 골수세포의 감소를 억제하는 효과를 확인한 결과이다. 대조군은 아무것도 처리하지 않은 군이고, 도세탁셀+노근-125 및 도세탁셀+노근-250은 도세탁셀과 125 및 250㎍/㎖의 노근 추출물을 병용 투여한 것을 의미한다. #은 도세탁셀을 처리하지 않은 대조군(Control)에 비해 도세탁셀을 처리한 것의 골수세포의 수가 통계적으로 유의하게 차이가 있다는 것으로, p값이 0.05 미만임을 의미하고, *, **은 도세탁셀 처리군과 도세탁셀 및 노근 추출물을 병용처리한 군의 골수세포의 수가 통계적으로 유의하게 차이가 있다는 것으로, *는 p값이 0.05 미만이고, **는 p값이 0.01 미만임을 의미한다. 도 6은 도세탁셀의 처리에 의한 마우스의 골수구조에 이상(화살표 부분)이 발생하지만, 도세탁셀과 본 발명에 따른 125mg/kg(노근-125) 및 250mg/kg의 노근 추출물(노근-250)을 병용처리한 후 골수세포의 이상이 거의 발생하지 않는다는 것을 H&E 염색으로 확인한 결과이다. 도 7은 흉선(thymus)의 조직병리학적 분석 결과로, 도세탁셀의 투여에 의한 조직 수축 및 기능성 림프기관의 소실을 확인하였으며(화살표 표시), 도세탁셀과 본 발명에 따른 125mg/kg(노근-125) 및 250mg/kg의 노근 추출물(노근-250)을 병용처리에 의해 조직 수축 및 기능성 림프기관의 소실이 회복되는 것을 확인한 결과이다. 도 8은 노근 추출물의 항암제 유도 골수 억제 동물모델에서의 골수 억제 완화능을 확인한 결과이다. 도세탁셀+노근-125 및 도세탁셀+노근-250은 도세탁셀과 노근 125 및 250mg/kg을 병용 투여한 것을 의미한다. *은 도세탁셀 처리군과 도세탁셀 및 125mg/kg의 노근 추출물을 병용처리한 군의 면역증진 사이토카인(immune-stimulating cytokine)인 IL-3가 통계적으로 유의하게 차이가 있다는 것으로, p값이 0.05 미만임을 의미한다. 도 9는 마우스 비장세포에서 노근 추출물의 처리에 따른 면역증진 사이토카인(immune-stimulating cytokine)의 발현량 변화를 확인한 결과이다. 본 발명은 노근(Phragmitis Rhizoma) 추출물을 유효성분으로 함유하는 항암제 부작용에 의한 질환의 예방 또는 치료용 약학 조성물에 관한 것이다. 상기 노근 추출물은 하기의 단계를 포함하는 방법에 의해 제조되는 것일 수 있으나, 이에 한정하지 않는다: 1) 노근에 추출용매를 가하여 추출하는 단계; 2) 단계 1)의 추출물을 여과하는 단계; 및 3) 단계 2)의 여과한 추출물을 감압 농축하고 건조하여 추출물을 제조하는 단계. 상기 단계 1)에서 추출용매는 물, C1~C4의 저급 알코올 또는 이들의 혼합물인 것이 바람직하지만 이에 한정하지 않는다. 상기 제조방법에 있어서, 노근 추출물의 추출은 여과법, 열수 추출, 침지 추출, 환류 냉각 추출 및 초음파추출 등 당업계에 공지된 모든 통상적인 방법을 이용할 수 있다. 상기 추출용매는 건조된 노근 부피의 1 내지 20배 첨가하여 추출하는 것이 바람직하며, 더 바람직하게는 3~10배 첨가하는 것이다. 추출온도는 20 내지 50℃인 것이 바람직하나 이에 한정하지 않는다. 또한, 추출시간은 10 내지 100시간인 것이 바람직하며, 24 내지 96시간이 더욱 바람직하고, 72시간이 가장 바람직하나 이에 한정하지 않는다. 상기 방법에 있어서, 단계 3)의 감압농축은 진공감압농축기 또는 진공회전증발기를 이용하는 것이 바람직하나 이에 한정하지 않는다. 또한, 건조는 감압건조, 진공건조, 비등건조, 분무건조 또는 동결건조하는 것이 바람직하나 이에 한정하지 않는다. 상기 암은 폐암, 유방암, 간암, 위암, 대장암, 결장암, 피부암, 방광암, 전립선암, 난소암, 자궁경부암, 갑상선암, 신장암, 섬유육종, 흑색종 및 혈액암 중에서 선택된 어느 하나의 암인 것이 바람직하지만, 이에 한정하는 것은 아니며, 진단 가능한 암이라면 제한하지 않는다. 상기 항암제는 항종양 항생제(antitumor antibiotics), 위상이성질화효소 억제제(topoisomerase inhibitor), 또는 탁산(taxane)계 항암제를 포함하나 이에 한정되지 않으며 임상, 약학, 생의학적으로 사용 가능한 모든 항암제를 포함한다. 상기 항종양 항생제는 액티노마이신 D(actinomycin D), 블레오마이신 설페이트(bleomycin sulfate), 다우노마이신(daunomycin), 다우노루비신(daunorubicin), 독소루비신(doxorubicin), 에피루비신(epirubicin), 아이다루비신(idarubicin), 미토마이신(mitomycin), 미토마이신-C(mitomycin-C) 및 미트라마이신(mitramycin)으로 이루어진 군으로부터 선택된 어느 하나 이상인 것이 바람직하며, 이에 한정되지 않는다. 상기 위상이성질화효소 억제제는 이리노테칸(irinotecan), 캠프토테신(camptothecin), 노보비오신(novobiocin), 에피루비신(epirubicin), 닥티노마이신(dactinomycin), 암사크린(amsacrine), 테니포시드(teniposide) 및 에토포시드(etoposide)으로 이루어진 군으로부터 선택된 어느 하나 이상인 것이 바람직하며, 이에 한정되지 않는다. 상기 탁산계 항암제는 파클리탁셀(paclitaxel) 또는 도세탁셀(docetaxel) 중 어느 하나 또는 둘 다인 것인 것이 바람직하다. 상기 부작용에 의한 질환은 조혈 독성, 빈혈 및 호중구 감소증으로 이루어진 군으로부터 선택되는 어느 하나 이상인 바람직하지만 이에 한정하는 것은 아니다. 본 발명의 조성물은 조성물 총 중량에 대하여 본 발명의 노근 추출물 또는 분획물을 0.1 내지 99.9중량%를 유효성분으로 함유하고, 약제학적으로 허용 가능한 담체, 부형제 또는 희석제를 포함할 수 있다. 본 발명의 조성물은 경구 또는 비경구의 여러 가지 제형일 수 있다. 제제화할 경우에는 보통 사용하는 충진제, 증량제, 결합제, 습윤제, 붕해제, 계면활성제 등의 희석제 또는 부형제를 사용하여 조제된다. 경구투여를 위한 고형 제제에는 정제, 환제, 산제, 과립제, 캡슐제 등이 포함되며, 이러한 고형 제제는 하나 이상의 화합물에 적어도 하나 이상의 부형제 예를 들면, 전분, 탄산칼슘, 수크로오스(sucrose) 또는 락토오스(lactose), 젤라틴 등을 섞어 조제된다. 또한, 단순한 부형제 이외에 스테아린산 마그네슘, 탈크 등과 같은 윤활제들도 사용된다. 경구 투여를 위한 액상 제제로는 현탁제, 내용액제, 유제, 시럽제 등이 해당되는데 흔히 사용되는 단순 희석제인 물, 리퀴드 파라핀 이외에 여러 가지 부형제, 예를 들면 습윤제, 감미제, 방향제, 보존제 등이 포함될 수 있다. 비경구 투여를 위한 제제에는 멸균된 수용액, 비수성 용제, 현탁제, 유제, 동결건조제제, 좌제가 포함된다. 비수성 용제 및 현탁 용제로는 프로필렌글리콜(propylene glycol), 폴리에틸렌 글리콜, 올리브 오일과 같은 식물성 기름, 에틸올레이트와 같은 주사 가능한 에스테르 등이 사용될 수 있다. 좌제의 기제로는 위텝솔(witepsol), 마크로골, 트윈tween) 61, 카카오지, 라우린지, 글리세로 젤라틴 등이 사용될 수 있다. 본 발명의 조성물은 경구 또는 비경구로 투여될 수 있으며, 비경구 투여 시 피부 외용 또는 복강 내, 직장, 정맥, 근육, 피하, 자궁 내 경막 또는 뇌혈관 내 주사 방식을 선택하는 것이 바람직하며, 가장 바람직하게는 피부 외용으로 사용한다. 본 발명에 따른 조성물은 약제학적으로 유효한 양으로 투여한다. 본 발명에 있어서, "약제학적으로 유효한 양"은 의학적 치료에 적용 가능한 합리적인 수혜/위험 비율로 질환을 치료하기에 충분한 양을 의미하며, 유효용량 수준은 환자의 질환의 종류, 중증도, 약물의 활성, 약물에 대한 민감도, 투여 시간, 투여 경로 및 배출 비율, 치료기간, 동시 사용되는 약물을 포함한 요소 및 기타 의학 분야에 잘 알려진 요소에 따라 결정될 수 있다. 본 발명의 조성물은 개별 치료제로 투여하거나 다른 치료제와 병용하여 투여될 수 있고 종래의 치료제와는 순차적 또는 동시에 투여될 수 있으며, 단일 또는 다중 투여될 수 있다. 상기한 요소들을 모두 고려하여 부작용없이 최소한의 양으로 최대 효과를 얻을 수 있는 양을 투여하는 것이 중요하며, 이는 당업자에 의해 용이하게 결정될 수 있다. 본 발명의 조성물의 투여량은 환자의 체중, 연령, 성별, 건강상태, 식이, 투여시간, 투여방법, 배설률 및 질환의 중증도에 따라 그 범위가 다양하며, 일일 투여량은 노근 추출물의 양을 기준으로 0.01 내지 2,000mg/kg이고, 바람직하게는 30 내지 500mg/kg이고, 더욱 바람직하게는 50 내지 300mg/kg이며, 하루 1 내지 6회 투여될 수 있다. 본 발명의 조성물은 단독으로 또는 수술, 방사선 치료, 호르몬 치료, 화학 치료 및 생물학적 반응 조절제를 사용하는 방법들과 병용하여 사용할 수 있다. 또한, 본 발명은 노근 추출물을 유효성분으로 함유하는 항암제 부작용에 의한 질환의 예방 또는 개선용 건강기능식품에 관한 것이다. 상기 노근 추출물의 추출용매는 물, C1~C4의 저급 알코올 또는 이들의 혼합물인 것이 바람직하지만 이에 한정하지 않는다. 상기 항암제는 항종양 항생제, 위상이성질화효소 억제제 또는 탁산계 항암제를 포함하나 이에 한정되지 않으며 임상, 약학, 생의학적으로 사용 가능한 모든 항암제를 포함한다. 상기 항암제의 부작용에 의한 질환은 조혈 독성, 빈혈 및 호중구 감소증으로 이루어진 군으로부터 선택되는 어느 하나 이상인 것을 특징으로 한다. 본 발명의 건강식품은 노근 추출물을 그대로 첨가하거나 다른 식품 또는 식품 성분과 함께 사용될 수 있고, 통상적인 방법에 따라 적절하게 사용될 수 있다. 상기 건강식품의 종류에는 특별한 제한은 없다. 상기 노근 추출물을 첨가할 수 있는 식품의 예로는 육류, 소시지, 빵, 초콜릿, 캔디류, 스넥류, 과자류, 피자, 라면, 기타 면류, 껌류, 아이스크림류를 포함한 낙농제품, 각종 스프, 음료수, 차, 드링크제, 알코올음료 및 비타민 복합제 등이 있으며, 통상적인 의미에서의 건강식품을 모두 포함한다. 본 발명의 조성물을 포함하는 건강 음료는 통상의 음료와 같이 여러 가지 향미제 또는 천연 탄수화물 등을 추가 성분으로서 함유할 수 있다. 상술한 천연 탄수화물은 포도당, 과당과 같은 모노사카라이드, 말토스, 슈크로스와 같은 디사카라이드, 및 덱스트린, 사이클로덱스트린과 같은 폴리사카라이드, 자일리톨, 소르비톨, 에리트리톨 등의 당알콜이다. 감미제로서는 타우마틴, 스테비아 추출물과 같은 천연 감미제나, 사카린, 아스파르탐과 같은 합성 감미제 등을 사용할 수 있다. 상기 천연 탄수화물의 비율은 본 발명의 조성물 100g당 일반적으로 약 0.01 내지 0.04g, 바람직하게는 약 0.02 내지 0.03g이다. 본 발명의 건강식품은 상기 유효성분 이외에 여러 가지 영양제, 비타민, 전해질, 풍미제, 착색제, 펙트산 및 그의 염, 알긴산 및 그의 염, 유기산, 보호성 콜로이드 증점제, pH 조절제, 안정화제, 방부제, 글리세린, 알코올, 탄산음료에 사용되는 탄산화제 등을 추가로 더 함유할 수 있다. 그 밖에 과일주스 또는 야채 음료의 제조를 위한 과육을 더 함유할 수 있다. 이러한 성분은 독립적으로 또는 혼합하여 사용할 수 있다. 이러한 첨가제의 비율은 크게 중요하진 않지만 본 발명의 조성물 100 중량부에 대하여, 0.01 내지 2 중량부의 범위에서 선택되는 것이 일반적이다. 또한, 본 발명은 노근 추출물을 유효성분으로 함유하는 항암 보조제에 관한 것이다. 상기 항암 보조제는 항암제 투여에 의해 유발되는 조혈 독성, 빈혈 및 호중구 감소증 중에서 선택된 하나 이상의 항암제 부작용을 억제하는 것이 특징이다. 상기 항암 보조제는 노근 추출물에 추가로 동일 또는 유사한 기능을 나타내는 유효성분을 1종 이상을 함유할 수 있다. 상기 항암 보조제는 임상 투여 시에 경구 또는 비경구로 투여가 가능하며, 비경구 투여 시 복강 내 주사, 직장 내 주사, 피하주사, 정맥주사, 근육 내 주사, 자궁 내 경막주사, 뇌혈관 내 주사 또는 흉부 내 주사에 의해 투여될 수 있고, 일반적인 의약품 제제의 형태로 사용될 수 있다. 상기 항암 보조제는 단독으로, 또는 수술, 방사선 치료, 호르몬 치료, 화학 치료 및 생물학적 반응 조절제를 사용하는 방법들과 병용하여 사용할 수 있다. 상기 항암 보조제의 일일 투여량은 약 0.0001 내지 100㎎/㎏이고, 바람직하게는 0.001 내지 10㎎/㎏이며, 하루 1회 내지 수회 나누어 투여하는 것이 바람직하나 환자의 체중, 연령, 성별, 건강상태, 식이, 투여시간, 투여 방법, 배설률 및 질환의 중증도 등에 따라 그 범위가 다양하다. 본 발명의 항암 보조제는 실제 임상 투여 시에 비경구의 여러 가지 제형으로 투여될 수 있는데, 제제화할 경우에는 보통 사용하는 충진제, 증량제, 결합제, 습윤제, 붕해제, 계면활성제 등의 희석제 또는 부형제를 사용하여 조제된다. 비경구 투여를 위한 제제에는 멸균된 수용액, 비수성용제, 현탁제, 유제, 동결건조제제, 좌제가 포함된다. 비수성용제, 현탁용제로는 프로필렌글리콜(Propylene glycol), 폴리에틸렌 글리콜, 올리브 오일과 같은 식물성 기름, 에틸올레이트와 같은 주사 가능한 에스테르 등이 사용될 수 있다. 좌제의 기제로는 위텝솔(witepsol), 마크로골, 트윈(tween) 61, 카카오지, 라우린지, 글리세로제라틴 등이 사용될 수 있다. 이하, 실시예를 이용하여 본 발명을 더욱 상세하게 설명하고자 한다. 이들 실시예는 오로지 본 발명을 보다 구체적으로 설명하기 위한 것으로 본 발명의 범위가 이들에 의해 제한되지 않는다는 것은 당해 기술분야에서 통상의 지식을 가진 자에게 있어 자명한 것이다. 실시예 1. 노근 추출물의 제조 본 발명의 유효성분인 노근 추출물 제조하기 위하여, 노근을 광명당제약(울산, 대한민국)으로부터 구입하였다. 상기 구입한 노근 100g을 분쇄한 후, 물 2ℓ와 함께 둥근 플라스크에 넣어 혼합하였다. 냉각관이 부착된 환류추출장치에 연결된 항온수조(water bath)를 가열하여 1회 2시간 씩, 총 2회 반복추출하였다. 추출된 추출물을 종이여과지(Whatman No.2)와 진공펌프(Vacuum pump, GAST)를 사용하여 감압 여과하였다. 회전농축기(Rotary evaporator, EYELA)를 이용하여 여과된 액상추출물을 감압 농축하고, 농축된 추출물을 동결건조한 후, 막자사발로 균질화하여 노근 추출물을 수득하였다. 이는 실험 전까지 밀봉 플라스틱 용기에 담아 4℃ 저온 저장소에 보관하였다. 실시예 2. 항암제의 조혈 독성 확인 현재 임상에서 이용되고 있는 항암제의 조혈독성 효과를 확인하기 위하여, 항암제 농도에 따른 마우스 골수세포에서 조혈모세포의 성장 및 분화에 미치는 영향을 1)마우스의 골수세포에서 항암제의 조혈독성 효과 확인( 마우스의 대퇴골(femur)로부터 골수 세포를 분리하였다. 그리고 나서, 도세탁셀, 독소루비신, 이리노테칸, 파클리탁셀 및 다우노루비신이 농도별로 첨가된 쥐 유래의 재조합 줄기 세포 인자(recombinant murine stem cell factor, rm stem cell factor), rm IL-3, 인간 유래의 재조합 IL-6(recombinant human IL-6, rh IL-6) 및 rh 에리스로포이에틴(rh Erythropoietin)을 포함하는 메도컬트 GF M3434(methocult GF M3434) 배지에 상기 골수 세포를 7~10일간 배양하여 조혈모세포의 성장을 유도하였다. 성장한 조혈모세포를 수득하고, 콜로니 형성 유닛 분석(Colony Formin Unit assay, CFU assay)를 수행하여 항암제가 조혈모세포의 성장 및 분화에 미치는 영향을 관찰하였다. 그 결과, 도 1에 개시한 바와 같이 낮은 농도에서도 조혈독성이 나타났고, 특히, 도세탁셀은 50nM 이상에서, 독소루비신은 50μM 이상에서, 이리노테칸은 5μM 이상에서, 파클리탁셀은 25nM 이상에서, 다우노루비신은 100nM 이상에서는 조혈독성이 매우 심하게 나타나는 것을 확인할 수 있었다. 2) 항암제가 복강 주사된 마우스에서 조혈독성 효과 확인( C57BL/6 마우스에 50, 100 및 150㎎/㎏의 도세탁셀을 복강 주사하였다. 3일 후와 7일 후, 마우스의 대퇴골로부터 골수 세포를 분리하여 계수하고, 생존율을 측정하였다. 그 결과, 도 2에 나타난 바와 같이 50, 100 및 150㎎/㎏의 도세탁셀을 주사한 모든 경우, 3일 후와 7일 후, 분리한 골수세포의 수가 유의하게 감소함으로써, 실시예 3. 항암제에 의해 유도된 골수 독성에 대하여 노근 추출물의 골수 독성을 회복하는 효과 확인 노근 추출물이 골수 세포에서 항암제(15nM 도세탁셀, 100nM 독소루비신, 100μM 이리노테칸, 50nM 파클리탁셀 및 100nM 다우노루비신)에 의해 유도된 조혈독성을 완화하는 효과가 있는지를 확인하기 위하여, 15nM 도세탁셀, 100nM 독소루비신, 100μM 이리노테칸, 50nM 파클리탁셀 또는 100nM 다우노루비신과 노근 추출물을 병용 처리하여 골수 독성의 완화효과를 확인하였다. 구체적으로, 마우스의 대퇴골로부터 골수 세포를 분리한 후, 쥐 유래의 재조합 줄기 세포 인자, rm IL-3, 인간 유래의 재조합 IL-6 및 rh 에리스로포이에틴을 포함하는 메도컬트 GF M3434 배지에 골수 세포의 조혈독성을 유발하는 15nM의 도세탁셀 등의 항암제들을 처리하였다. 이후, 상기 실시예 1에서 제조한 25, 50 및 100㎍/㎖의 노근 추출물을 각각 첨가하고, 7일 동안 배양하면서 조혈모세포의 성장을 유도하였다. 7일 후, 성장한 조혈모세포를 수득하여, CFU 분석을 수행하여 조혈모세포의 성장을 확인하였다. 음성 대조군으로, 노근 추출물 대신 0.5% DMSO가 포함된 PBS를 용매(vehicle)로서 처리하고 상기와 동일한 방법을 수행하였다. 그 결과, 도 3에 나타난 바와 같이 노근 추출물에 의해 각각의 항암제로부터 유발된 조혈모세포 콜로니의 감소가 통계적으로 유의하게 회복되는 것을 확인하였다(도 3). 실시예 4. 노근 추출물의 도세탁셀 유도 골수 억제 동물 모델에서의 골수 억제 완화능 확인 노근 추출물이 골수억제 유도 동물 모델에서 조혈독성 완화 효과를 나타내는지 확인하기 위하여, 마우스에 도세탁셀을 복강주사하여 골수 억제를 유도한 후, 노근 추출물에 의한 변화를 확인하였다. 구체적으로, C57BL/6 마우스를 4개의 그룹으로 구별하였는데, 그룹 1은 대조군(control)로서, 5% 에탄올과 2% 폴리소르베이트 80(polysorbate 80)을 포함하는 염수(saline)를 처리한 군이고, 그룹 2는 30mg/kg의 도세탁셀을 3번 복강 내 투여한 도세탁셀 처리군이고, 그룹 3은 도세탁셀을 투여하기 이틀 전부터 125mg/kg의 노근 추출물을 1일 1회 강제투여하고, 도세탁셀 투여하는 3일 동안에도 1일 1회 노근 추출물을 강제 투여한 도세탁셀 및 125mg/kg의 노근 추출물의 투여군이며, 그룹 4는 상기 그룹 3과 동일한 방법으로, 도세탁셀을 투여하기 이틀 전부터 250mg/kg의 노근 추출물을 1일 1회 투여하고, 도세탁셀 투여하는 3일 동안에도 1일 1회 250mg/kg의 노근 추출물을 강제투여한 도세탁셀 및 250mg/kg의 노근 추출물의 투여군이다. 이후, 상기 대조군, 도세탁셀 투여군, 도세탁셀과 125mg/kg의 노근 추출물 병용 투여군 및 도세탁셀과 250mg/kg의 노근 추출물 병용 투여군의 마우스의 체중 변화를 매일 측정한 후, 6일 째 마우스를 해부하여, 골수 내 세포수 변화 및 조혈작용에 중요한 역할을 하는 비장(spleen) 및 흉선(thymus)의 무게를 측정하였다. 그 결과, 도 4 및 도 5에 나타난 바와 같이 마우스에 도세탁셀을 투여한 경우, 조혈독성 및 골수억제와 함께 체중의 유의한 감소가 유도되었으나, 노근 추출물을 병용 투여한 경우, 체중 감소가 완화되었고(도 4), 도세탁셀 투여군에서 대조군과 유의하게 골수세포(Bone marrow mononuclear cells) 수가 감소하였고, 노근 추출물을 투여한 군에서 골수 억제가 회복되는 것을 확인하였다(도 5). 상기 각 투여군의 마우스 대퇴골의 조직학적 분석을 수행한 결과, 도세탁셀 단독 투여군에서는 조혈 세포들의 감소로 인한 저세포 충실도(hypocellularity) 현상 및 골수 내 세포구조의 이상(노란 화살표 표시)가 발견되었으나, 노근 추출물의 병용 투여군에서는 이러한 현상이 감소되었음을 확인하였고(도 6), 흉선(Thymus)의 조직병리학적 분석 결과도 도세탁셀 투여에 의한 조직 수축 및 기능성 림프 기관의 소실이 노근 병용 투여에 의해 회복되는 것이 관찰되었다(도 7). 또한, 도세탁셀을 투여한 마우스의 경우, 조혈 작용에 관여하는 체내 기관인 비장(spleen)과 흉선(thymus)의 이상을 초래하여 급격한 무게의 감소로 인한 기관 인덱스(organ index)의 감소가 나타났으나, 도세탁셀과 노근 추출물을 병용 투여한 군에서는 조직 인덱스의 감소가 완화되는 것을 확인하였다. 기관 인덱스(organ index, mg/g) = 기관의 무게(mg)/개체의 무게(g) 도세탁셀 투여군에서는 조혈작용에 관여하는 생체기관인 비장 및 흉선의 수축, 및 무게 감소가 관찰되었으며, 노근 추출물 투여군에서는 이러한 감소가 완화되는 효과를 확인하였다(표 1). 한편, 마우스의 비장(spleen) 조직으로부터 mRNA를 수득하여 조혈작용에 관여하는 사이토카인의 발현 변화를 확인하였다. 도세탁셀 투여에 의해 조혈작용(hematopoiesis), 특히 골수성 전구세포(myeloid progenitor cell)의 분화와 증식에 깊이 관여하는 IL-3의 발현이 크게 감소하였으며, 도세탁셀과 노근 추출물을 병용 투여하는 경우, 감소된 IL-3의 발현을 회복시키는 것을 확인하였다(도 8). 실시예 5. 노근 추출물이 마우스 비장세포에서 면역-증진 사이토카인(immune-stimulatingcytokine)에 미치는 영향 확인( 노근 추출물이 골수억제 유도 동물 모델에서 조혈작용에 관여하는 사이토카인의 발현에 미치는 영향을 확인하기 위하여, 마우스에 도세탁셀을 복강주사하여 골수 억제를 유도한 후, 노근 추출물에 의한 변화를 확인하였다. 구체적으로, C57BL/6 마우스를 5개의 그룹으로 구별하였는데, 그룹 1의 대조군(Control)은 5% 에탄올과 2% 폴리소르베이트 80(polysorbate 80)을 포함하는 염수(saline)를 처리한 군이고, 그룹 2는 30mg/kg의 도세탁셀을 3번 복강 내 투여한 도세탁셀 처리군이고, 그룹 3은 도세탁셀을 투여하기 이틀 전부터 125mg/kg의 노근 추출물을 1일 1회 강제투여하고, 도세탁셀 투여하는 3일 및 이후 3일 동안에도 1일 1회 노근 추출물을 강제 투여한 도세탁셀 및 125mg/kg의 노근 추출물의 투여군이며, 그룹 4는 상기 그룹 3과 동일한 방법으로, 도세탁셀 및 250mg/kg의 노근 추출물의 투여군, 그룹 5는 역시 동일한 방법으로 도세탁셀 및 500mg/kg의 노근 추출물의 투여군이다. 상기 동물에서 비장조직을 수득하여, mRNA를 추출한 후, 조혈작용에 관여하는 사이토카인의 발현변화를 확인한 결과, 조혈모세포의 분화와 증식을 촉진하는 사이토카인인 IL-3, IL-6, SCF(stem cell factor) 및 GM-CSF(Granulocyte-macrophage colony-stimulating factor)의 발현 증가를 확인하였다(도 9). 실시예 6. 노근 추출물이 도세탁셀 유도 골수 억제 동물 모델에서 미치는 영향 확인 노근 추출물이 골수억제 유도 동물 모델의 혈액지표에 미치는 영향을 확인하기 위하여, 마우스에 도세탁셀을 복강주사하여 골수 억제를 유도한 후, 노근 추출물에 의한 변화를 확인하였다. 구체적으로, C57BL/6 마우스를 5개의 그룹으로 구별하였는데, 그룹 1의 대조군(control)은 5% 에탄올과 2% polysorbate 80을 포함하는 염수(saline)을 처리한 군이고, 그룹 2는 30mg/kg의 도세탁셀을 3번 복강 내 투여한 도세탁셀 처리군이고, 그룹 3은 도세탁셀을 투여하기 이틀 전부터 30mg/kg의 노근 추출물을 1일 1회 강제투여하고, 도세탁셀 투여하는 3일 및 이후 3일 동안에도 1일 1회 노근 추출물을 강제 투여한 도세탁셀 및 30mg/kg의 노근 추출물의 투여군이며, 그룹 4는 상기 그룹 3과 동일한 방법으로, 도세탁셀 및 100mg/kg의 노근 추출물의 투여군, 그룹 5는 역시 동일한 방법으로 도세탁셀 및 300mg/kg의 노근 추출물의 투여군이다. 상기 동물에서 혈액을 채취하여 혈구세포 수의 변화를 확인한 결과, 도세탁셀 투여군에서는 백혈구, 호중구, 림프구 및 적혈구의 감소가 확인되었으며, 노근추출물의 병용투여군에서는 이의 회복이 관찰되었다. 상기 표 2의 데이터는 10마리의 마우스로부터 획득 값의 평균±표준오차(SEM)를 나타내며,#, p<0.05,##, p<0.01 vs. 도세탁셀 처리군을 의미한다. The present invention relates to a composition containing a Phragmitis Rhizoma extract as an active ingredient for preventing, ameliorating, or treating diseases attributed to side effects of anticancer agents. In the present invention, it was revealed that when mouse myelocytes were treated with a Phragmitis Rhizoma extract, hematopoietic stem cell colonies remarkably recovered from a reduced state caused by an anticancer agent and that an animal model in which bone marrow repression had been induced by the intraperitoneal injection of an anticancer agent remarkably recovered from the anticancer agent-induced bone marrow repression. Accordingly, the Phragmitis Rhizoma extract of the present invention can be usefully used in a composition for the prevention, amelioration, and treatment of diseases attributed by side effects of anticancer agents, and may increase the effect of an anticancer agent when administered as an anticancer agent aid in combination with the anticancer agent. 노근(Phragmitis Rhizoma) 추출물을 유효성분으로 함유하는 항암제 부작용에 의한 질환의 예방 또는 치료용 약학 조성물. 제1항에 있어서, 상기 추출물은 물, C1~C4의 저급 알코올 또는 이들의 혼합물을 용매로 하여 추출하는 것을 특징으로 하는 항암제 부작용에 의한 질환의 예방 또는 치료용 약학 조성물. 제1항에 있어서, 상기 항암제는 항종양 항생제(antitumor antibiotics), 위상이성질화효소 억제제(topoisomerase inhibitor), 또는 탁산(taxane)계 항암제인 것을 특징으로 하는 항암제 부작용에 의한 질환의 예방 또는 치료용 약학 조성물. 제3항에 있어서, 상기 항종양 항생제(antitumor antibiotics)는 액티노마이신 D(actinomycin D), 블레오마이신 설페이트(bleomycin sulfate), 다우노마이신(daunomycin), 다우노루비신(daunorubicin), 독소루비신(doxorubicin), 에피루비신(epirubicin), 아이다루비신(idarubicin), 미토마이신(mitomycin), 미토마이신-C(mitomycin-C) 및 미트라마이신(mitramycin)으로 이루어진 군으로부터 선택된 어느 하나 이상인 것을 특징으로 하는 항암제 부작용에 의한 질환의 예방 또는 치료용 약학 조성물. 제3항에 있어서, 상기 위상이성질화효소 억제제(topoisomerase inhibitor)는 이리노테칸(irinotecan), 캠프토테신(camptothecin), 노보비오신(novobiocin), 에피루비신(epirubicin), 닥티노마이신(dactinomycin), 암사크린(amsacrine), 테니포시드(teniposide) 및 에토포시드(etoposide)으로 이루어진 군으로부터 선택된 어느 하나 이상인 것을 특징으로 하는 항암제 부작용에 의한 질환의 예방 또는 치료용 약학 조성물. 제3항에 있어서, 상기 탁산(taxane)계 항암제는 파클리탁셀(paclitaxel) 및 도세탁셀(docetaxel) 중에서 선택된 어느 하나 이상인 것을 특징으로 하는 항암제 부작용에 의한 질환의 예방 또는 치료용 약학 조성물. 제1항에 있어서, 상기 항암제 부작용에 의한 질환은 조혈 독성, 빈혈 및 호중구 감소증 중에서 선택된 하나 이상인 것을 특징으로 하는 항암제 부작용에 의한 질환의 예방 또는 치료용 약학 조성물. 노근 추출물을 유효성분으로 함유하는 항암제 부작용에 의한 질환의 예방 또는 개선용 건강기능식품. 노근 추출물을 유효성분으로 함유하는 항암 보조제. 제9항에 있어서, 상기 항암 보조제는 항암제 투여에 의해 유발되는 조혈 독성, 빈혈 및 호중구 감소증 중에서 선택된 하나 이상의 항암제 부작용에 의한 질환을 개선하는 것을 특징으로 하는 항암 보조제.Spleen index(mg/g) Thymus index(mg/g) 대조군 3.111±0.58 2.360±0.28 도세탁셀 2.366±0.22 0.911±0.22 도세탁셀+노근-125 3.004±0.25 1.721±0.07 도세탁셀+노근-250 2.842±0.27 1.842±0.49 백혈구(WBCs) 호중구(Neutrophile) 림프구(Lymphocyte) 적혈구(RBCs) 대조군 3.44±0.24 0.48±0.02 2.88±0.23 9.11±0.18 도세탁셀군 2.09±0.19 0.30±0.01 1.56±0.22 7.72±0.15 도세탁셀+노근(30mg/kg) 2.52±0.15 0.47±0.06## 1.83±0.10 8.04±0.13 도세탁셀+노근(100mg/kg) 2.59±0.13# 0.41±0.06 2.09±0.10# 7.88±0.13 도세탁셀+노근(300mg/kg) 2.84±0.30 0.42±0.07 2.22±0.25 8.11±0.18